Die chemischen Bindungen zwischen einer Phosphat-Gruppe und einem C- oder O-Atom einer organischen Verbindung haben durchaus unterschiedliche Bindungsdissoziationsenergien. Dies wird im Chemie- oder Biologie-Unterricht der gymnasialen Oberstufe oft übersehen.
Schauen uns wir die vier für den katabolischen Stoffwechsel wichtigsten Phosphatbindungen einmal unter dem Energieaspekt näher an.
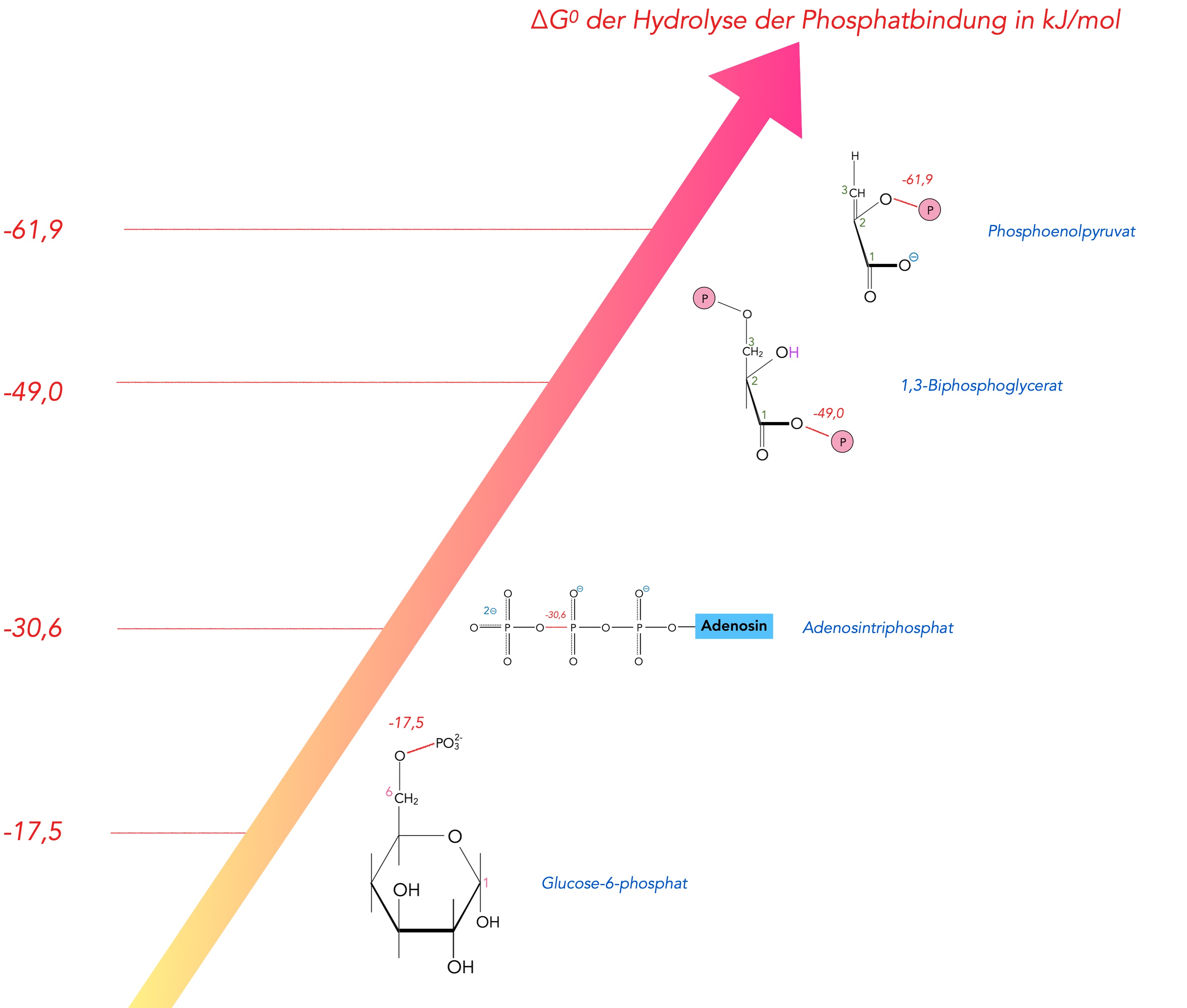
Bindungsdissoziationsenergie verschiedener Phosphat-Bindungen mit O-Atomen.
Autor: Ulrich Helmich 05/2025, Lizenz: Public domain
Dieses Bild, das in Anlehnung an die Abb. 2.49 aus dem neuen Lehrbuch von Alberts et al (2025) angefertigt wurde, zeigt den Energiegehalt verschiedener Phosphat-Sauerstoff-Bindungen.
Betrachten wir zunächst das bekannteste Molekül, das Adenosintriphosphat, besser als ATP bekannt. Die P-O-Bindung, mit der die äußere Phosphatgruppe an die beiden inneren Phosphatgrupen gebunden sind, hat einen ΔG0-Wert von -30,6 kJ/mol. Das soll nun unser Referenzwert sein.
Im ersten Schritt der Glyolyse wird eine Phosphatgruppe vom ATP auf Glucose übertragen. Der ΔG0-Wert dieser neuen Bindung beträgt nur -17,5 kJ/mol. Das erklärt, warum diese Reaktion exotherm ist und so leicht abläuft.
In der Glycolyse wird in dem Schritt 6 ein ATP-Molekül aus ADP und Pi gewonnen:
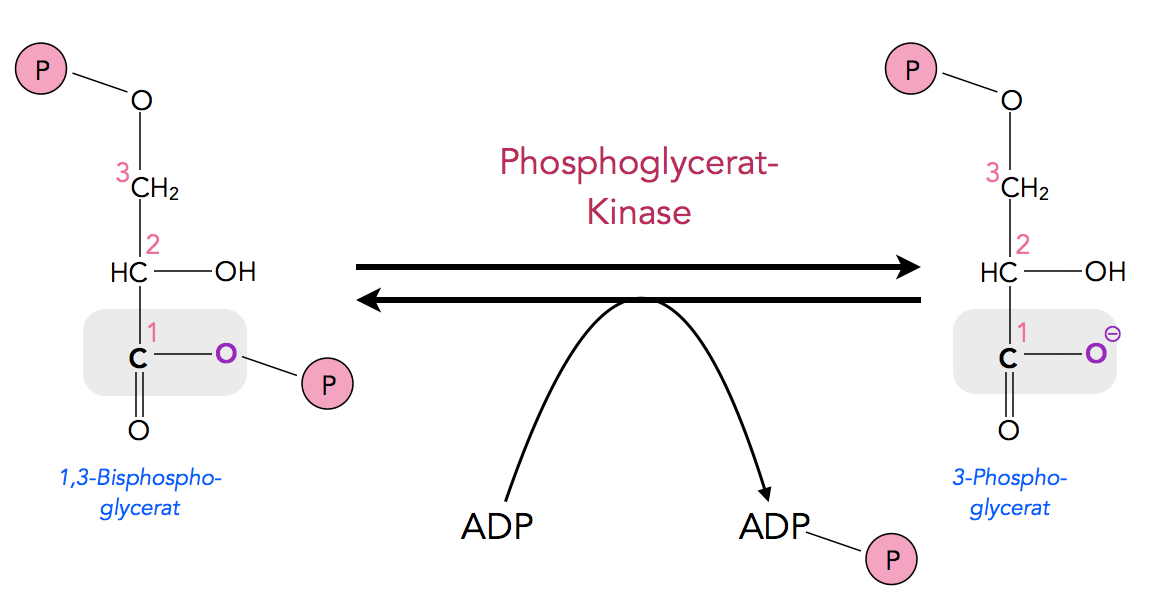
Der Schritt 6 der Glycolyse
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Diese Reaktion ist exotherm, denn die Bindungsdissoziationsenergie der relevanten O-P-Bindung des 1,3-Bisphosphoglycerats hat einen Wert von -49,0 kJ/mol. Das ist erheblich mehr, als zur Bildung eines ATP-Moleküls (30,6 kJ/mol) erforderlich ist.
Auch im letzten Schritt der Glycolyse wird ATP gewonnen:
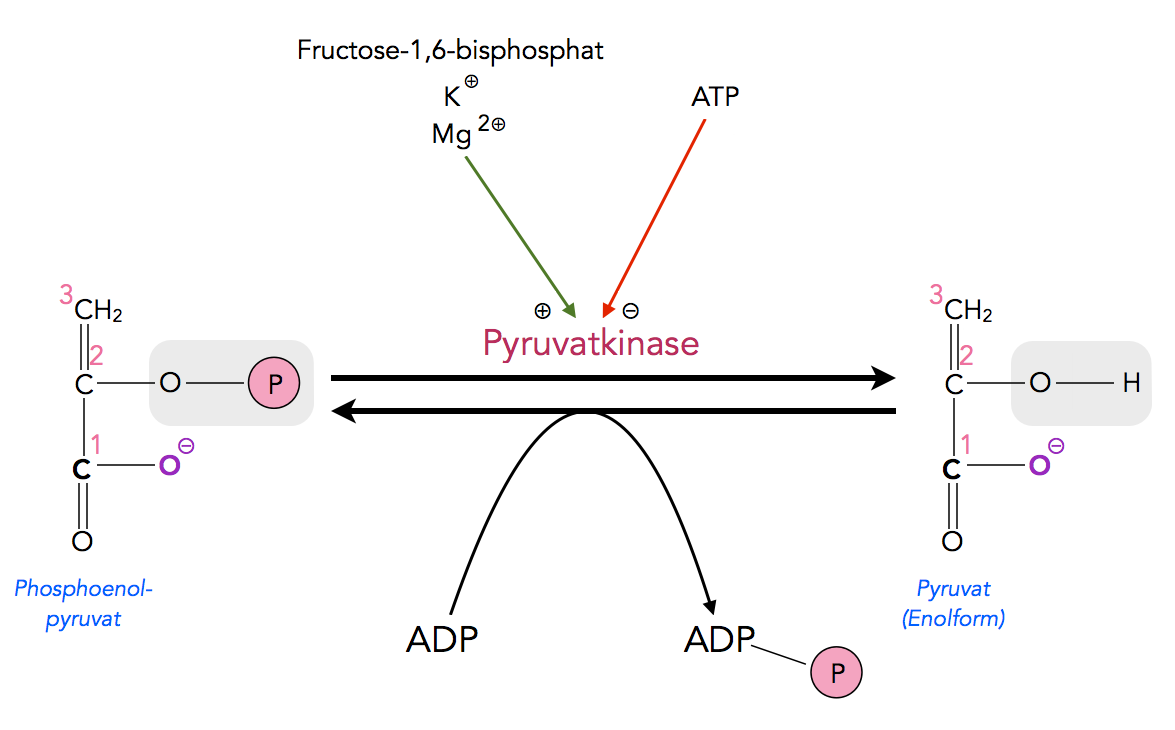
Der Schritt 9 der Glycolyse
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Die relevante O-P-Bindung des Phosphoenolpyruvats hat eine noch höhere Bindungsdissoziationsenergie, nämlich -61,9 kJ/mol. Rein theoretisch könnten damit sogar zwei Einheiten ATP gebildet werden.
Quellen:
- Alberts et al. Molekularbiologie der Zelle, 7. Auflage, Weinheim 2025.