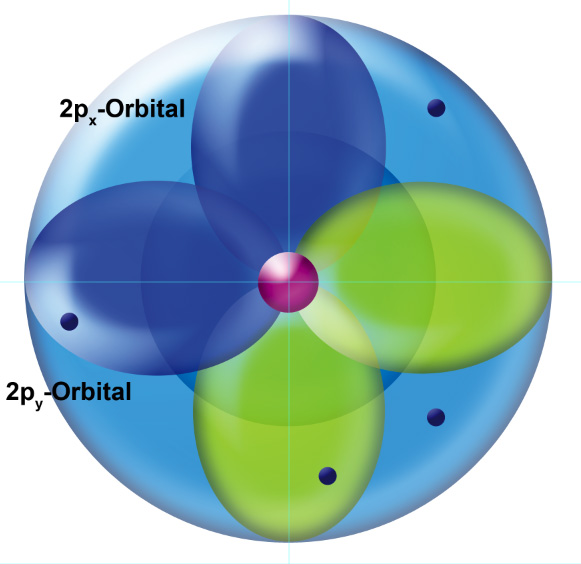
Das C-Atom im Orbitalmodell
Diese Zeichnung kennen Sie bereits aus dem einführenden Abschnitt, als Sie die Grundlagen des Orbitalmodells gelernt haben. Die Außenelektronen des C-Atoms befinden sich in drei unterschiedlichen Orbitalen. Das 2s-Orbital, kugelförmig, enthält zwei Außenelektronen und ist damit eigentlich vollbesetzt. Die zwei 2p-Orbitale enthalten je ein Elektron, das dritte p-Orbital ist leer bzw. gar nicht vorhanden (das ist Ansichtssache). Jedenfalls ist das 2px-Orbital einfach besetzt, und das 2py-Orbital ebenfalls.
Während das 2s-Orbital also "gesättigt" ist, chemisch quasi "zufrieden" ist, sind die beiden p-Orbitale "ungesättigt", sie haben radikalischen Charakter, und das dritte p-Orbital ist ebenfalls "unzufrieden", da es überhaupt kein Elektron besitzt. Kohlenstoff sollte also eine ziemlich reaktionsfreudige Substanz sein, wegen der unbesetzten bzw. einfach besetzten Orbitale.
Das Methan im Orbitalmodell
Die einfachste organische Kohlenstoff-Verbindung ist das Methan, das bekanntlich die Summenformel CH4 hat. Das Kugelwolkenmodell kann diese Summenformel sehr gut erklären, weil das C-Atom nach dem Kugelwolkenmodell ja vier tetraedrisch angeordnete, jeweils einfach besetzte Kugelwolken auf der L-Schale hat. Jede dieser Kugelwolken kann nun mit einem H-Atom überlappen und so das tetraedrisch aufgebaute Methan-Molekül bilden.
Nach dem Orbitalmodell müsste das Methan eine ganz andere Struktur haben. Sogar eine ganz andere Summenformel, nämlich CH2. Warum gerade diese Formel?
Von den vier Außenelektronen halten sich zwei in dem 2s-Orbital auf. Dieses Orbital ist doppelt besetzt und somit "zufrieden gestellt". Es hat keinen "Drang" mehr, chemische Reaktionen einzugehen und sich dabei mit anderen Orbitalen zu verbinden. Lediglich die beiden einfach besetzten p-Orbitale stehen für chemische Reaktionen zur Verfügung. Jedes dieser beiden p-Orbitale könnte nun mit dem 1s-Orbital eines H-Atoms überlappen und dabei eine kovalente Bindung bilden. Aber was bei dieser chemischen Reaktion herauskäme, wäre kein CH4 mehr, sondern die Verbindung CH2.
Wäre das C-Atom so aufgebaut, wie das Orbitalmodell es verlangt, hätte dieses Methan-Molekül sogar eine ganz andere Raumstruktur. Die beiden p-Orbitale stehen nämlich in einem 90-Grad-Winkel zueinander. Folglich müssten auch die beiden H-Atome des CH2-Moleküls einen rechten Winkel bilden:
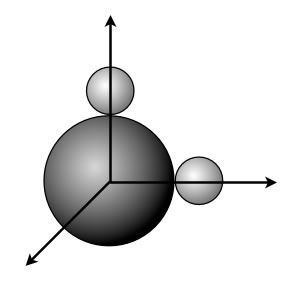
So wie in dieser Abbildung müsste das Methan-Molekül CH2 eigentlich aussehen.
Aus der praktischen Chemie wissen wir aber mit 100%iger Sicherheit, dass Methan die Summenformel CH4 hat und dass die vier H-Atome tetraedrisch um das C-Atom herum angeordnet sind. Einen 90-Grad-Winkel hat man bisher noch nicht gefunden.
Das Konzept der Hybridisierung
Was also tun? - sprach Zeus. Die Chemiker, die sich mit der oben erläuterten Fragestellung beschäftigten, hatten ein Problem. Nämlich einen Widerspruch zwischen dem Orbitalmodell einerseits und den experimentellen Befunden zur Methanstruktur andererseits.
Was macht man, wenn man sich in einer solchen Situation befindet? Man überarbeitet das Modell so, dass es die experimentellen Befunde erklären kann. Und so ist das Konzept der Hybridisierung entstanden, das ich Ihnen nun kurz erläutern möchte.
Experimentelle Befunde:
- Die vier Außenelektronen des C-Atoms sind energetisch gleichwertig.
- Die vier Außenelektronen des C-Atoms sind tetraedrisch um den Atomkern verteilt.
Hybridisierungskonzept:
Das 2s-Orbital und die drei 2p-Orbitale werden "vermischt", dabei entstehen vier energetisch gleichwertige sp3-Hybridorbitale.
Jedes Hybridorbital des C-Atoms ist mit einem Elektron besetzt, und nach der Elektronenpaar-Abstoßungstheorie nehmen energetisch gleichwertige Orbitale eine solche räumliche Anordnung ein, dass sie maximal weit voneinander entfernt sind (weil sich die Elektronen der Orbitale ja gegenseitig abstoßen).
Das C-Atom nach diesem modifizierten Orbitalmodell sieht also genau so aus wie nach dem Kugelwolkenmodell, nur dass wir jetzt nicht mehr von "Kugelwolken" sprechen, sondern von sp3-Hybridorbitalen.
Weitere Einzelheiten zu diesem Thema finden Sie auf der nächsten Seite zum Thema "Das C-Atom im Orbitalmodell".
Das Kugelwolkenmodell als didaktische Vereinfachung des Orbitalmodells
Das Kugelwolkenmodell ist zeitlich gesehen erst nach dem Orbitalmodell entstanden. Es ist eine didaktische Vereinfachung des Orbitalmodells. Alle Hauptgruppen-Atome werden als sp3-hybridisiert angesehen, und die Hybridorbitale werden als Kugelwolken bezeichnet.
In den 50er Jahren des 20. Jahrhunderts stellte der amerikanische Professor George E. KIMBALL fest, dass seine Studenten doch ziemlich große Probleme beim Erlernen des quantenmechanischen Orbitalmodells hatten. Darauf entwickelte KIMBALL ein vereinfachtes Orbitalmodell, bei dem es nur eine Sorte von Orbitalen gab, die alle kugelförmig waren. 1956 veröffentlichte er sein vereinfachtes Orbitalmodell. Kurze Zeit darauf verstarb KIMBALL an einer Herzkrankheit und konnte sein Modell daher nicht weiterentwickeln.
Dies tat dann Henry A. BENT im Jahre 1963, er verfeinerte KIMBALLs Modell zum "Tangent-Sphere Modell". Der deutsche Chemiker und Lehrbuchautor H.R. CHRISTEN führte dann in den 70er Jahren zum ersten Mal das "Kugelwolkenmodell" in seinen Lehrbüchern ein, das auf dem Tangent-Sphere-Modell von BENT aufbaute. Dieses Modell war so einfach zu verstehen und konnte trotzdem so viele Phänomene der Chemie erklären, dass es einen Siegeszug durch die deutschen Chemielehrbücher antrat.
Auf einer Seite der Uni Rostock wird behauptet, dass seit Anfang der 90er Jahre das Kugelwolkenmodell allerdings zunehmend durch das Elektronenschalenmodellen ersetzt wird, dass sich aber das Kugelwolkenmodell trotzdem noch in vielen Lehrbüchern hält. Dieser Aussage kann ich nicht unbedingt zustimmen. Jedes Chemie-Lehrbuch für die Sekundarstufe I des Gymnasiums (NRW), das ich kenne, führt nach dem Schalenmodell auch das Kugelwolkenmodell ein.
Dieses Thema ist sehr wichtig für das tiefere Verständnis der Chemie der Aromaten und Farbstoffe, gehört allerdings nicht zu den abiturrelevanten Themen in NRW. Daher habe ich das Thema "Orbitalmodell" in diesen Exkurs ausgelagert.
Digitale Folien:
Interne Links:
Externe Links:
- Kugelwolkenmodell (Didaktik der Chemie, Uni Rostock)