Eine Redoxreaktion ist eine chemische Reaktion, bei der gleichzeitig ein Stoff oxidiert, ein anderer Stoff reduziert wird. Daher auch der Name "RedOx-Reaktion".
Schauen wir uns dazu einmal den Mechanismus der FEHLING-Probe an:
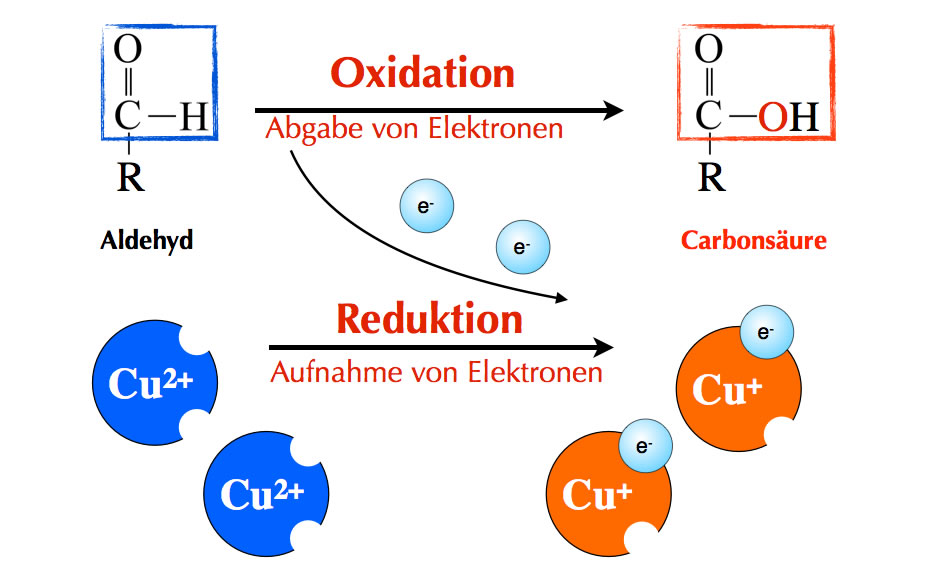
Reaktionsschema für die Fehling-Probe mit einem Aldehyd und Cu2+-Ionen
Der Aldehyd wird oxidiert. Das kann man einmal daran sehen, dass das Aldehyd-Molekül ein Sauerstoff-Atom aufnimmt. Dies ist eine Oxidation nach dem klassischen Oxidations-Begriff der 7. Klasse (Aufnahme von Sauerstoff). In der 8. oder 9. Klasse haben Sie aber sicherlich gerlernt, dass auch die Abgabe von Elektronen als Oxidation bezeichnet wird. Der Aldehyd nimmt hier nicht nur ein Sauerstoff-Atom auf, sondern gibt auch zwei Elektronen ab (Einzelheiten dazu auf der nächsten Seite). Der Aldehyd spielt hier also die Rolle eines Elektronen-Donators.
Wo ein Elektronen-Donator ist, muss aber auch ein Elektronen-Akzeptor sein. Die Elektronen können nur dann abgegeben werden, wenn gleichzeitig "etwas" in der Nähe ist, das die Elektronen aufnimmt - ein Elektronen-Akzeptor.
Bei der FEHLING-Probe spielen zweiwertige Kupfer-Ionen die Rolle dieses Elektronen-Akzeptors. Aus den Cu2+-Ionen werden durch Aufnahme je eines Elektrons (Reduktion) Cu+-Ionen.
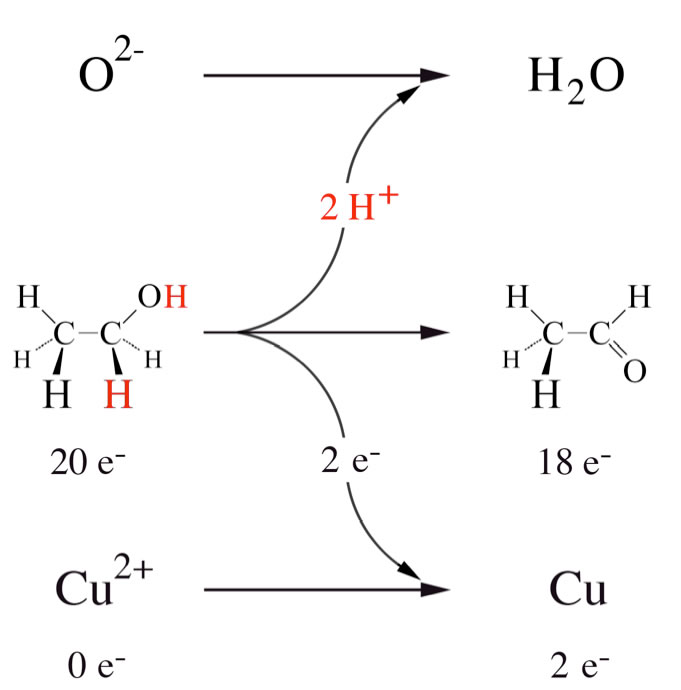
Oxidation eines primären Alkohols (Ethanol) mit Kupferoxid CuO zu einem Aldehyd (Ethanal)
Hier haben wir ein weiteres schönes Beispiel für eine Redoxreaktion. Bei der Herstellung von Acetaldehyd aus Ethanol hatten wir im Versuch oxidiertes Kupfer eingesetzt (Eintauchen eines heißen oxidierten Kupferblechs in den Alkohol). Kupferoxid besteht aus Cu2+-Ionen und O2--Ionen. Das Alkohol-Molekül gibt bei der Oxidation zwei Elektronen ab, die Cu2+-Ionen nehmen diese beiden Elektronen auf und werden dabei reduziert. Die Wasserstoff-Atome des Alkohols (rot markiert) werden als Protonen abgespalten (die Elektronen der H-Atome wandern dann zu den Cu2+-Ionen) und verbinden sich dann mit den O2--Ionen des Kupferoxids zu Wasser.
Seitenanfang -
Alkohol-Oxidation -
Carbonylgruppe -
Nachweis -
Redoxreaktionen -
Oxidationszahlen
Weitere Aspekte