Halogenalkane
Halogenalkane sind Alkane, bei denen ein oder mehrere Wasserstoff-Atome durch Halogen-Atome ersetzt worden sind. Die Halogenalkane werden oft auch als Alkylhalogenide bezeichnet, so zum Beispiel im Römpp Chemie-Lexikon[1].
Neben monosubstituierten Halogenalkanen wie zum Beispiel Chorethan gibt es auch mehrfach-substituierte Halogenalkane wie Trichlormethan (Chloroform). Halogenalkane können auch verschiedene Halogene enthalten, beispielsweise Fluor und Chlor gleichzeitig (FCKWs).
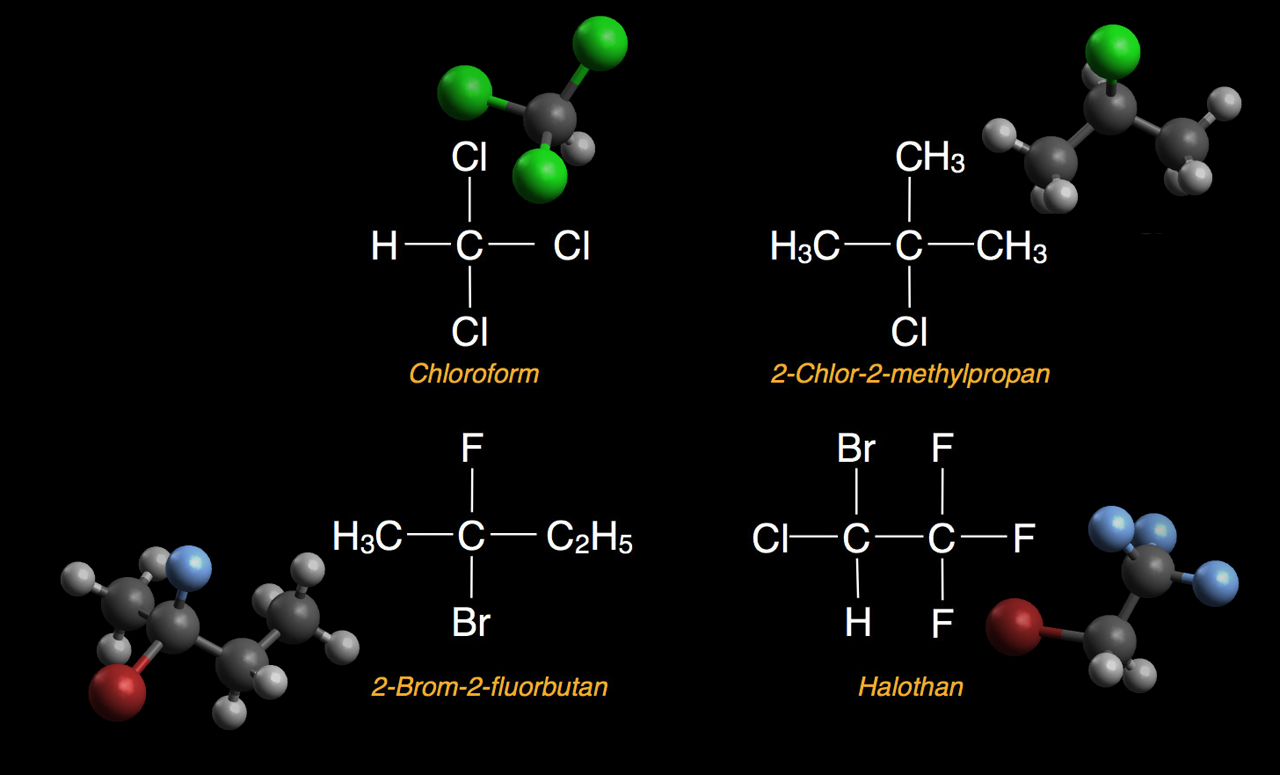
Einige Halogenalkane: Chloroform, 2-Chlor-2-methylpropan, 2-Brom-2-fluorbutan, Halothan
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Bild oben zeigt vier typische Halogenalkane als Strukturformel und als Molekülmodell.
Die C-X-Bindung
Halogenalkane unterscheiden sich von den Alkanen durch den Besitz von Halogen-Atomen (Fluor, Chlor, Brom oder Iod). Halogene sind elektronegativer als Kohlenstoff-Atome, daher ist die C-X-Bindung grundsätzlich polarisiert mit einem negativen Ladungsschwerpunkt am Halogen-Atom und einem positiven Ladungsschwerpunkt am Kohlenstoff-Atom der C-X-Bindung. Die Stärke der Polarisierung hängt von dem Elektronegativitäts-Unterschied zwischen dem C-Atom und dem Halogen-Atom ab. Bei der C-F-Bindung ist dieser EN-Unterschied am größten, bei der C-I-Bindung am geringsten. Die C-F-Bindung ist daher sehr stark polarisiert, die C-I-Bindung nur noch sehr schwach.
Streng genommen, ist die C-I-Bindung unpolar, denn sowohl Kohlenstoff wie auch Iod haben eine Elektronegativität von 2,5, der EN-Unterschied ist also gleich Null.
EN-Unterschiede der C-X-Bindung
- C-F: 2,5-4,0 = -1,5
- C-Cl: 2,5-3,0 = -0,5
- C-Br: 2,5-2,8 = -0,3
- C-I: 2,5-2,5 = 0
Die Polarität der C-X-Bindung hat Auswirkungen sowohl auf die physikalischen wie auch auf die chemischen Eigenschaften der Halogenalkane.
Physikalische Eigenschaften
Siedepunkt, Schmelzpunkt und Dichte
Wegen der polaren C-X-Bindung, die den Halogenalkan-Molekülen einen mehr oder weniger starken permanenten Dipol-Charakter verleiht, sind die Siedepunkte, Schmelzpunkte und Dichten grundsätzlich höher als bei den entsprechenden Alkanen. So hat Butan einen Siedepunkt von 0,5 ºC, 1-Chlor-butan dagegen siedet bei 78 ºC. Allerdings ist dieser Siedepunkt niedriger als der von Butan-1-ol mit 117,7 ºC. Das wiederum liegt daran, dass die Halogenalkane keine Wasserstoffbrücken-Bindungen untereinander eingehen können, während die Alkohole das ja können.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane sind grundsätzlich höher als die der entsprechenden Alkane und niedriger als die der entsprechenden Alkohole.
- Die Schmelzpunkte, Siedepunkte und Dichten der Halogenalkane steigen mit wachsender Kettenlänge, wie bei jeder homologen Reihe der organischen Verbindungen.
Einen erheblichen Einfluss auf die drei genannten Eigenschaften hat auch die Art des Halogens, das mit dem Alkan verbunden ist. So hat Fluor-ethan einen Siedepunkt von -37,1 ºC, während Iod-ethan bei +71 ºC siedet. Ursache hierfür ist erstens die höhere molare Masse des Iod-ethans (156 gegenüber 48 beim Fluor-ethan), und zweitens die leichte Polarisierbarkeit des Iod-Atom.
Wasserlöslichkeit
Die Wasserlöslichkeit der Halogenalkane ist sehr gering, aber immer noch deutlich höher als bei den entsprechenden Alkanen:
- Pentan: Wasserlöslichkeit = 39 mg / l Wasser
- 1-Chlor-pentan: Wasserlöslichkeit = 200 mg / l Wasser
- 1-Pentanol: Wasserlöslichkeit = 22.000 mg / l Wasser
Das Chlor-pentan ist also fast fünfmal besser wasserlöslich als das bei Zimmertemperatur ebenfalls flüssige Pentan. Allerdings ist der entsprechende Alkohol 1-Pentanol über 100 mal besser wasserlöslich als 1-Chlor-pentan.
Offensichtlich hat die polare C-X-Bindung einen Einfluss auf die Wasserlöslichkeit. Dies ist zunächst etwas verwunderlich, da die Halogenalkane ja keine Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen können. Allerdings sind Halogenalkan-Moleküle permanente Dipole, genau wie Wasser-Moleküle. Daher können sich Dipol-Dipol-Kräfte zwischen den Molekülen des Halogenalkans und den Wasser-Molekülen ausbilden. Wie man beim Vergleich mit den entsprechenden Alkoholen sieht, sind diese Wechselwirkungen aber sehr schwach im Gegensatz zu den Wasserstoffbrücken-Bindungen, die sich zwischen den OH-Gruppen der Alkohole und den Wasser-Molekülen bilden können.
Für Schüler(innen) der Stufe EF sollte diese Seite hier eigentlich reichen. Wenn Sie aber mehr über die physikalischen Eigenschaften der Halogenalkane wissen möchten, gehen Sie doch bitte auf die Vertiefungsseite.
Zusammenfassung
Die physikalischen Eigenschaften der Halogenalkane werden weitgehend durch die polare C-X-Bindung bestimmt. Halogenalkane haben höhere Dichten, Siedepunkte und Schmelzpunkte als die Alkane mit gleicher Kettenlänge, aber auch eine bessere Wasserlöslichkeit. Je größer die Kettenlänge eines Halogenalkans, desto mehr ähneln die physikalischen Eigenschaften denen des entsprechenden Alkans, weil der Einfluss der C-X-Bindung immer geringer wird, je länger die C-Kette ist.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Webseite zum Lösungsbuch zu "Get Ready for Organic Chemistry" von Leroy G. Wade, ISBN 032183296
- Wikipedia, verschiedene Artikel zu Halogenalkanen
Seitenanfang -
zur Vertiefungsseite: physikalische Eigenschaften der Halogenalkane...
zur Folgeseite: Synthese der Halogenalkane...