2-Chlor-butan / NaCN
Auch diese Beispiele habe ich dem Video zur Vorlesung "Organische Chemie I" von Prof. Gerald Dyker an der Ruhr-Universität Bochum entnommen. Eine sehr interssante Vorlesung, die ich jedem engagierten Chemie-LK-Schüler nur empfehlen kann.
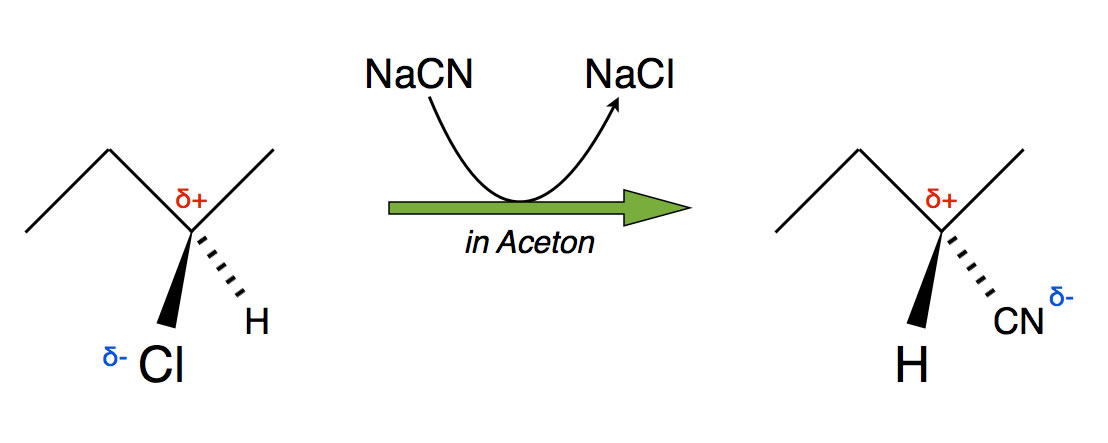 Reaktion von 2-Chlor-butan mit Natriumcyanid in Aceton unter Inversion, also nach SN2
Reaktion von 2-Chlor-butan mit Natriumcyanid in Aceton unter Inversion, also nach SN2
Das 2- Chlor-butan wird mit Natriumcyanid in Aceton als Lösemittel umgesetzt. Die Substitution führt dann zu einem Nitril. Das Chlorid ist keine gute Austrittsgruppe, was eher für eine SN2-Reaktion spricht, da eine spontane Dissoziation nach SN1 eher unwahrscheinlich ist. Das CN- ist ein gutes Nucleophil, kann also das Chlor leicht verdrängen, auch das spricht eher für eine SN2-Reaktion. Wem diese Befunde noch nicht reichen, der schaue sich doch einmal die Raumstruktur des Reaktionsproduktes an. Während der Reaktion hat eine Inversion stattgefunden, auch das ist nur durch eine SN2-Reaktion erklärbar.
2-Iod-butan / Methanol
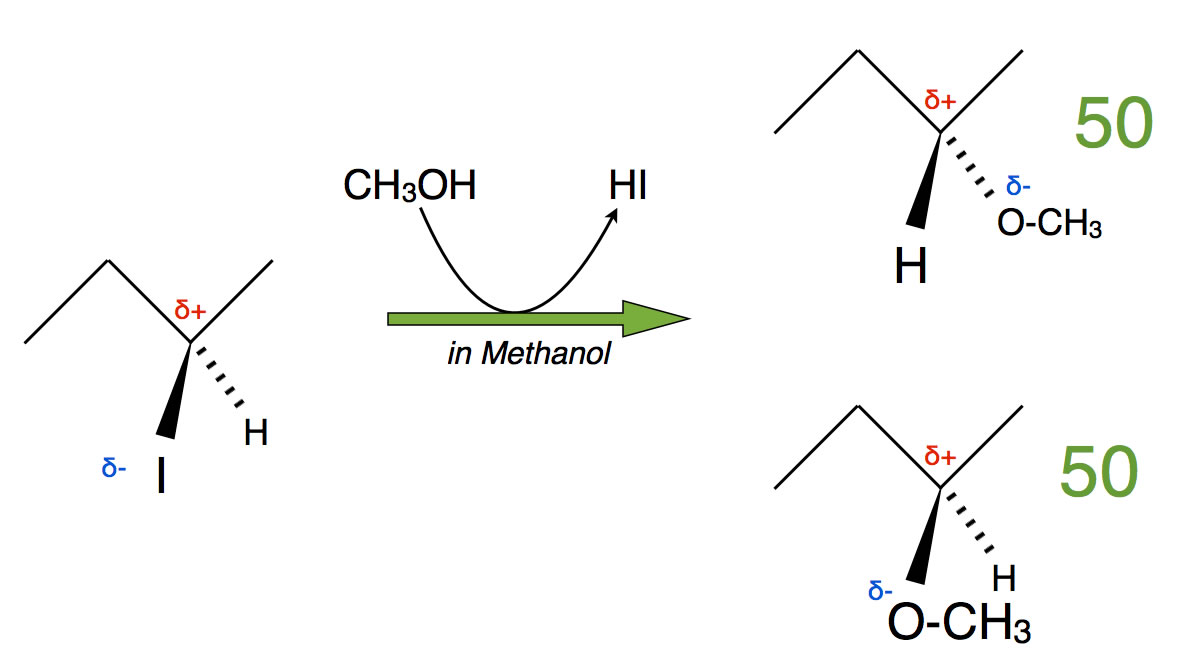
Reaktion von 2-Iod-butan mit Methanol
Nun lassen wir 2-Iod-butan mit Methanol reagieren, das Lösemittel ist ebenfalls Methanol. Das Iod ist eine gute nucleofuge Gruppe, das Lösemittel ist stark polar und kann das abgespaltene Iodid gut solvatisieren (also mit einer Hülle aus Wasser-Molekülen umschließen). Unter diesen Bedingungen würden wir eine SN1-Reaktion erwarten. Für diese Annahme spricht auch die Tatsache, dass man ein racemisiertes Produkt findet, also ein Produktgemisch, dass zu 50% aus dem einen Spiegelbild-Isomer und zu 50% aus dem anderen Spiegelbild-Isomer (Enantiomer) besteht.
Acetylsalicylsäure (Aspirin)
Aspirin bzwl Acetylsalicylsäure wird aus Salicylsäure und Essigsäure-Anhydrid synthetisiert. Das Essigsäure-Anhydrid dient dabei als organisches Substrat, das durch Protonierung zunächst in ein Carbenium-Ion umgewandelt wird. Dieses Carbenium-Ion wird dann von der OH-Gruppe der Hydroxy-Benzoesäure nucleophil angegriffen. Die Reaktion ist ein wenig komplexer als hier dargestellt und wird auf der Seite "Aspirin-Synthese" detailliert beschrieben.