Aceton ist der Trivialname für Propanon, dem einfachsten Keton bzw. Alkanon.
Struktur
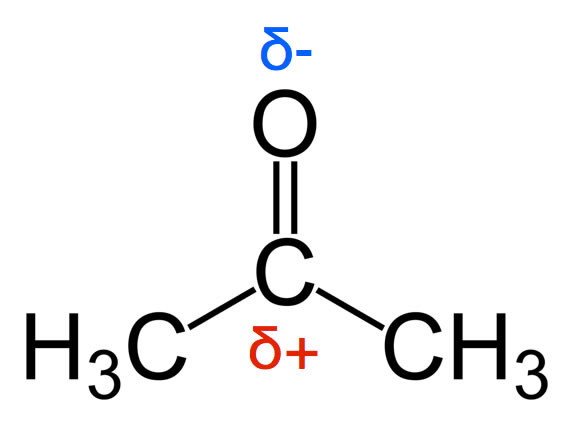
Strukturformel des Aceton-Moleküls
Eine Carbonylgruppe C=O ist mit zwei Methylgruppen -CH3 verknüpft. Wegen der hohen Elektronegativität des O-Atoms ist das C-Atom der Carbonylgruppe positiv polarisiert.
Was man auf diesem Bild nicht sehen kann, ist die planare Struktur des Aceton-Grundgerüstes. Die Carbonylgruppe sowie die beiden C-Atome der Methylgruppen liegen in einer Ebene.
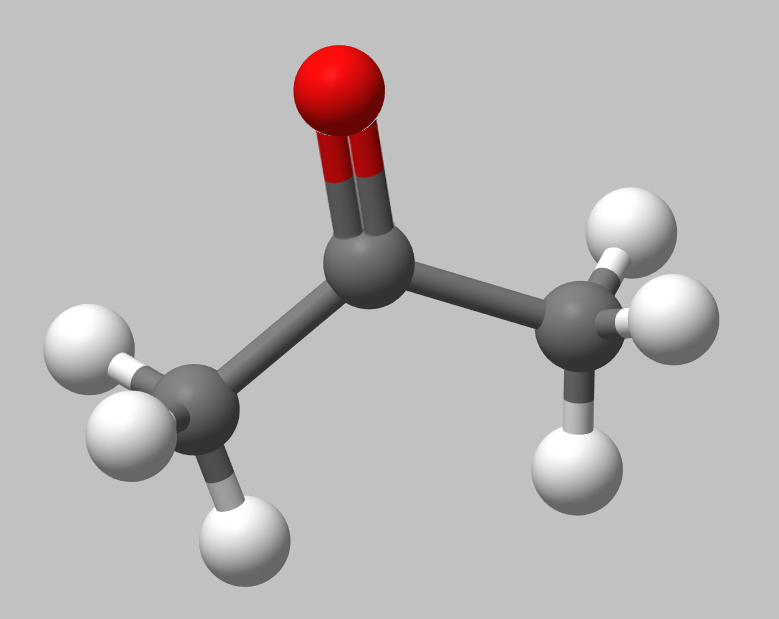
Kugel-Stab-Modell des Aceton-Moleküls
Die planare Struktur des Acetons kann man auf diesem Bild etwas besser erkennen, aber auch noch nicht perfekt. Ursache für die planare Struktur ist die sp2-Hybridisierung des C-Atoms und des O-Atoms der Carbonylgruppe.
Darstellung
Oxidation von Propan-2-ol
Im Chemieunterricht kann Aceton recht einfach aus Propan-2-ol durch Oxidation hergestellt werden. Der bekannteste und in fast jedem Schulbuch vertretende Versuch ist der, bei dem Kupferblech zum Glühen gebracht und dann in ein Reagenzglas mit Propan-2-ol geworfen wird.
Der Alkohol gibt zwei Elektronen und zwei Protonen ab und wird zum Propanon oxidiert:
$H_{3}C-CHOH-CH_{3} \to H_{3}C-CO-CH_{3} + 2 e^{-} + 2 H^{+}$Die Cu2+-Ionen nehmen die zwei Elektronen auf und werden dadurch zu Kupfer Cu reduziert:
$Cu^{2+} + 2 e^{-} \to Cu$Die Protonen vereinigen sich dann mit den noch vorhandenen Oxid-Ionen des entstandenen Kupferoxids zu Wasser:
$O^{2-} + 2 H^{+} \to H_{2}O$
Erhitzen von Calciumacetat
Eine andere Methode ist das starke Erhitzen von Calciumacetat. Aus zwei Acetat-Resten entsteht dann in einer recht komplexen Reaktion unter CO2-Abspaltung ein Aceton-Molekül. Auf der Seite von Prof. Blume findet sich eine gute Anleitung für diesen Versuch.
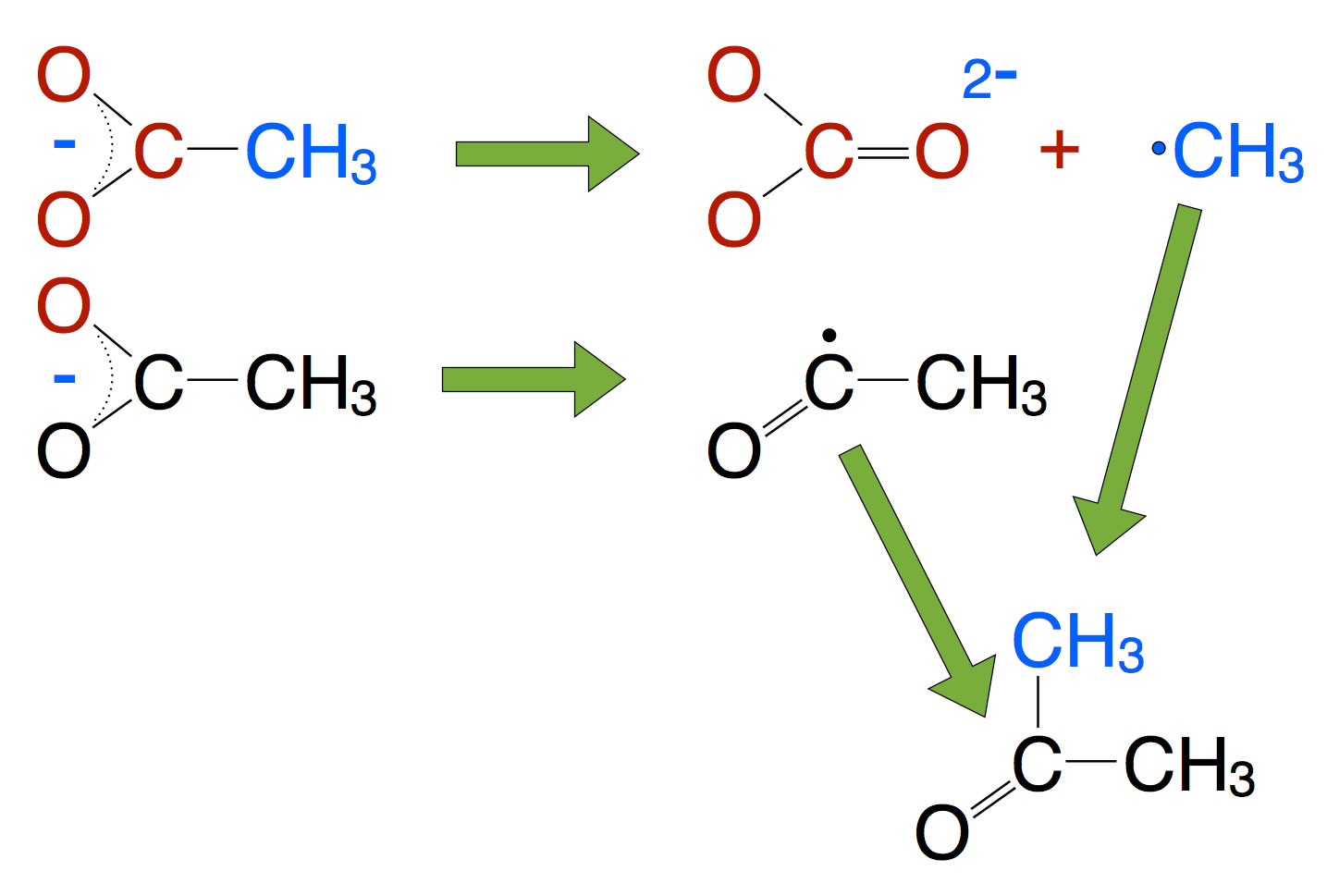
Schema der Synthese von Aceton aus Acetat über radikalische Zwischenstufen
In der Industrie wendet man diese Methode heutzutage nicht mehr an, sie gilt als veraltet. Es entstehen zu viele Nebenprodukte. Das kann man auch während des Schulversuchs gut beobachten. Nach der Anleitung von Prof. Blume soll man die entstehenden Acetondämpfe in ein Reagenzglas mit Wasser einleiten; dann entsteht aber kein reines Aceton, sondern eine Lösung von Aceton in Wasser. Ich habe den Versuch in meinem Unterricht so modifiziert, dass die Acetondämpfe in ein trockenes aber gut gekühltes Reagenzglas eingeleitet werden. Auf diese Weise sollte man reines Aceton erhalten. Eine anschließende Brennprobe bestätigt dies; das Reaktionsprodukt verbrennt mit blau-gelber Flamme, zeigt also eine Sauerstoff-Verbindung an. Allerdings bleibt bei dieser Verbrennung eine ölige Flüssigkeit auf dem Fliesentisch zurück. Ich vermute mal, dass es sich hierbei um eine Art Polyaceton handelt, also ein Polymer des Acetons, wie man es ja auch vom Formaldehyd her kennt.
Industrielle Herstellung
In der Industrie wird Aceton nach einem komplexeren Verfahren hergestellt. Zunächst lässt man Benzol mit Propen unter saurer Katalyse (Phosphorsäure) reagieren, dabei entsteht die Verbindung Cumol:
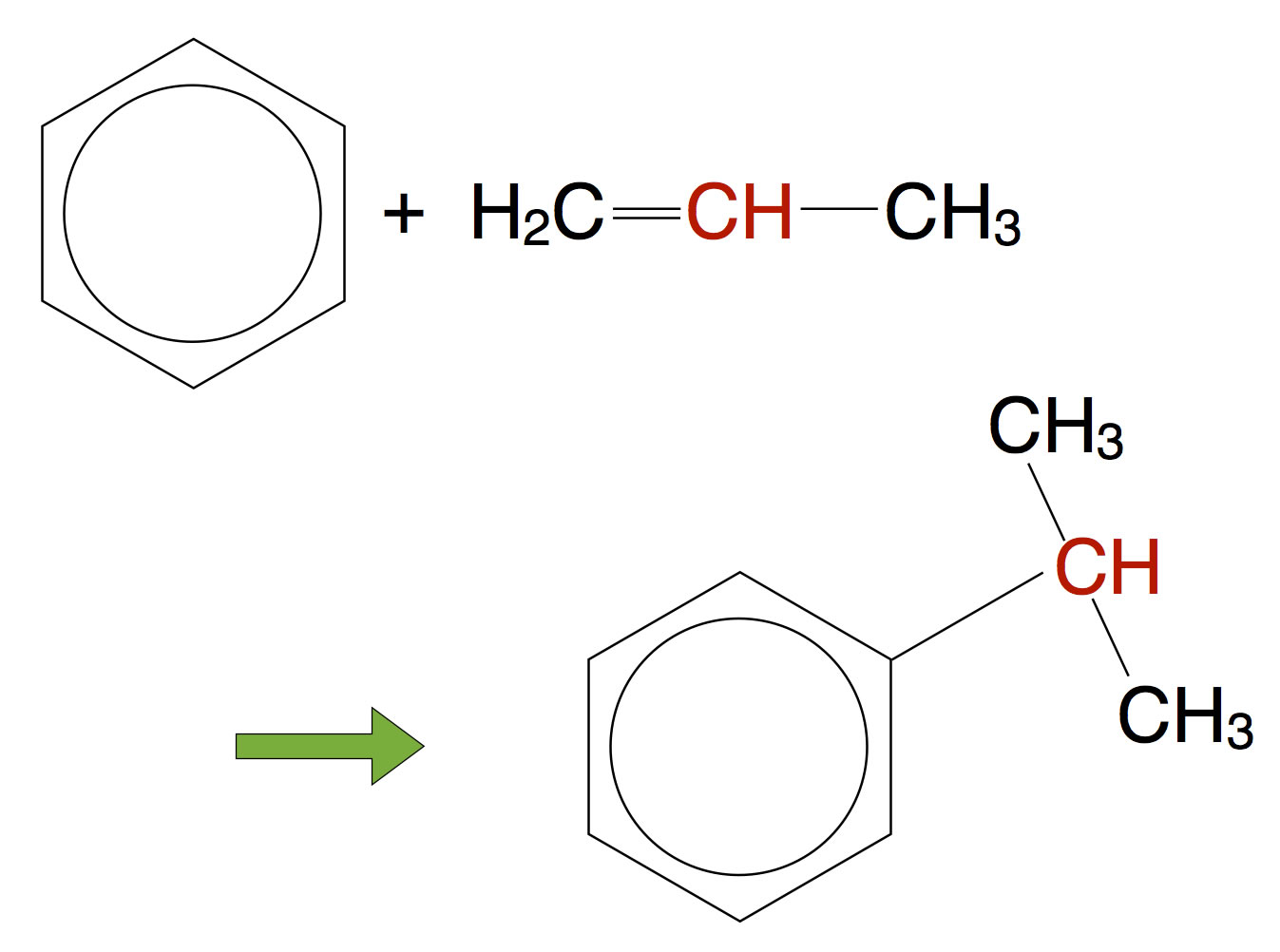
Synthese von Cumol aus Benzol und Propen
Chemisch gesehen handelt es sich hier um eine Art elektrophiler Substitution. Das eine H-Atom des Benzolringes wird durch das Carbenium-Ion ersetzt. Das Carbenium-Ion entsteht, wenn sich ein Proton an die Doppelbindung des Propens setzt. Einen solchen Vorgang - "Anbau eines Carbenium-Ions an einen Benzolring" bezeichnet man übrigens als Friedel-Crafts-Alkylierung.
Das gebildete Cumol reagiert dann mit Luftsauerstoff zu Cumolhydroperoxid:
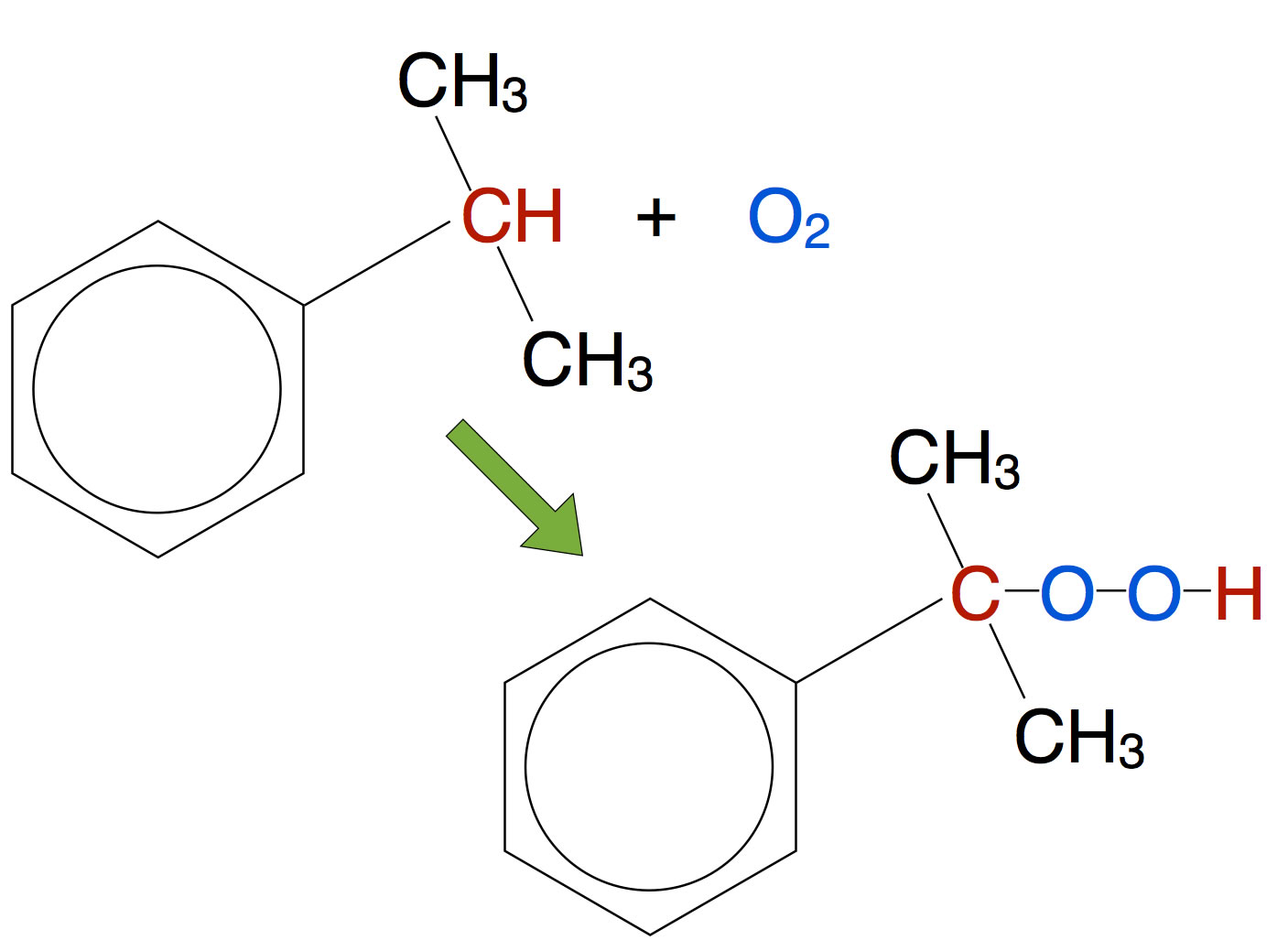
Bildung des Cumolhydroperoxids
Unter Säurekatalyse zerfällt das Cumolhydroperoxid dann zu Phenol und Aceton, zwei in der Industrie sehr nachgefragte Rohstoffe für weitere chemische Synthesen:
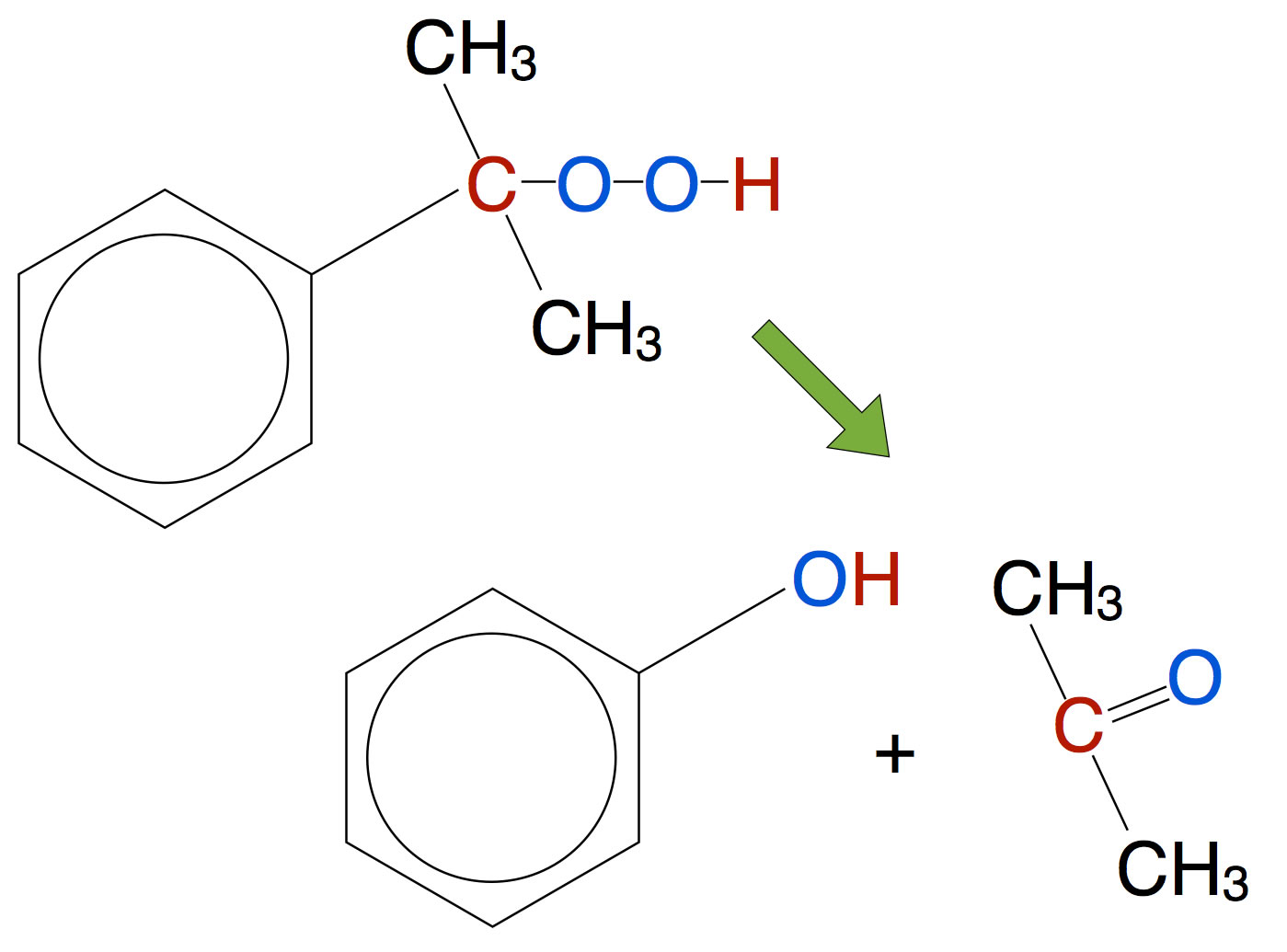
Säurekatalysierter Zerfall von Cumolhydroperoxid in Phenol und Aceton
Physikalische Eigenschaften
Aceton ist eine farblose, nach Nagellack riechende und unbegrenzt in Wasser lösliche Flüssigkeit, die mit blau-gelber Flamme brennt.
Siedpunkt
Der Siedepunkt von 56 ºC liegt deutlich höher als der vergleichbarer Alkane, aber auch deutlich unterhalb dem Siedepunkt vergleichbarer Alkohole. Alkan-Moleküle sind unpolar und keine Dipole, daher der geringe Siedepunkt der Alkane. Alkohole dagegen sind nicht nur polar und Dipol-Moleküle, sondern sie können untereinander auch noch Wasserstoffbrücken-Bindungen bilden. Aceton hat eine Mittelstellung. Es ist wegen der C=O-Bindung einerseits polar und ein Dipol, kann aber keine H-Brücken mit anderen Aceton-Molekülen bilden, weil die sechs H-Atome an C-Atome gebunden sind, nicht aber an O- oder N-Atome, wie es für die Bildung von H-Brücken erforderlich ist.
Wasserlöslichkeit
Aceton ist unbegrenzt in Wasser löslich. Verantwortlich dafür ist das O-Atom der Carbonylgruppe, das mit den Wasser-Molekülen H-Brücken bilden kann.
Lösungsmittel
Aceton löst organische unpolare Stoffe meistens sehr gut, daher wird es häufig als universelles Lösemittel für alles Mögliche eingesetzt, zum Beispiel für Farben und Lacke, Vinylharze, Öle und so weiter.
Chemische Eigenschaften
Aceton als einfachster Vertreter der Ketone hat auch alle chemischen Eigenschaften der Ketone. Für den Chemieunterricht am wichtigsten ist natürlich die polare Carbonylgruppe im Aceton-Molekül, an die sich sowohl nucleophile wie auch elektrophile Teilchen anlagern können. Die typische Reaktion der Carbonylverbindungen, die nucleophile Addition, ist auf eigenen Seiten dieser Homepage ausführlich dargestellt.
In meinem eigenen Chemieunterricht führe ich immer die Herstellung von Dibenzalaceton durch, bei der ein Aceton-Molekül mit zwei Benzaldehyd-Molekülen reagiert.
Weitere Details
Hier verweise ich einfach mal auf den Wikipedia-Artikel "Aceton" sowie auf den "Aceton"-Artikel von Thomas Seilnacht. Auf der Seilnacht-Seite wird das Aceton sehr übersichtlich dargestellt.