Auf dieser Seite finden Sie Informationen zur Carboxy-Gruppe, die auch für Schüler(innen) der Stufe EF interessant sind. Auf vertiefende Betrachtungen wurde hier verzichtet, Kenntnisse des Orbitalmodell sind nicht notwendig, und auf Mesomerie und Nucleophile Substitution und Addition wird hier auch nicht eingegangen.
Allgemeines
Die Carboxy-Gruppe (früher: Carboxyl-Gruppe, kurz COOH-Gruppe) ist eine wichtige funktionelle Gruppe organischer Verbindungen, sie kommt vor allem in Carbonsäuren vor, die eine, zwei, drei oder auch mehr Carboxy-Gruppen tragen können.
Auf den ersten Blick sieht die Carboxy-Gruppe wie eine Kombination aus Carbonyl-Gruppe und Hydroxy-Gruppe aus. Die Kombination dieser beiden funktionellen Gruppen ergibt jedoch völlig neue Eigenschaften, die weder auf die Carbonyl-Gruppe allein noch auf die Hydroxy-Gruppe allein zutreffen [1]. Beispielsweise (um nur eine dieser neuen Eigenschaften zu nennen), kann die Hydroxy-Gruppe ganz leicht ein Proton abgeben, wenn sie mit der Carbonyl-Gruppe kombiniert ist. Alkane mit einer Carboxy-Gruppe werden daher als Carbonsäuren bzw. Alkansäuren bezeichnet.
Hier finden Sie Informationen zur Stoffklasse der Carbonsäuren, geeignet für Schüler(innen) der Sekundarstufe II.
Wenn Sie überlegen, ob Sie das Fach Chemie studieren sollen oder bereits mit dem Chemie-Studium begonnen haben, dann sollten Sie sich auf dieser Seite über Carbonsäuren umsehen. Hier wird viel intensiver auf das Thema eingegangen als auf den Seiten für die Sek. II.
Strukturdaten Q2/Studium

Strukturdaten der Carboxy-Gruppe
Den Aufbau und die Strukturdaten der Carboxy-Gruppe sieht man gut in der Abbildung 1. Die Strukturdaten wurden dem Buch "Organische Chemie" von Vollhardt und Schore[2] entnommen.
Die C=O-Doppelbindung ist mit 120 pm deutlich kürzer als die C-O-Einzelbindung mit 134 pm. Die O-H-Bindung hat nur eine Länge von 97 pm.
Die Bindungswinkel sind interessant. Die R-C-O-O-Struktur ist völlig planar, weil das mittlere C-Atom sp2-hybridisiert ist. Dennoch weichen die Bindungswinkel deutlich von den idealen 120 Grad ab. Das liegt an den freien Elektronenpaaren des Sauerstoff-Atoms, die "drücken" die anderen beiden Bindungen des sp2-hybridisierten C-Atoms etwas von sich weg. Daher haben diese Bindungswinkel Werte um 124 Grad.
Der Bindungswinkel zwischen dem zentralen C-Atom, dem O-Atom der OH-Gruppe und dem H-Atom der OH-Gruppe liegt mit 106,3 Grad nahezu bei dem Wert des normalen Tetraeder-Winkels von 109,5 Grad. Die "Verengung" des Winkels auf 106,3 Grad ist ebenfalls auf die beiden freien Elektronenpaare des Sauerstoff-Atoms zurückzuführen.
Chemische Eigenschaften Q2/Studium
Betrachten wir nun die chemischen Eigenschaften der Carboxy-Gruppe näher. Durch die beiden elektronegativen Sauerstoff-Atome ist das zentrale C-Atom stark positiv polarisiert, trägt also eine positive Teilladung, während die beiden Sauerstoff-Atome negative Teilladungen tragen.

Sowohl elektrophile wie auch nucleophile Teilchen können die Carboxy-Gruppe angreifen
Elektrophile Teilchen, also positiv geladene Moleküle oder Ionen, die "auf der Suche" nach negativen Ladungen sind, können die beiden O-Atome der Carboxylgruppe leicht angreifen. Umgekehrt können nucleophile Teilchen, die "auf der Suche" nach positiven Ladungen sind, das zentrale C-Atom angreifen. Damit ist die Carboxy-Gruppe in chemischen Synthesen recht universell einsetzbar. Davon abgesehen gibt es noch einen weiteren wichtigen Reaktionstyp der Carboxy-Gruppe, nämlich die Abspaltung eines Protons von der OH-Gruppe. Die Carboxy-Gruppe kann also sauer reagieren. Warum das so ist, wird weiter unten erläutert.
Nucleophile Substitution Q2/Studium
Das positiv polarisierte zentrale C-Atom der Carboxy-Gruppe kann auf zwei Weisen nucleophil angegriffen werden. Bei der nucleophilen Substitution wird die OH-Gruppe durch eine andere nucleophile Gruppe ersetzt. Die C=O-Doppelbindung kommt dabei aber nicht ungeschoren weg, sondern wird in die Reaktion einbezogen.

Theoretischer Ablauf einer nucleophilen Substitution bei einer Carbonsäure
Die Reaktion besteht aus zwei Schritten. Im ersten Schritt findet eine nucleophile Addition statt. Die C=O-Doppelbindung wird aufgebrochen, ein H-Atom des Nucleophils HNu lagert sich an das O-Atom der Carbonylgruppe an, wodurch eine zweite OH-Gruppe entsteht. Das C-Atom der Carboxy-Gruppe wird dadurch positiv und addiert dann das Anion Nu- des Nucleophils.
Im zweiten Schritt findet eine Eliminierung statt. Das H-Atom der neu gebildeten OH-Gruppe spaltet sich wieder ab, und die C=O-Doppelbindung bildet sich neu. Die "alte" OH-Gruppe der Carboxy-Gruppe vereinigt sich mit dem abgespaltenem H-Atom zu Wasser. So weit die Theorie.
Vergleich mit der SN1- und SN2-Reaktion
Auch die SN1-Reaktion der Halogenalkane, Alkohole und verwandter Verbindungen ist eine zweischrittige Reaktion. Allerdings verläuft die SN1-Reaktion genau anders herum als die eben beschriebene Umsetzung: Hier findet im ersten Schritt die Abspaltung des Nucleofugs statt und im zweiten Schritt die Addition des neuen Nucleophils.
Bei der SN2-Reaktion finden Abspaltung des Nucleofugs und Addition des Nucleophils gleichzeitig statt.
Die Nucleophile Substitution an der COOH-Gruppe ist also ein neuer, dritter Mechanismus, der in der Fachliteratur meistens als Additions-Eliminierungs-Mechanismus bezeichnet wird.
Nucleophile Substitution vs. Protolyse
Bei Carbonsäuren wird der Ablauf der nucleophilen Substitution dadurch gestört, dass das H-Atom der OH-Gruppe leicht als Proton abgespalten werden kann. Die meisten Nucleophile sind gleichzeitig Basen und würden mit diesem Proton reagieren:

Ein Nucleophil spaltet ein Proton aus der Carboxy-Gruppe ab
Nucleophile Addition eher unwahrscheinlich
Bei den meisten Carbonsäuren ist die nucleophile Addition nur der erste Schritt der nucleophilen Substitution. "Richtige" nucleophile Additionen kommen so gut wie nicht vor, zumindest nicht bei normalen Carbonsäuren. Die beiden OH-Gruppen, die sich nach der Addition von HNu bilden würden, sind recht instabil.
Protonenabgabe Q2/Studium
Die Carboxy-Gruppe kann sehr leicht ein Proton abgeben. Die Ursache hierfür liegt zunächst in der stark polaren Bindung zwischen dem O-Atom und dem H-Atom der OH-Gruppe. Die beiden Bindungselektronen halten sich wegen der hohen EN des O-Atoms statistisch gesehen eher beim O-Atom auf als beim H-Atom. Eine heterolytische Spaltung der OH-Bindung ist daher kein besonderes Problem, da die beiden Elektronen ja sowieso schon meistens beim O-Atom sind.
Dann stellt sich natürlich die Frage, warum nicht auch Alkohole sauer reagieren, denn Alkohole besitzen ja auch eine OH-Gruppe. Vergleicht man aber die pKS-Werte von Carbonsäuren und Alkoholen, sieht man, dass Carbonsäuren um viele Größenordnungen saurer sind als Alkohole. Alkohole wie Methanol oder Ethanol haben pKS-Werte im Bereich von 14, während Carbonsäuren wie Methansäure oder Ethansäure pKS-Werte im Bereich von 4 bis 5 haben, sie sind also fast 10 Größenordnungen saurer.
10 Größenordnungen heißt nicht "10 mal so sauer", sondern "1010 mal so sauer", also zehn Milliarden mal so sauer; der pKS-Wert ist ja bekanntlich eine logarithmische Größe, ähnlich wie der pH-Wert.
Dass Carbonsäuren ein Proton so leicht abgeben können, hat zwei Hauptgründe.
Induktive Effekte
Das zentrale C-Atom der Carboxy-Gruppe ist mit einem Sauerstoff-Atom verbunden. Dieses wirkt wegen der hohen Elektronegativität elektronenziehend, verringert also die Elektronendichte am zentralen C-Atom, was dadurch ja auch positiv polarisiert wird. Dieser Elektronenmangel zieht nun seinerseits Elektronen aus der O-H-Bindung der Hydroxy-Gruppe ab. Die O-H-Bindung wird dadurch schwächer, und das H-Atom kann leichter als Proton abgespalten werden.
Mesomere Effekte
So schön wie der negative induktive Effekt auch ist, er spielt bei der Acidität der Carboxy-Gruppe nur eine untergeordnete Rolle. Viel wichtiger ist der mesomere Effekt. Dazu muss man sich einmal die Struktur des Carboxylat-Ions anschauen, das ja entsteht, wenn eine Carbonsäure ein Proton abspaltet. Es gibt nämlich zwei Grenzstrukturen des Carboxylat-Ions:
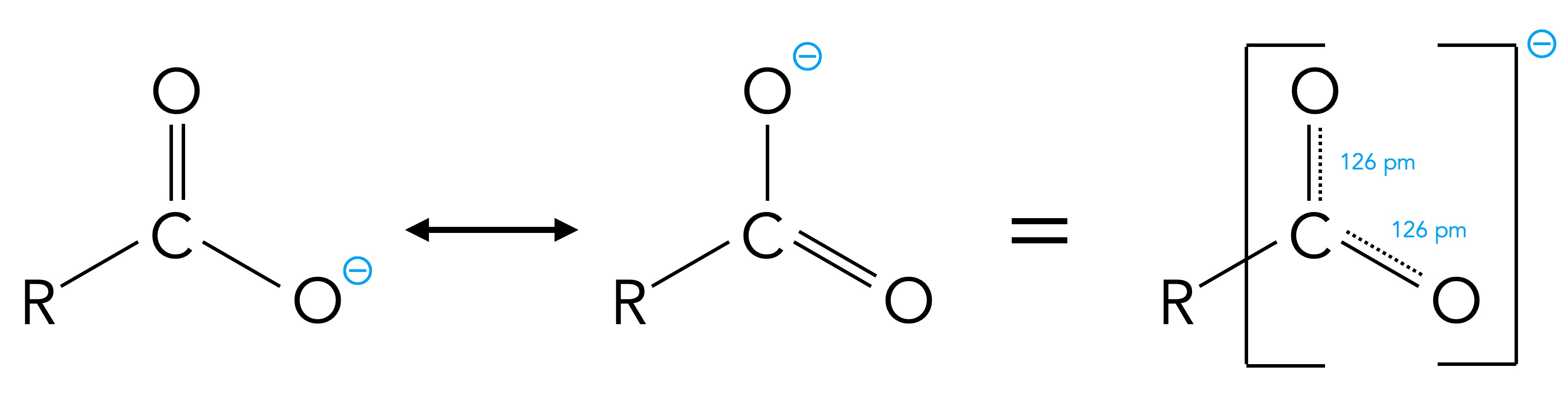
Die beiden Grenzstrukturen des Carboxylat-Ions
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Die negative Ladung wird so quasi auf "zwei Schultern" verteilt und dadurch stabilisiert. Ein derart Mesomerie-stabilisiertes Anion kann sich leichter bilden als ein "normales" Anion, und das erklärt den starken Säurecharakter von Carbonsäuren.
Betrachten wir dazu noch einmal die Struktur der protonierten Carboxy-Gruppe:

Eine theoretische zweite Grenzstruktur der COOH-Gruppe
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Denkbar wäre eine zweite Grenzstruktur der COOH-Gruppe. Allerdings wäre diese Grenzstruktur extrem instabil, weil sie mit einer Ladungstrennung verbunden wäre. Daher spielt diese Grenzstruktur keine Rolle, ihr Beitrag zur Gesamtstruktur ist vernachlässigbar klein. De facto hat die COOH-Gruppe also nur eine Struktur, die man dann auch nicht mehr als "Grenzstruktur" bezeichnen dürfte.
Auch die OH-Gruppe eines Alkohols kann ein Proton abgeben. Das so entstehende Alkoholat-Ion ist allerdings nicht Mesomerie-stabilisiert. Daher bildet es sich auch nicht so leicht, und entsprechend hoch ist der pKS-Wert der Alkohole.
Quellen:
- Lexikon der Chemie, Artikel "Carboxy-Gruppe", Spektrum-Verlag 1998.
- Vollhardt, Schore: "Organische Chemie", Weinheim 2000
- Römpp Chemie-Lexikon, 9. Auflage 1992