Abitur
Die Konzentrationsbestimmung einer Säure (oder Lauge) durch Titration mit einer Lauge (bzw. Säure) kommt in fast jeder Abituraufgabe zum Inhaltsfeld 1 (Säuren, Basen, Konzentrationsbestimmung) in NRW (und in anderen Bundesländern) vor.
Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- wie man eine Apparatur zur Titration einer Säure (oder Lauge) aufbaut,
- wie man die Titration durchführt,
- wie man aus den Versuchsergebnissen die Konzentration der Säure berechnet.
Der Versuchsaufbau
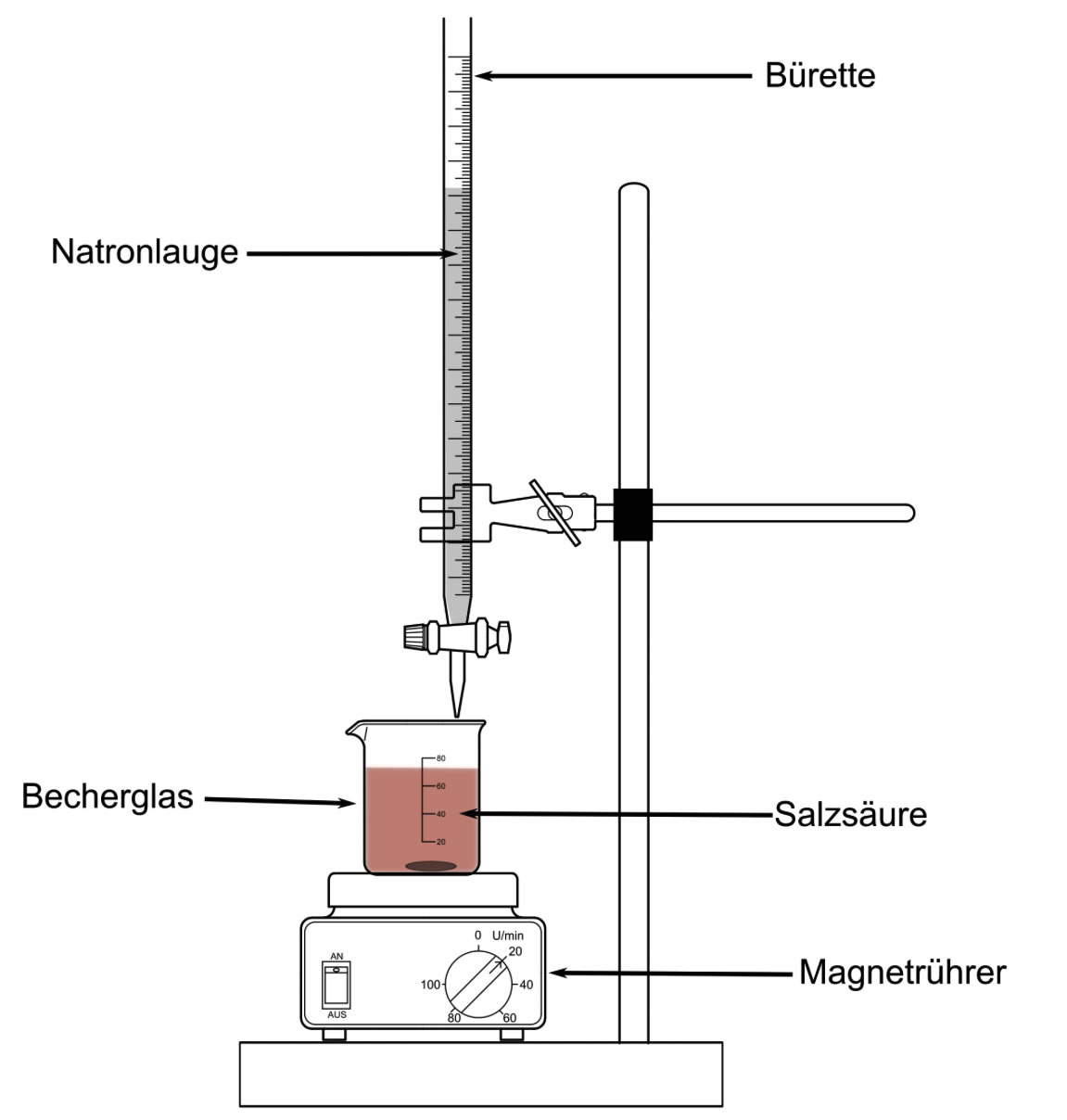
Eine typische Titrationsapparatur
Quelle: deutsche Wikipedia. Autor: Muskid.
Originalbild verändert von Ulrich Helmich am 31.08.2019 (pH-Sonde wurde entfernt, Säure wurde stattdessen mit Universalindidator versetzt).
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
In dem Becherglas befindet sich die zu untersuchende saure Lösung, deren Konzentration ihr bestimmen sollt. Das Volumen V(Säure) muss genau bekannt sein. "Krumme" Zahlen wie 83 ml erschweren hinterher die Berechnung, am besten gebt ihr 100 ml oder 200 ml saure Lösung in das Becherglas.
Was ist der Unterschied zwischen einer Säure und einer sauren Lösung?
Eine Säure ist die reine Verbindung, die also zu nahezu 100% vorliegt. Konzentrierte Essigsäure ist beispielsweise tatsächlich eine Säure, sie liegt zu 98 bis 99% vor. Gibt man diese Säure in ein Becherglas mit Wasser, entsteht eine saure Lösung.
Die Flüssigkeit, die sich in dem Becherglas befindet, ist also keine Säure, sondern eine saure Lösung. Wäre sie eine Säure, bräuchte man die Konzentration ja nicht mehr zu bestimmen, da es sich um einen Reinstoff handelte.
Die Säure wird dann mit ein paar Tropfen Universalindikator versetzt. Mit dem Universalindikator kann man den pH-Wert der sauren Lösung messen. Wenn ihr Universalindikator in eine saure Lösung gebt, nimmt er die Farbe rot an bzw. orange bei einer schwach sauren Lösung oder gelb bei einer ganz schwach sauren Lösung.
Was versteht man unter dem pH-Wert?
Der pH-Wert ist ein Maß für die Stärke einer sauren Lösung. Je kleiner der pH-Wert, desto stärker sauer ist die Lösung. Hier ein paar Beispiele:
- pH = 5: eine schwach saure Lösung
- pH = 3: schon ziemlich sauer!
- pH = 1: sehr sauer, die Hand würde ich hier nicht mehr reinhalten!
- pH = 0: saurer geht es nicht mehr
Bei einem pH-Wert von 7 liegt eine neutrale Lösung vor, die weder sauer noch alkalisch ist. Wasser hat den pH-Wert 7, wenn es nicht verunreinigt ist.
Ist der pH-Wert größer als 7, handelt es sich nicht mehr um eine saure Lösung, sondern um eine alkalische Lösung, auch "Lauge" genannt.
- pH = 9: eine schwach alkalische Lösung, ein wenig stärker als Seifenlauge
- pH = 11: schon sehr alkalisch, darf nicht mehr ins Auge gelangen
- pH = 13: sehr alkalisch, verätzt die Haut und viele Stoffe
- pH = 14: extrem alkalisch, mehr geht nicht, stark ätzend!
Vermischt man eine saure Lösung und eine alkalische Lösung, so können sich die sauren und alkalischen Effekte gegenseitig aufheben. Man sagt: eine Lauge kann eine Säure neutralisieren und umgekehrt.
Messen kann man den pH-Wert entweder mit einem speziellen Messgeräte, einem pH-Meter, oder mit Universalindikator, einem Farbstoffgemisch, dessen Farbe von dem jeweiligen pH-Wert abhängt. Der Univeralindikator in unserer Schule ist im sauren Bereich orange bis rot, im alkalischen Bereich blaugrün bis tiefblau, und im neutralen Bereich (pH = 7) grün.
Das Becherglas mit der sauren Lösung und dem Universalindikator wird nun auf ein magnetisches Rührgerät gestellt. In diesem Rührgerät befindet sich ein Magnet, der durch einen Elektromotor zum schnellen Drehen gebracht wird.
In das Becherglas wird dann ein sogenannter Rührfisch gegeben. Das ist ein kleiner Magnet, der von Kunststoff ummantelt ist. Der große Magnet im Magnetrührer dreht sich und bewegt dadurch den kleinen Magneten im Rührfisch mit, so dass sich dieser auch dreht. Dadurch wird die Lösung im Becherglas schön gleichmäßig durchgerührt.
An dem Stativ wird nun eine Bürette befestigt, die mit Natronlauge gefüllt ist. Beim Befüllen der Bürette muss man ziemlich aufpassen, damit nichts überläuft und auf die Hände oder in die Augen kommt. Also Schutzhandschuhe anziehen und Schutzbrille aufsetzen und beim Befüllen natürlich einen Trichter verwenden.
Am unteren Ende der Bürette befindet sich ein Hahn, der geöffnet werden kann. Beim Befüllen der Bürette muss dieser Hahn quer stehen, damit keine Flüssigkeit aus der Bürette herausläuft.
Die Bürette ist mit einer Skala gekennzeichnet, an der man ablesen kann, wie viel Lauge bereits aus der Bürette herausgetropft ist, wenn man den Hahn öffnet.
Der Hahn der Bürette wird nun geöffnet. Die Natronlauge tropft in das Becherglas mit der sauren Lösung. Durch den rotierenden Rührfisch wird die Lauge gleichmäßig im Becherglas verteilt.
Beobachtungen, weitere Durchführung
je nachdem, wie stark sauer die Lösung im Becherglas ist, kann es eine ganze Weile dauern, bis man überhaupt etwas beobachten kann. Erst mal passiert wahrscheinlich gar nichts, die Lösung im Becherglas bleibt rot. Irgendwann werden aber die Tropfen, die aus der Bürette in die Lösung fallen, für eine kurze Zeit blau. Es handelt sich ja schließlich um eine Lauge, die den Indikator blau färbt. Die Blaufärbung löst sich aber sehr schnell wieder auf und verschwindet.
Aber nach einiger Zeit bleibt die Blaufärbung der hineinfallenden Tropfen länger bestehen. Jetzt sollte man aufpassen und den Hahn der Bürette etwas enger stellen, so dass nicht mehr so viele Tropfen pro Sekunde herausfallen.
Wenn man richtig gut gearbeitet hat, sieht man nach wenigen Tropfen, dass die Lösung im Becherglas grün geworden ist. Jetzt sollte man den Hahn der Bürette sofort schließen. Wenn man hier nicht aufpasst, wird die Lösung nach zwei oder drei weiteren Tropfen sofort blau. Dann hat man den Zeitpunkt der Neutralisation verpasst. Den meisten Schüler(innen) passiert das am Anfang, manchen Lehrern auch. Das ist auch nicht weiter schlimm, denn ein oder zwei Tropfen mehr oder weniger ändern nichts am Ergebnis der Berechnung, die wir gleich durchführen. Aber spätestens jetzt sollte man den Hahn der Bürette schließen und an der Skala der Bürette ablesen, wie viel Natronlauge zur Neutralisation der sauren Lösung verbraucht wurde.
Wenn ihr diesen Wert notiert habt, könnt ihr den Rest der Lauge aus der Bürette in das Becherglas fließen lassen. Den Inhalt des Becherglases könnt ihr dann in den Ausguss geben, er ist nicht besonders stark sauer oder alkalisch. Lasst auf jeden Fall viel Leitungswasser dazu laufen, um die Lösung weiter zu verdünnen. Die Bürette wird mit Leitungswasser gereinigt, am Ende lasst ihr etwas destilliertes Wasser durch die Bürette laufen.
Berechnung der Säure-Konzentration
Wie spielen jetzt einmal ein Fallbeispiel durch. Angenommen, ihr hattet in dem Becherglas genau 100 ml Essigsäure unbekannter Konzentration und habt genau 17 ml Natronlauge der Konzentration c(NaOH) = 1 mol/l verbraucht.
Schritt 1: Berechnung von n(NaOH)
Als erstes berechnen wir die Stoffmenge der verbrauchten Natronlauge. Einfach ausgedrückt, versteht man unter der Stoffemenge die "Anzahl der Mole". Ein Mol enthält ja bekanntlich 6,022 * 1023 Teilchen. Wer diesen Begriff nicht kennt, sollte sich schnellstens ein Chemiebuch der Sekundarstufe I besorgen und das alles noch einmal nachlesen. Oder lest das auf meiner Homepage nach: "Der Mol-Begriff".
Die Stoffmenge n wird aus der Konzentration des Stoffes c und dem Volumen V berechnet. Die Konzentration c(NaOH) betrug 1 mol/l, und das Volumen V(NaOH) war 17 ml bzw. 0,017 l.
Die Gleichung zur Berechnung von n lautet $n = c \cdot V$. Die Konzentration muss also mit dem Volumen multipliziert werden. Übertragen wir das auf unser konkretes Beispiel:
$n(NaOH) = c(NaOH) \cdot V(NaOH) = 1 mol/l \cdot 0,017 l = 0,017 mol$
Wir haben also eine Stoffmenge von n(NaOH) = 0,017 mol in die saure Lösung hineintropfen lassen.
Schritt 2: Aufstellen der Reaktionsgleichung
Die Reaktionsgleichung für die Reaktion von Essigsäure mit Natronlauge sieht so aus:
$CH_{3}COOH + NaOH \to CH_{3}COONa + H_{2}O$
Schritt 3: Berechnung von n(Essigsäure)
Eine Einheit Essigsäure wird also durch genau eine Einheit Natronlauge neutralisiert. Für 1 mol Essigsäure wird 1 mol Natronlauge benötigt, für 0,3 mol Essigsäure 0,3 mol Natronlauge und so weiter.
Wenn wir also 0,017 mol Natronlauge verbraucht haben, heißt das, dass sich in dem Becherglas auch genau 0,017 mol Essigsäure befunden haben.
Schritt 4: Berechnung von c(Essigsäure)
Die Konzentration eines Stoffes hängt von der Stoffmenge n und dem Volumen der Lösung V ab. Je höher die Stoffmenge, desto größer die Konzentration, und je größer das Volumen, desto geringer die Konzentration. Das führt dann zu der Gleichung
$c = \frac{n}{V}$
Die Stoffmenge n(Essigsäure) hatten wir mit 0,017 mol ermittelt, und V(Essigsäure) ist genau 0,1 l. Damit kommen wir auf c(Essigsäure) = 0,17 mol/l.
Aufgaben zur Selbstkontrolle
Leicht:
Für die Neutralisation von 200 ml Ameisensäure unbekannter Konzentration wurden 67 ml Natronlauge der Konzentration 0,1 mol/l benötigt. Berechne die Konzentration der Ameisensäure
Schwerer:
Für die Neutralisation von 83 ml Buttersäure unbekannter Konzentration wurden 34 ml Natronlauge der Konzentration 0,3 mol/l benötigt. Berechne die Konzentration der Buttersäure.
Zu den Lösungen - aber versucht es erst einmal ohne auf die Lösungen zu schauen!
Vertiefung
Das YouTube-Video "09 Säure-Base-Titration" von Wolfgang Dukom erklärt die Titration und die Berechnungen auf hervorragende Weise. Wer also den Text auf dieser Seite noch nicht verstanden haben sollte, schaut sich am besten mal dieses Video an, in dem die Neutralisation von Salzsäure mit Natronlauge ausführlich erklärt wird.
Eigener Film
Neulich in der Chemiesammlung habe ich mal die Titration einer Lauge mit 1-molarer Salzsäure gefilmt, und zwar vor allem die kritische Phase kurz vor und nach der Neutralisierung. Hier könnt ihr euch den Film anschauen. Man sieht, dass die Grünphase nur für eine sehr kurze Zeit besteht. Ein paar Tropfen später ist die Lösung schon komplett rot.