Wir wollen jetzt wissen, welche Reaktionsgeschwindigkeit exakt zum Zeitpunkt t1 herrschte. Die Durchschnittsgeschwindigkeit in der ersten Sekunde lag bei 0,15 mol l-1 s-1, die Durchschnittsgeschwindigkeit in der zweiten Sekunde bei 0,13 mol l-1 s-1. Aber welche Geschwindigkeit herrschte bei t1? Etwa ein Mittelwert von 0,14 mol l-1 s-1?
Die Antwort zeigt uns die folgende Abbildung:
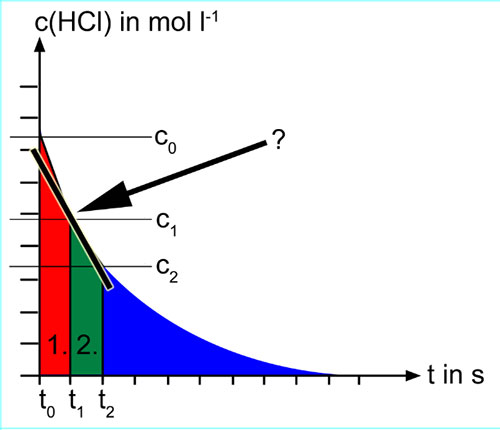
Wir haben hier eine Tangente an die Kurve gelegt, und zwar genau durch den Punkt (t1,c1). Die Steigung dieser Tangente ist jetzt die Reaktionsgeschwindigkeit zum Zeitpunkt t1. Wie Sie aus der Mathematik vielleicht schon wissen, ist das Zeitintervall jetzt gegen Null "geschrumpft". Eine praktische Messung der Momentangeschwindigkeit ist daher nicht möglich, da es kein Messgerät gibt, dass Messungen in einem Zeitintervall von Null durchführt. Wenn man ein möglichst genaues Bild vom zeitlichen Verlauf der Reaktionsgeschwindigkeit haben will, kann man höchstens dafür sorgen, dass die Zeitintervalle möglichst klein sind.
Zeichnet man zum Beispiel das Herausschieben des Kolbenprobers mit einer aktuellen Digitalkamera auf, die im Videomodus 120 Bilder pro Sekunde macht, so kann man das Zeitintervall auf 1/120 Sekunde schrumpfen, was schon ziemlich genaue Darstellungen ergibt. Streng genommen handelt es sich aber immer noch um Durchschnittsgeschwindigkeiten, auch wenn Δt, das Zeitintervall, jetzt extrem klein ist.