4.1 Rekapitulation Schulwissen
In den Schulbüchern der gymnasialen Oberstufe wird die Stoffklasse der Carbonsäuren meistens sehr ausführlich behandelt, vor allem im Zusammenhang mit der Säure-Base-Chemie und dem chemischen Gleichgewicht. Auf die Säure-Base-Eigenschaften der Carbonsäuren wird gern im Zusammenhang mit dem Thema "Starke Säuren - schwache Säuren" eingegangen. Der pKS-Wert von Essigsäure kann beispielsweise leicht aus dem pH-Wert einer 0,1-molaren Lösung hergeleitet werden:
Berechnung des pKS-Wertes von Essigsäure
Eine Essigsäure der Konzentration c(HAc) = 0,1 mol/l hat einen pH-Wert von 2,8. Die Konzentration der Oxonium-Ionen in dieser Lösung beträgt also 10-2,8 mol/l.
Die Gleichgewichtskonstante KS von Essigsäure berechnet sich nach dieser Formel:
$K_{s}=\frac{c(H_{3}O^{+})^{2}} {c_{0}(HAc) - c(H_{3}O^{+})}$
Wenn wir nun die Konzentrationen c = 0,1 mol/l und c = 10-2,8 mol/l in diese Formel einsetzen, erhalten wir:
$K_{s} =\frac{(10^{-2,8})^{2}} {0,1 - 10^{-2,8}} = \frac{10^{-5,6}}{0,098} = 10^{-4,59}$
Der negative dekadische Logarithmus des KS-Wertes ist der pKS-Wert, er hat bei Essigsäure also den Wert pKS = 4,59. Damit ist Essigsäure eine mittelstarke Säure.
Auf diesen Seiten für die Sek. II können Sie noch einmal alles über den pKS-Wert und seine Berechnung nachlesen.
Wenn eine Carbonsäure eine mittelstarke Säure ist, dann ist das Säure-Anion R-COO- logischerweise eine mittelstarke Base.
4.2 Studienvorbereitung
pKS-Werte der Alkansäuren
Vergleichen wir die pKS-Werte einiger Alkansäuren:
- Ameisensäure bzw. Methansäure = 3,77
- Essigsäure bzw. Ethansäure = 4,59
- Propionsäure bzw. Propansäure = 4,87
- Buttersäure bzw. Butansäure = 4,82
- Valeriansäure bzw. Pentansäure = 4,84
- Capronsäure bzw. Hexansäure = 4,85
Offensichtlich hängt die Säurestärke von der Zahl der C-Atome ab, je weniger C-Atome, desto stärker die Säure. Ameisensäure hat den kleinsten pKS-Wert und somit die größte Säurestärke der sechs aufgelisteten Monocarbonsäuren.
Aber ab der Propionsäure scheint die Zahl der C-Atome keinen Einfluss mehr auf die Säurestärke zu haben. Propionsäure bis Capronsäure (C3 bis C6) haben alle den fast gleichen pKS-Wert und damit die fast gleiche Säurestärke.
Gründe für die hohe Säurestärke
Vergleichen wir einmal die Säurestärken von Ethanol und Ethansäure.
- Ethanol = 16
- Ethansäure = 4,59
Denken Sie daran, dass der pKS-Wert ein logarithmisches Maß ist. Die Säurestärke von Essigsäure ist also nicht 3,5 mal so groß wie die von Ethanol, sondern 1011,4 mal so groß, also mehr als hundert Milliarden mal so groß.
Die Ursache für die relativ hohe Säurestärke liegt in der Struktur des Carboxylat-Ions, das nämlich durch zwei Grenzstrukturen stabilisiert wird:
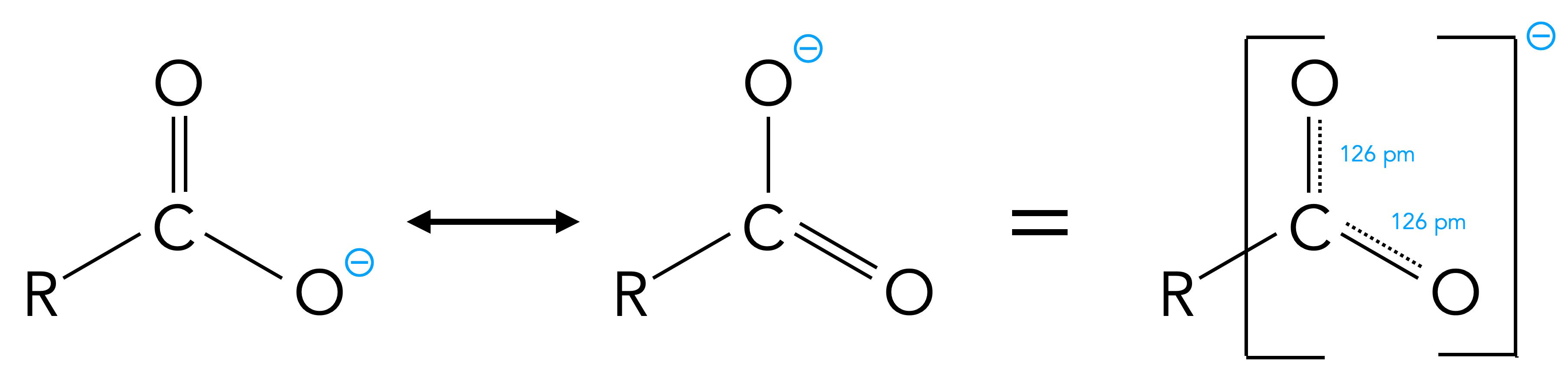
Das Carboxylat-Ion ist mesomeriestabilisiert
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Beide C-O-Bindungen der COO--Gruppe haben die gleiche Länge von 126 pm, was zeigt, dass beide Bindungen absolut gleichwertig sind. Diese Bindungslänge liegt ziemlich genau zwischen der Länge einer C-O-Einfachbindung (134 pm) und einer C=O-Doppelbindung (120 pm).
Eine zweite Ursache für die hohe Stabilität des Carboxylat-Ions ist laut [1] die sp2-Hybridisierung des zentralen C-Atoms: "Das positiv polarisierte und sp2-hybridisierte Kohlenstoffatom übt einen starken elektronenziehenden induktiven Effekt auf die benachbarten Gruppen aus."
Einfluss von -I-Substituenten
Substituenten am alpha-C-Atom (also dem C-Atom, das der COOH-Gruppe direkt benachbart ist) haben einen großen Einfluss auf die Säurestärke der Monocarbonsäuren. Schauen Sie sich dazu die folgenden pKS-Werte aus [1] an:
- CH3-COOH = 4,76
- Cl-CH2-COOH = 2,82
- Cl2-CH-COOH = 1,26
- Cl3-C-COOH = 0,63
- F3-C-COOH = 0,23
Elektronenziehende Substituenten wie bei den Chlor- oder Fluoressigsäuren erhöhen durch ihren -I-Effekt die Acidität erheblich.
Einfluss der Entfernung des -I-Substituenten von der COOH-Gruppe
In [2] finden wir eine schöne Darstellung, die uns zeigt, welchen Einfluss die Entfernung des -I-Substituenten von der COOH-Gruppe auf die Säurestärke der Carbonsäure hat:
- Butansäure = 4,81
- 4-Chlorbutansäure = 4,55
- 3-Chlorbutansäure = 4,05
- 2-Chlorbutansäure = 2,85
Bereits das recht weit entfernte Cl-Atom an Position 4 hat schon einen merkbaren Einfluss auf die Säurestärke, der pKS-Wert steigt von 4,81 auf 4,55. In absoluten Zahlen ausgedrückt steigt die Säurestärke (KS-Wert, Säurekonstante) von 155 * 10-7 auf 282 * 10-7, also fast auf das Doppelte. Wenn das Cl-Atom noch eine Position näher an die COOH-Gruppe rückt, steigt die Säurestärke auf 891 * 10-7, das ist schon 5,7 mal so sauer. Der pKS-Wert der 2-Chlorbutansäure beträgt 2,85 oder 10-2,85, was dem Wert 14.125 * 10-7 entspricht. Damit ist die 2-Chlorbutansäure ca. 91 mal so sauer wie die Butansäure.
So richtig deutlich wird der Einfluss der Entfernung, wenn man nicht die nicht logarithmischen KS-Werte (mit 1000 multipliziert) graphisch darstellt:
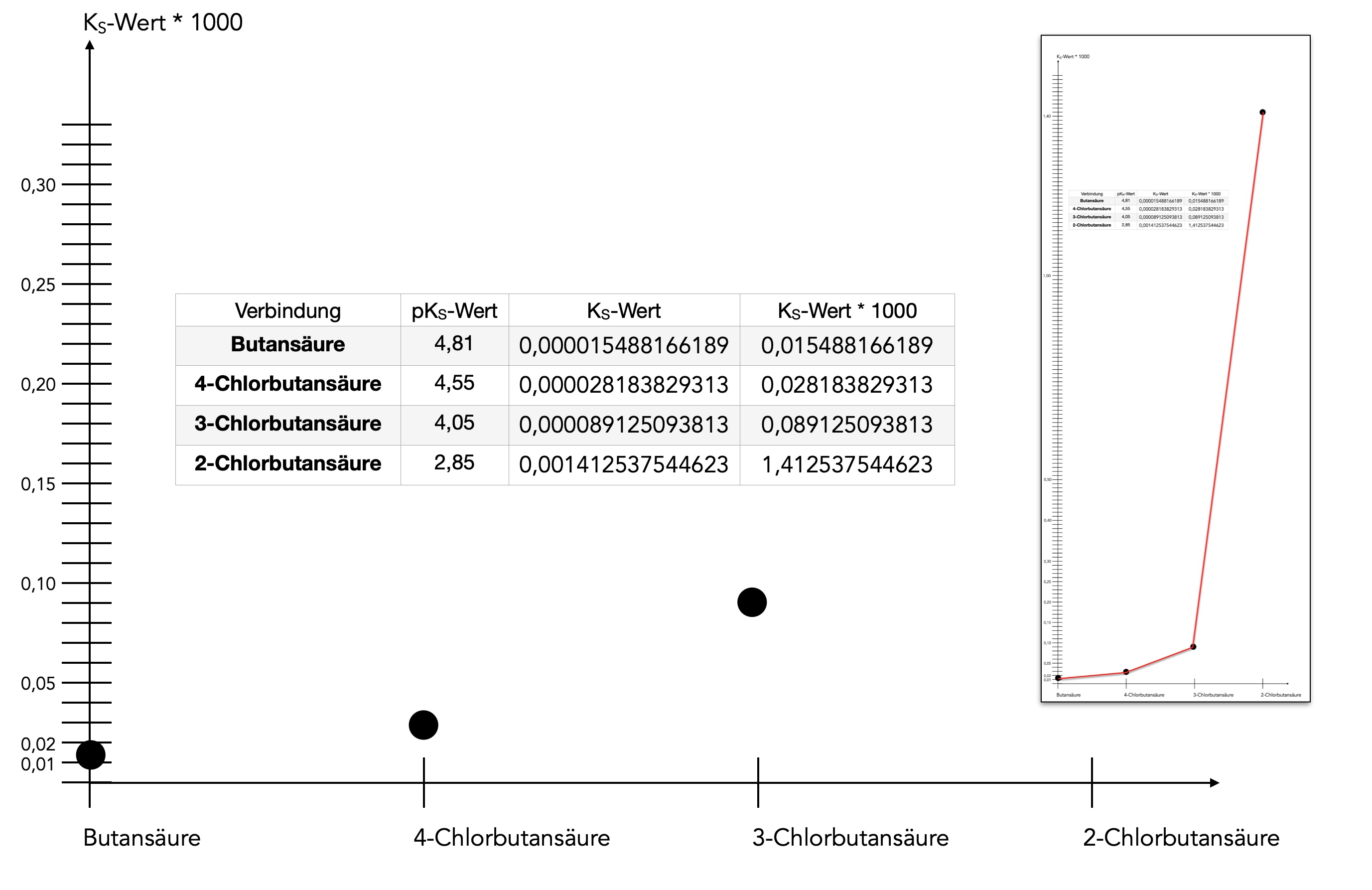
Einfluss der Entfernung des -I-Substituenten auf die Säurestärke einer Carbonsäure
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Die KS-Werte von Butansäure, 4-Chlor- und 3-Chlorbutansäure konnten noch ganz vernünftig dargestellt werden, der Wert für die 2-Chlorbutansäure sprengt jedoch den Rahmen, wie man in dem kleinen Bild gut sehen kann.
Einfluss von +I-Substituenten
Logischerweise müssten dann Substituenten mit einem +I-Effekt die Säurestärke vermindern. Das wollen wir einmal anhand der Pentansäuren überprüfen.
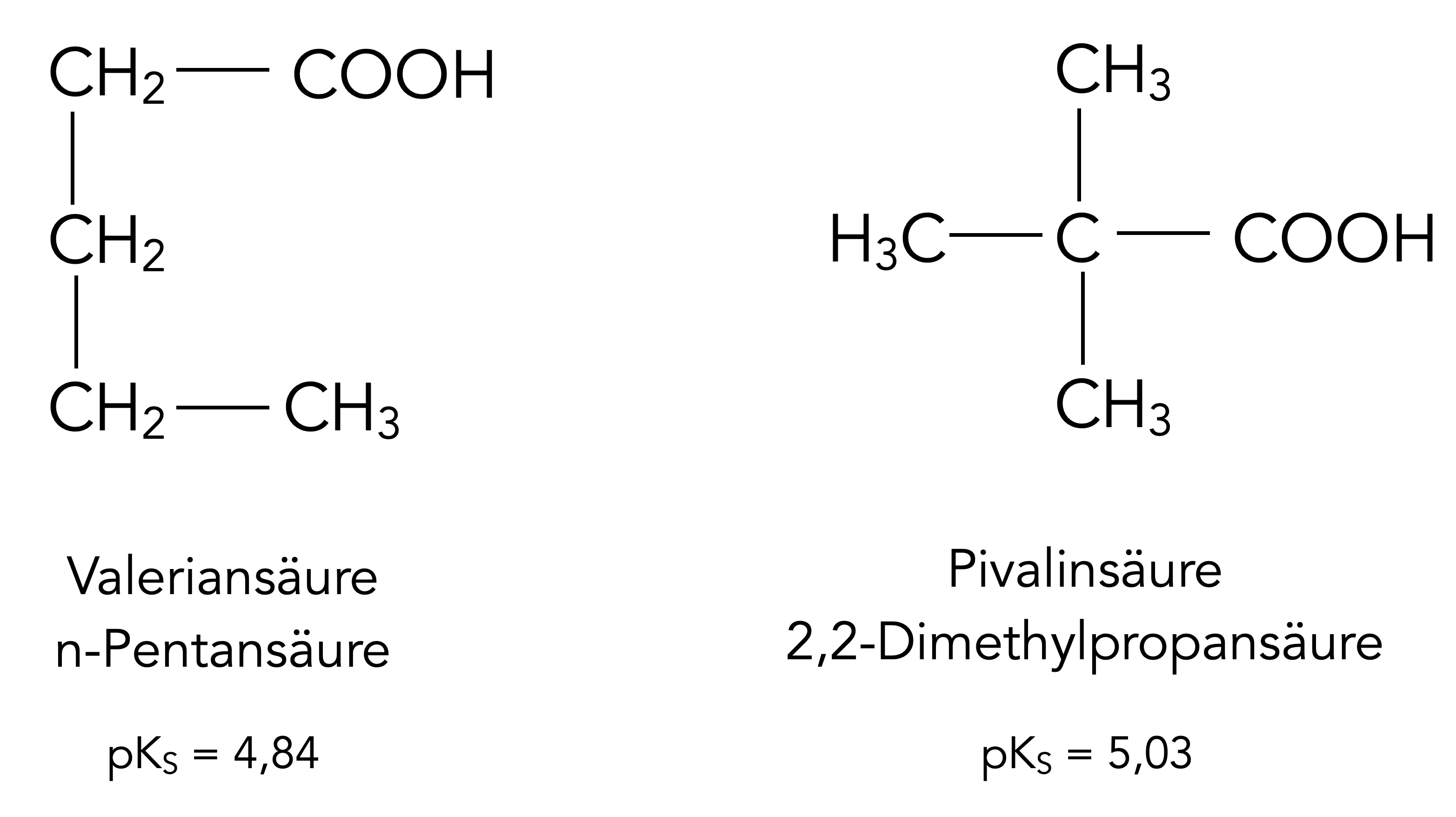
pKS-Werte von Valeriansäure und Pivalinsäure
Autor: Ulrich Helmich 05/2024, Lizenz: Public domain
Die 2,2-Dimethylpropansäure hat tatsächlich eine (etwas) geringere Säurestärke als die isomere n-Pentansäure. Die drei Methylgruppen üben einen +I-Effekt auf das α-C-Atom und damit etwas schwächer auch auf die COOH-Gruppe aus. Dieser +I-Effekt scheint etwas größer zu sein als der ebenfalls vorhandene +I-Effekt der Propyl-Gruppe bei der n-Pentansäure.
Den Einfluss von +I-Substituenten auf die Säurestärke von Carbonsäuren kann man sich auch klarmachen, wenn man die pKS-Werte der ersten drei oder vier Alkansäuren vergleicht.
- Ameisensäure bzw. Methansäure = 3,77
- Essigsäure bzw. Ethansäure = 4,59
- Propionsäure bzw. Propansäure = 4,87
Die Ameisensäure hat noch keinen Substituenten an der COOH-Gruppe, die Essigsäure hat einen kleinen CH3-Substituenten mit einem +I-Effekt, und die Propionsäure hat schon einen etwas größeren C2H5-Substituenten mit einem etwas stärkeren +I-Effekt.
Dicarbonsäuren
Dicarbonsäuren besitzen zwei COOH-Gruppen. Carboxy-Gruppen üben bekanntlich einen -I-Effekt auf benachbarte Atome oder Atomgruppen aus, ähnlich wie Chlor- oder Fluor-Atome. Daher sollte Oxalsäure (HOOC-COOH) einen deutlich niedrigeren pKS-Wert haben als Essigsäure. Vergleichen wir einmal:
- Essigsäure = 4,76
- Oxalsäure = 1,27 / 4,19
Selbst der zweite pKS-Wert der Oxalsäure ist noch niedriger als der pKS-Wert der Essigsäure. Auch die folgenden Dicarbonsäuren haben einen niedrigeren ersten pKS-Wert als die entsprechenden Monocarbonsäuren:
- Oxalsäure HOOC-COOH = 1,27
- Malonsäure HOOC-CH2-COOH = 2,83
- Bernsteinsäure HOOC-(CH2)2-COOH = 4,20
Man sieht hier regelrecht, wie der -I-Effekt durch die dazwischen liegenden CH2-Gruppen vermindert wird. Je weiter die zweite COOH-Gruppe von der ersten entfernt, desto geringer ist ihr Einfluss auf den pKS-Wert. Dennoch wirkt sich selbst bei vier dazwischen liegenden CH2-Gruppen der -I-Effekt noch aus:
- Adipinsäure HOOC-(CH2)4-COOH = 4,35
- Capronsäure H3C-(CH2)4-COOH = 4,85
Carbonsäuren als Basen
Carboxylat-Ionen als Basen
Dass die Carboxylat-Ion R-COO- der Carbonsäuren Brönsted-Basen sind, sollte auf den ersten Blick klar sein. Durch Anlagerung eines Protons entstehen aus den Carboxylat-Ionen wieder die ursprünglichen Carbonsäuren. Diese Tatsache macht man sich ja auch zu Nutze, wenn man das Salz einer Carbonsäure, beispielsweise Natriumacetat, mit einer stärkeren Säure versetzt, zum Beispiel Schwefelsäure. Die Carbonsäure - hier Essigsäure - wird dann quasi aus dem Salz "ausgetrieben" oder "verdrängt".
Carboxylat-Ionen als Nucleophile
Die negativ geladenen Carboxylat-Ionen sind starke Nucleophile. Sie können beispielsweise mit Halogenalkanen Ester bilden:
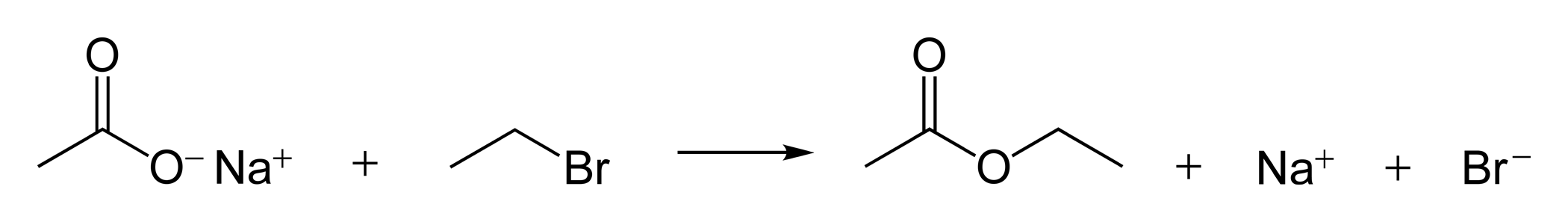
Bildung eines Carbonsäure-Esters aus einem Carboxylat-Ion und einem Halogenalkan
Benjah-bmm27, Public domain, via Wikimedia Commons
Carboxy-Gruppen als Basen
Aber auch die Carboxy-Gruppe COOH selbst kann als Base auftreten. Beide O-Atome der COOH-Gruppe können protoniert werden - ein analoger Vorgang zur Protonierung eines Wasser-Moleküls zum Oxonium-Ion H3O+.
Das O-Atom der C=O-Gruppe kann allerdings noch leichter protoniert werden als das O-Atom der OH-Gruppe. Wieder einmal ist hier ein +M-Effekt am Werke, also die Stabilisierung durch mehrere Grenzstrukturen.
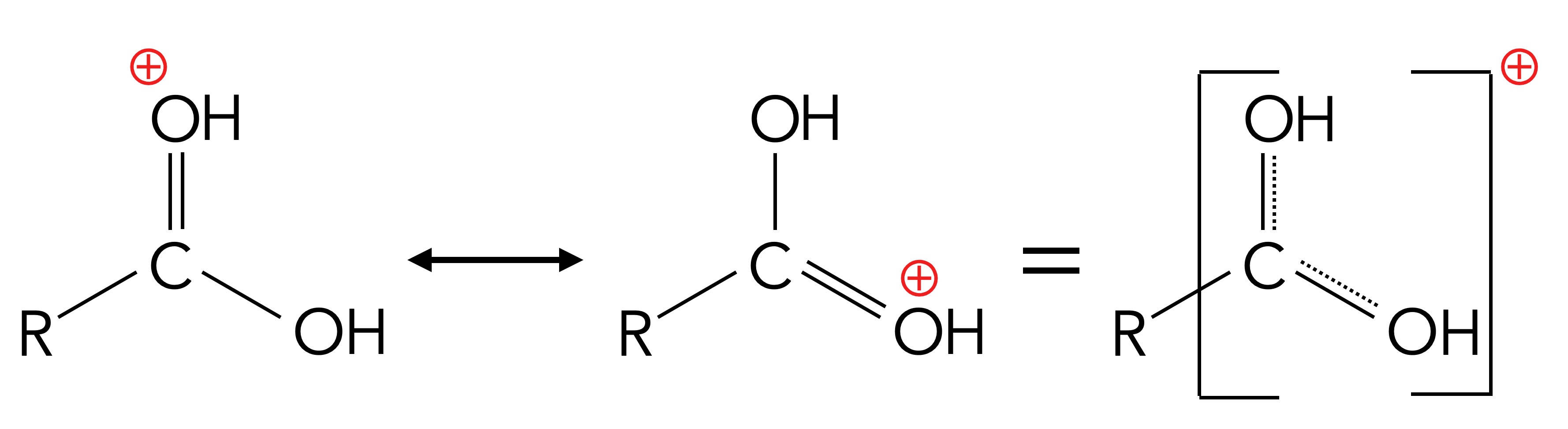
Mesomeriestabilisierung der protonierten COOH-Gruppe
Autor: Ulrich Helmich 05/2024, Lizenz: Public domain
Das chemische Gleichgewicht der Protonierung liegt allerdings extrem weit auf der linken Seite, da die protonierte COOH-Gruppe eine sehr starke Säure ist, der pKS-Wert liegt bei -6.
Dennoch kommt diese Protonierung bei chemischen Reaktionen recht häufig als Anfangsschritt vor, beispielsweise bei der säurekatalysierten Veresterung von Carbonsäuren:
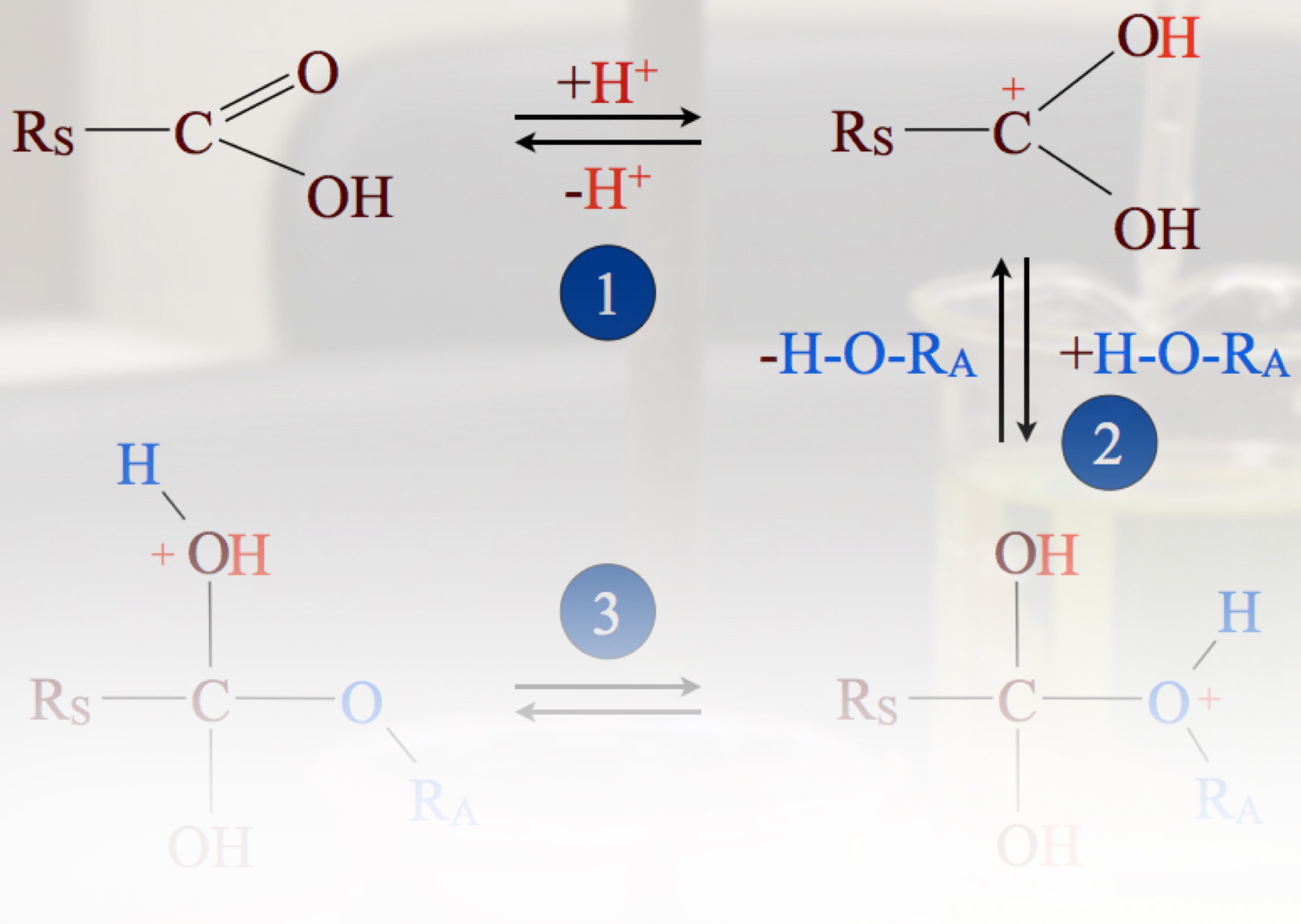
Der erste Schritt der säurekatalysierten Esterbildung
Autor: Ulrich Helmich 05/2024, Lizenz: Public domain
Hier sehen wir eine dritte Grenzstruktur des R-COOH2+-Ions, nämlich ein Carbenium-Ion.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- engl. Wikipedia, Artikel "Carboxylic acid"
Seitenanfang -
Weiter mit den ...