Das C-Atom besitzt nach dem Orbitalmodell auf der K-Schale ein doppelt besetztes 1s-Orbital und auf der L-Schale ein zweifach besetztes 2s-Orbital, zwei einfach besetzte p-Orbitale und ein leeres p-Orbital. Das kann man graphisch wie folgt darstellen:
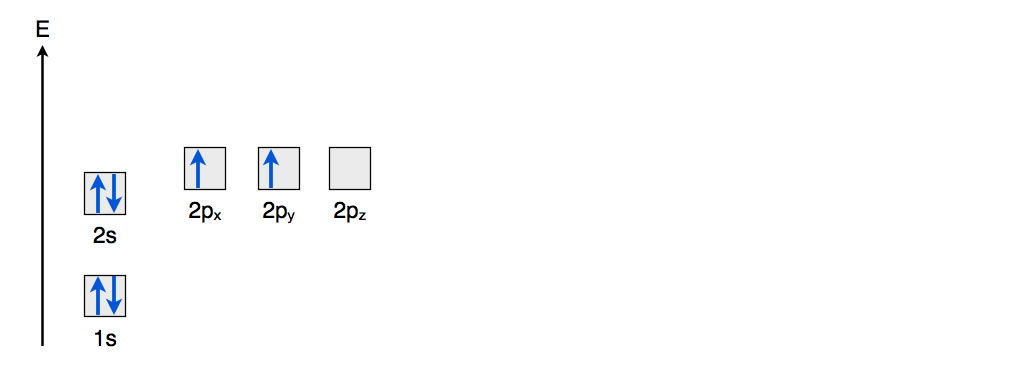
Elektronenkonfiguration / Energiediagramm des C-Atoms
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Jedes quadratische Kästchen steht für ein Orbital. Die blauen Pfeile symbolisieren die Elektronen in den Orbitalen. Ein Orbital fasst maximal zwei Elektronen, die sich in ihrem Spin ("Drehrichtung") unterscheiden müssen. Das 1s-Orbital (im Schalenmodell also die K-Schale) ist am energieärmsten, deswegen befindet sich der Kasten für das 1s-Orbital ganz unten in der Abbildung. Das 2s-Orbital auf der L-Schale ist schon energiereicher, darum ist es in der Abbildung über dem 1s-Orbital angeordnet. Die 2p-Orbitale befinden sich zwar ebenfalls auf der L-Schale, sind aber trotzdem ein wenig energiereicher als das 2s-Orbital. Das kann man in der Abbildung recht gut erkennen.
Nach der sogenannten Hundschen Regel werden zunächst die tiefer gelegenen Orbitale mit Elektronen besetzt, und zwar zunächst mit nur einem Elektron. Erst wenn alle Orbitale mit dem gleichen Energieniveau einfach besetzt sind, werden die Orbitale mit einem zweiten Elektron besetzt. Das 2s-Orbital hat ein niedrigeres Energieniveau als die 2p-Orbitale, daher wird dieses Orbital mit den beiden ersten Elektronen der L-Schale aufgefüllt. Die drei 2p-Orbitale haben alle das gleiche Energieniveau, daher werden sie zunächst mit nur einem Elektron besetzt.
Hybridisierung
Um zu erklären, wieso das C-Atom vier gleichwertige Bindungen eingehen kann, hat man das Konzept der Hybridisierung erfunden.
Promotion
Der erste Schritt dieser Hybridisierung ist die Promotion ("Beförderung") eines Elektrons aus dem 2s-Orbital in das leere 2pz-Orbital, wie die folgende Abbildung zeigt:
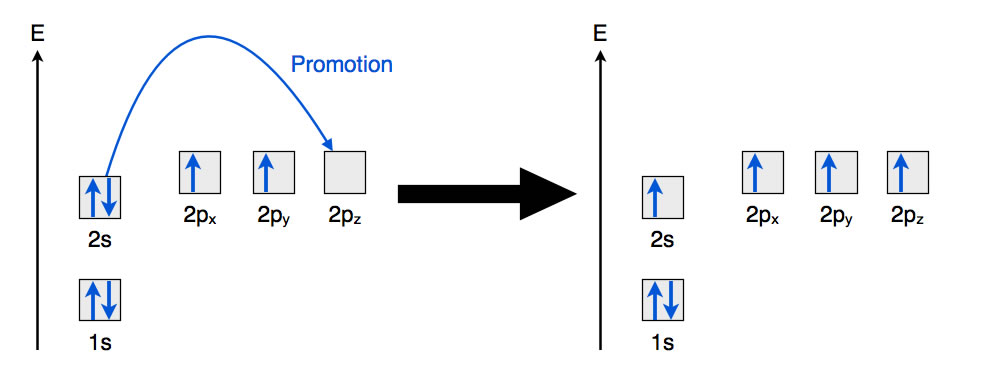
Promotion eines 2s-Elektrons in das leere 2pz-Orbital
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Ein Elektron des 2s-Orbitals wird in ein Orbital mit höherer Energie befördert; die dazu erforderliche Promotionsenergie beträgt 400 kJ/mol. Dieser Vorgang läuft nur deswegen "freiwillig" ab, weil im übernächsten Schritt Energie gewonnen wird.
Hybridisierung
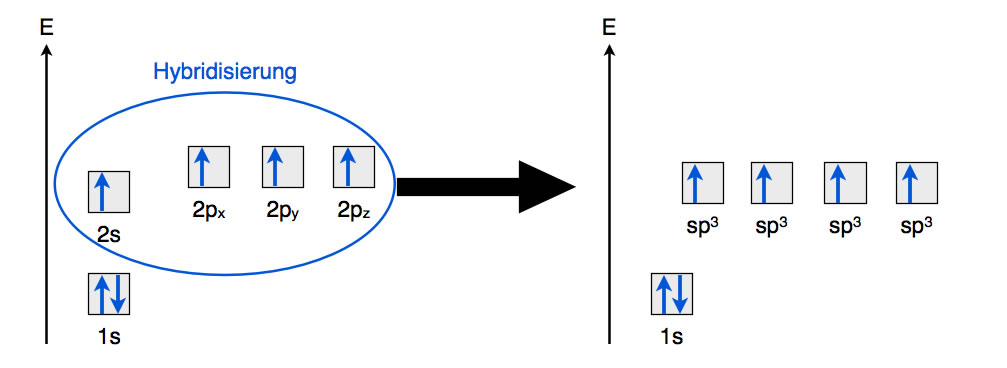
Hybridisierung
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Bei der Hybridisierung wird das einfach besetzte 2s-Orbital mit den drei einfach besetzten 2p-Orbitalen "vermischt", dabei entstehen vier energetisch gleichwertige sp3-Hybridorbitale. Diese vier Hybridorbitale stoßen sich nun aufgrund ihrer negativ geladenen Elektronen gegenseitig ab, und der Zustand minimaler Energie ist die tetraedrische Anordnung der vier Hybridorbitale, wie wir es bereits vom Kugelwolkenmodell her kennen. Diese Hybridisierung erfordert übrigens keine Hybridisierungsenergie, da sich die Gesamtenergie des C-Atoms durch die Hybridisierung nicht ändert. In der Zeichnung kann man gut sehen, dass das Energieniveau der vier Hybridorbitale etwas niedriger liegt als das der p-Orbitale, aber höher als das des 2s-Orbitals.
CH4-Bildung unter Energiegewinn
Der nicht-hybridisierte Kohlenstoff könnte theoretisch CH2-Moleküle bilden. Jedes C-Atom wäre mit zwei H-Atomen verbunden. Bei der Bildung einer solchen kovalenten Bindung wird ein bestimmter Betrag an Bindungsenergie freigesetzt; das CH2-Molekül hätte also weniger Energie als das C-Atom und zwei H-Atome zusammen.
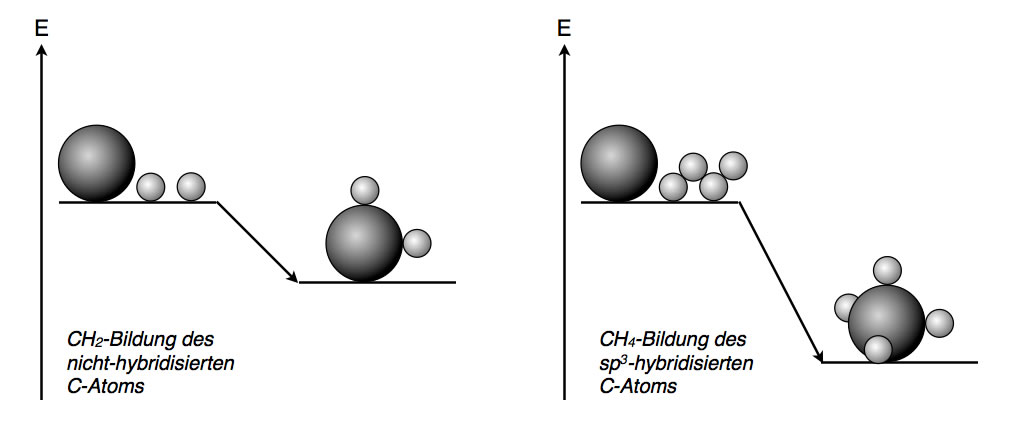
Energiegewinn bei der Bildung von CH4 statt CH2
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Durch die Hybridisierung hat das C-Atom nun vier energetisch gleichwertige Hybridorbitale mit je einem ungepaarten Elektron. Das C-Atom kann auf diese Weise also vier kovalente Bindungen zu anderen Atomen bilden. Der Energiegewinn ist also doppelt so groß bei der Bildung des CH4-Moleküls wie bei der Bildung des CH2-Moleküls des nicht-hybridisierten C-Atoms.
Der Energiegewinn bei der Bildung der vier C-H-Bindungen ist nun wesentlich größer als die zur Promotion des 2s-Elektrons erforderliche Promotionsenergie, so dass der Gesamtvorgang Promotion -> Hybridisierung -> CH4-Bildung exotherm ist.