Dieses Analyseverfahren ist die genaueste Möglichkeit, die Masse von Atomen, Ionen und Molekülen auf mehrere Nachkommastellen zu ermitteln.
Grundprinzip der Massenspektrometrie
- Die Probe wird zunächst verdampft und dann ionisiert, die Moleküle der Probe werden dadurch zu Kationen.
- Die verdampfte, positiv geladene Probe wird dann zu einem engen Strahl gebündelt.
- Dieser Strahl tritt durch einen Elektromagneten hindurch.
- Durch das magnetische Feld werden die positiv geladenen Teilchen des Strahls mehr oder weniger stark von ihrem Weg abgelenkt. Je geringer die Masse der Teilchen, desto stärker die Ablenkung vom geradlinigen Weg.
- Ein Detektor am Ende des Strahlengangs registriert dann die eintreffenden Teilchen.
Aufbau eines Massenspektrometers
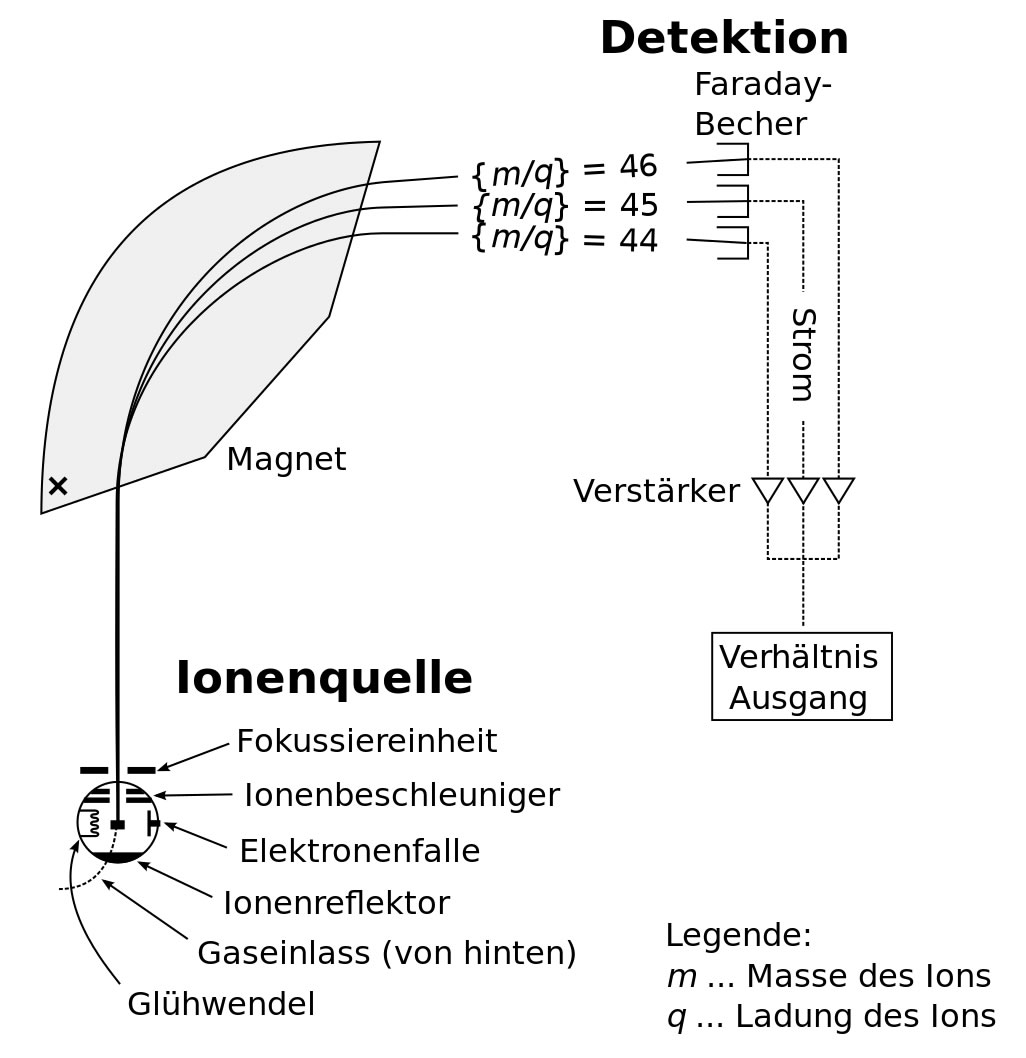
Schematische Zeichnung eines Sektorfeld-Massenspektrometers
Quelle: Deutsche Wikipedia.
This image is in the public domain in the United States because it only contains materials that originally came from the United States Geological Survey, an agency of the United States Department of the Interior. For more information, see the official USGS copyright policy.
Ein Massenspektrometer besteht aus drei Teilen: Der Ionenquelle, dem Analysator und dem Detektor.
Die Ionenquelle dient zur Ionisierung der zu analysierenden Substanz. Auf der Abbildung sieht man den ungefähren Aufbau der Ionenquelle. So richtig gut ist das Bild aus der Wikipedia nicht, aber leider gab es kein besseres public domain Bild. Der Glühwedel dient zum Verdampfen der Probe, der Ionenbeschleuniger zur Erzeugung eines Ionenstrahls, und die Fokussiereinheit zum Bündeln dieses Strahls.
Der Analysator ist der Teil des Massenspektrometers mit dem Magneten. Hier passiert das Wichtigste überhaupt: Der Ionenstrahl wird aufgetrennt. Je leichter die Teilchen sind, desto stärker werden sie vom Magneten abgelenkt. Das sieht man auf dem Wikipedia-Bild ganz gut. Teilchen mit der Masse 44 werden stärker abgelenkt als Teilchen mit der Masse 46.
Der Detektor ist komplizierter aufgebaut. Die Wikipedia nennt sechs verschiedene Typen von Detektoren. Nach der Abbildung 1 scheint es möglich zu sein, mehrere Kationenstrahlen gleichzeitig zu detektieren.
Ionisierungsmethoden
Ionenstoß-Ionisierung
Bei dieser Methode wird die Probe mit Elektronen hoher Energie beschossen. Dadurch werden Elektronen aus den Teilchen der Probe herausgeschlagen, und es bilden sich positiv geladene Kationen. Vor allem werden Elektronen aus den Teilchen der Probe abgetrennt, die nicht allzustark gebunden waren. Vor allen sind dies Elektronen aus nicht-bindenden Kugelwolken oder Orbitalen, beispielsweise die freien Elektronen von Stickstoff- oder Sauerstoff-Atomen. Bei diesem Verfahren entstehen dann meistens sogenannte Radikal-Kationen.
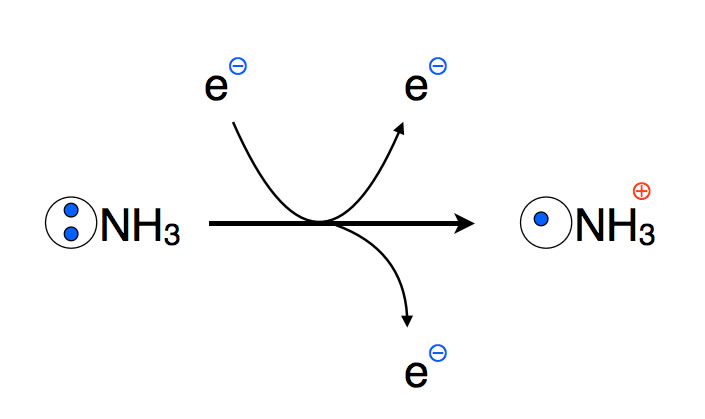
Bildung eines Radikal-Kations am Beispiel des Ammoniak-Moleküls
Das obere Elektron in der Abbildung 2 ist das energiereiche Elektron, mit dem die Probe beschossen wird. Das untere Elektron ist das Elektron, das aus den Teilchen der Probe herausgetrennt wurde. Aus dem Ammoniak-Molekül NH3 bildet sich durch diesen Beschuss das Radikal-Kation *NH3+.
Der Nachteil dieser Methode ist der, dass sie bei leicht zerbrechlichen organischen Molekülen nicht immer funktioniert. Durch den Beschuss mit den energiereichen Elektronen können manche Moleküle in mehrere Bruchstücke zerlegt werden. Zwar kann man diese dann einzeln analysieren, doch oft gibt es dann viele Möglichkeiten, wie man diese Bruchstücke am Schreibtisch wieder zu einem ganzen Molekül "zusammenbauen" kann.
Chemische Ionisierung
Das gasförmige Substrat wird mit einem leicht ionisierbaren und reaktiven Gas gemischt, beispielsweise mit Ammoniak. Dadurch, dass das zugesetzte Gas leicht ionisierbar ist, müssen die Elektronen, mit denen das Gemisch beschossen wird, nicht ganz so energiereich sein wie bei der Ionenstoß-Ionisierung. Es bilden sich dann zunächst Radikal-Kationen wie *NH3+, die dann aber durch Protonentransfer in stabilere Kationen wie NH4+ übergehen. Diese Ionen verbinden sich dann mit dem eigentlichen Substrat, dessen Moleküle dadurch positiv geladen werden. Die Masse dieser Teilchen nimmt dabei natürlich zu, das muss dann bei den folgenden Berechnungen berücksichtigt werden.
Quellen:
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Deutsche Wikipedia, Artikel Massenspektrometrie, abgerufen im Oktober 2019.