Die gesamte Erde ist in ca. 20 km Höhe von einer Ozonschicht umgeben, die die Lebewesen vor schädlicher UV-Strahlung schützt. Die Ozon-Konzentration in dieser Schicht ist nicht allzu hoch. Durch anthropogene Einflüsse (durch den Menschen verursacht) hat die Ozonkonzentration vor allem über der Antarktis drastisch abgenommen. Diese "Ausdünnung" der Ozonschicht wird jetzt als Ozonloch bezeichnet.
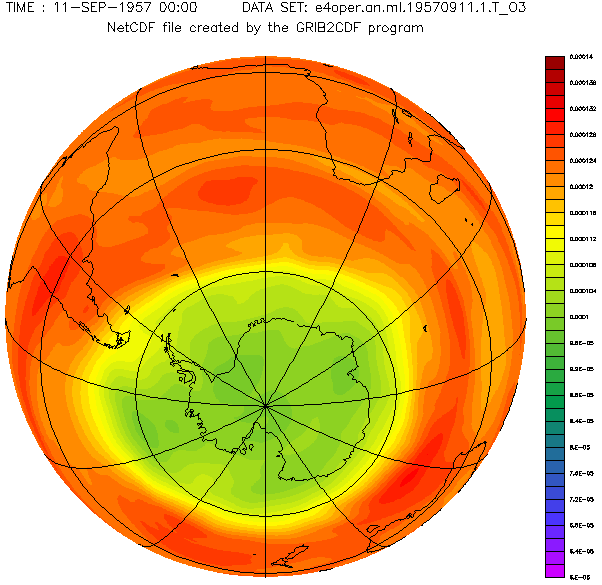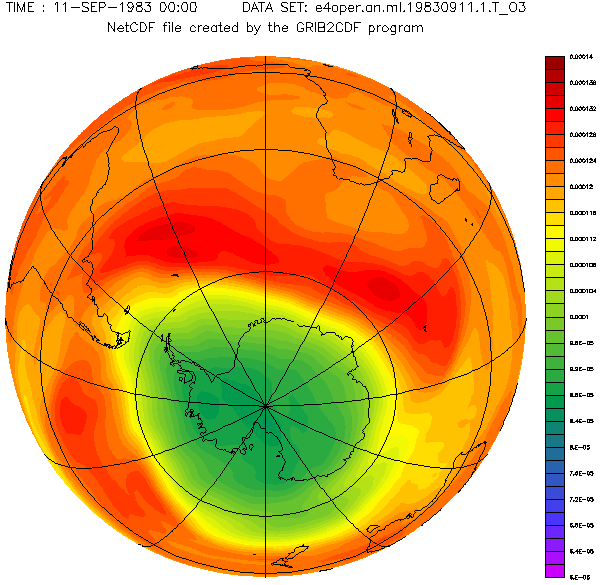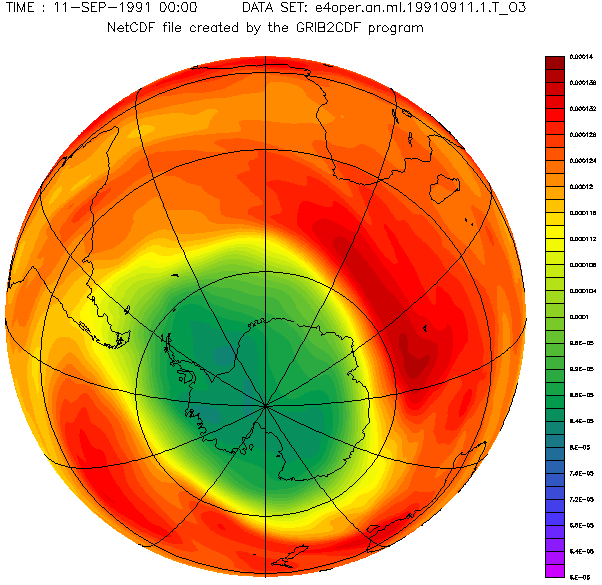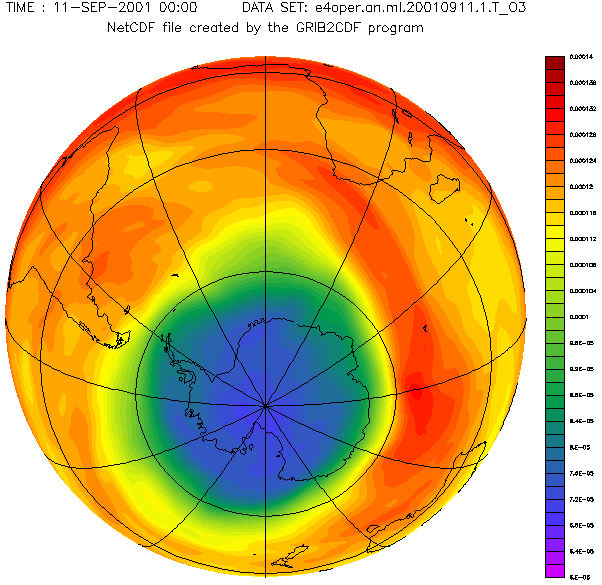
Antarctic ozone layer in September with the hole from 1957 to 2001 year.
Author: RedAndr (Andrew Ryzhkov). This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
Diese schöne von Adrew Ryhkov erstellte animierte Graphik zeigt, wie sich das Ozonloch in den Jahren 1957 bis 2001 verändert hat.
Ursachen der Ozonzerstörung
Hauptursache der Ausdünnung der Ozonschicht sind vor allem Chlor-Radikale aus Fluorchlorkohlenwasserstoffen (FCKWs).
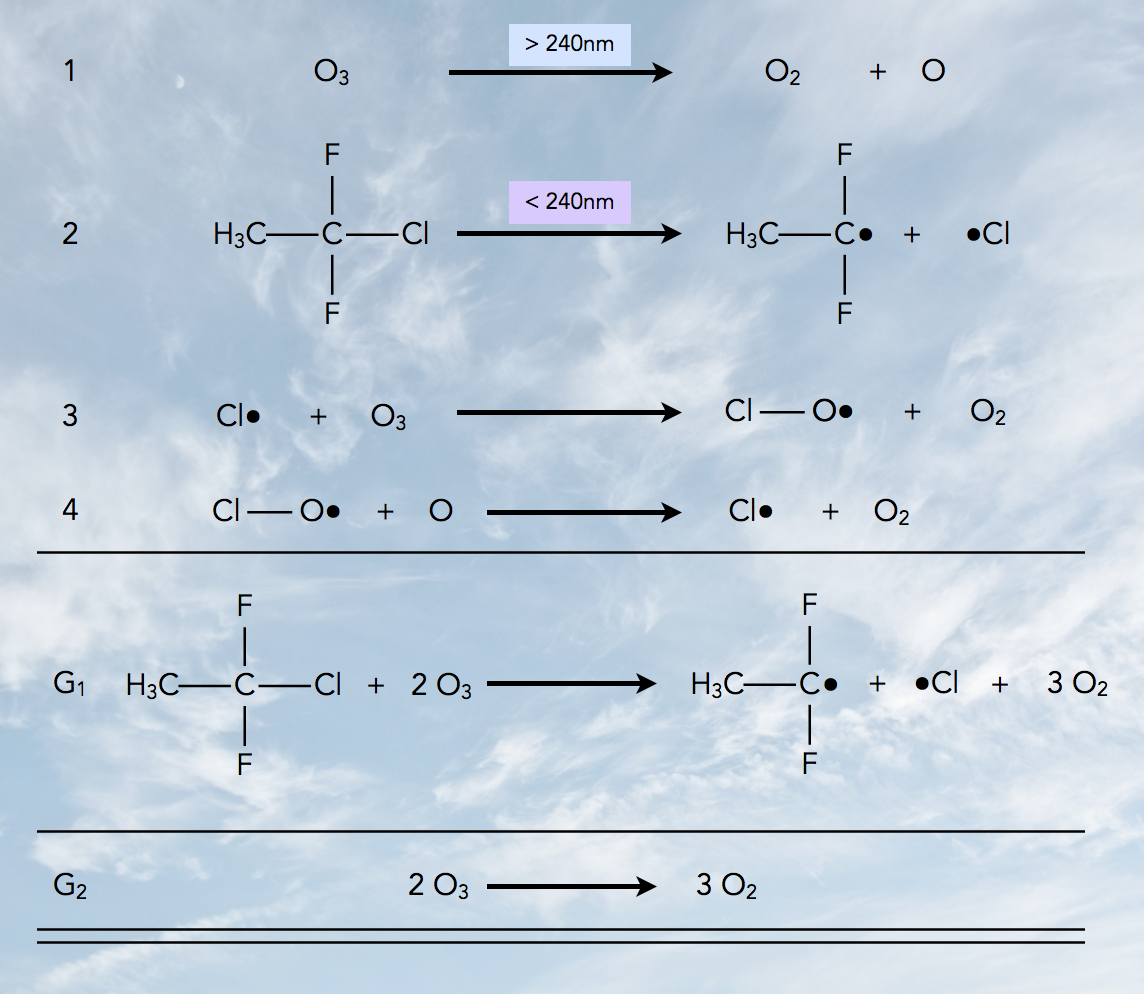
Reaktionen, die zur Bildung des Ozonlochs beitragen
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
- Bereits langwelligeres UV-Licht kann Ozon-Moleküle in Sauerstoff-Moleküle und freie Sauerstoff-Atome (Radikale) zerlegen.
- Kurzwelliges UV-Licht (λ < 240 nm) führt zur Homolyse von Fluorchlor-Kohlenwasserstoffen (FCKWs). Dabei entstehen freie Chlor-Atome (Radikale).
- Die freien Chlor-Atome Cl• reagieren mit Ozon-Molekülen O3 und ziehen ein O-Atom aus dem O3-Molekül heraus, übrig bleibt ein Chlormonooxid-Radikal Cl-O• und ein O2-Molekül.
- Ein Cl-O•-Radikal reagiert mit einem freien O-Atom zu einem neuen freien Chlor-Atom Cl• und einem Sauerstoff-Molekül O2.
G1 ist die Zusammenfassung dieser vier Schritte unter Berücksichtigung des Fluorchlor-Kohlenwasserstoffs und seiner Homolyse-Produkte, und G2 ist die Reaktion, die im Endeffekt abläuft, nämlich der "Umbau" von zwei Ozon-Molekülen zu drei Sauerstoff-Molekülen.
Die FCKW-Moleküle bzw. deren Homolyse-Produkte nehmen an der Gesamtreaktion im Prinzip nicht teil, wirken also eher als Katalysator, was umso schlimmer ist, da ein einziges FCKW-Molekül zum Abbau vieler Tausend Ozon-Moleküle beitragen kann.
Chemisch gesehen handelt es sich bei dem Ozon-Abbau um eine radikalische Kettenreaktion. Die Schritte 1 und 2 sind die Startreaktion, die Schritte 3 und 4 die beiden Kettenfortpflanzungsschritte.
Das Musterbeispiel für radikalische Kettenreaktionen ist die radikalische Substitution am Beispiel der Methan-Chlorierung. Diese Vorgänge sind in dieser Abteilung der Homepage ausführlich erläutert.
In vielen Büchern wird bei der Darstellung dieser Ozonabbau-Reaktionen auf die beiden ersten Schritt verzichtet. Aber die Sauerstoff-Atome in Schritt 4 müssen ja irgendwo herkommen, daher wurde auf dieser Seite das Schema um die beiden Schritte 1 und 2 ergänzt.