Es gibt mehrere Möglichkeiten, wie Radikale entstehen können.
1. Homolyse einer kovalenten Bindung
Einer der bekanntesten Wege ist die homolytische Spaltung einer kovalenten Bindung. Dazu muss die Bindungsdissoziationsenergie dieser kovalenten Bindung überwunden werden, was oft den Einsatz von Wärmeenergie oder Lichtenergie erfordert (Thermolyse bzw. Photolyse).
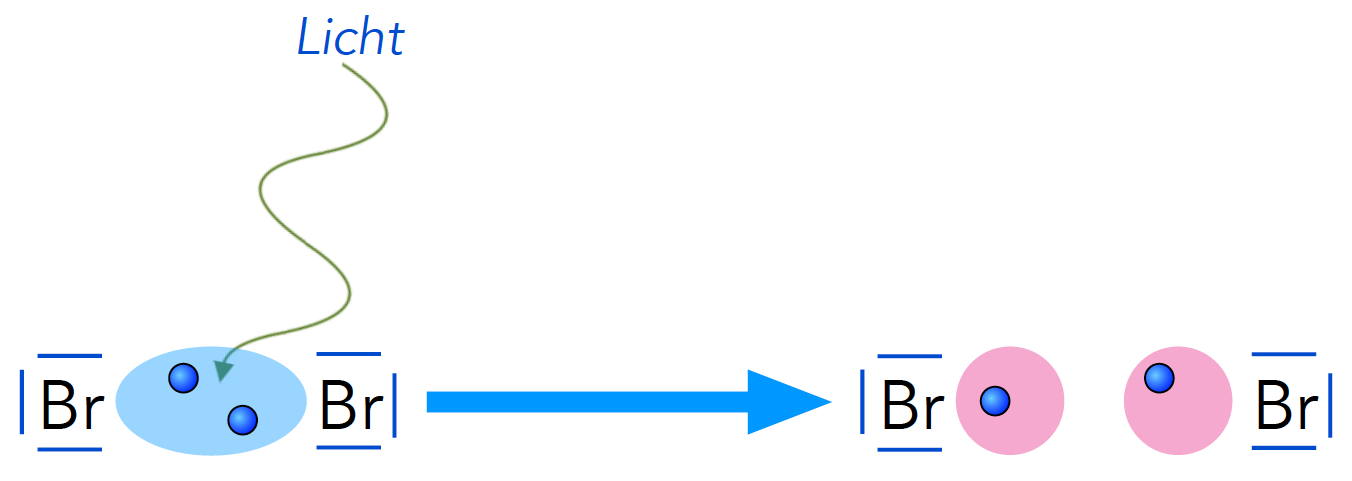
Photolytische Spaltung eines Brom-Moleküls in zwei Brom-Radikale
Die Abbildung 2 zeigt die Startreaktion der Bromierung eines Alkans. Siehe dazu auch "Radikalische Substitution" auf dieser Homepage.
2. Reaktion mit anderen Radikalen / Abstraktion
Stößt ein Radikal auf ein Molekül, so kann es diesem Molekül ein Atom samt einem Elektron entziehen. Das Radikal verbindet sich dann kovalent mit diesem Atom. Ein bekanntes Beispiel für diese Abstraktionen (so nennt man das Entziehen eines Atoms aus einem Molekül) sind die Kettenfortpflanzungsschritte der Radikalischen Substitution. Als Ergebnis dieser Abstaktion entsteht dann ein neues Radikal.

Ein Brom-Radikal abstrahiert ein Wasserstoff-Atom aus einem Methan-Molekül. Dabei entsteht ein Methyl-Radikal.
3. Addition eines Radikals
Die dritte Möglichkeit zur Bildung eines Radikals ist die Addition eines Radikals an eine Doppelbindung, wie man es beispielsweise von der radikalischen Addition an Alkene kennt.
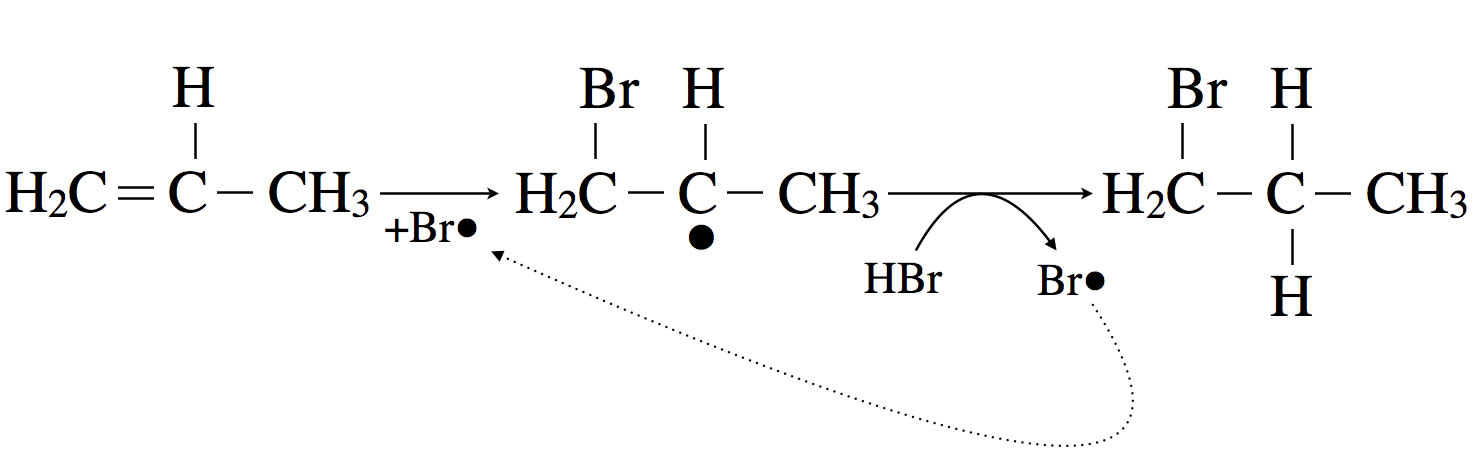
Hydrobromierung von Propen
Bei der Hydrobromierung von Propen addiert sich zunächst ein Brom-Radikal an die C=C-Doppelbindung. Dabei entsteht ein Propyl-Radikal. In einem zweiten Schritt abstrahiert das Propyl-Radikal ein H-Atom aus einem HBr-Molekül.
4. Eliminierung
Die nächste Möglichkeit der Radikalbildung ist jetzt etwas weit hergeholt, aber der Clayden listet sie explizit auf, und daher möchte ich auch auf dieser Seite kurz darauf eingehen. Das Beispiel aus dem Clayden sieht so aus [5]:
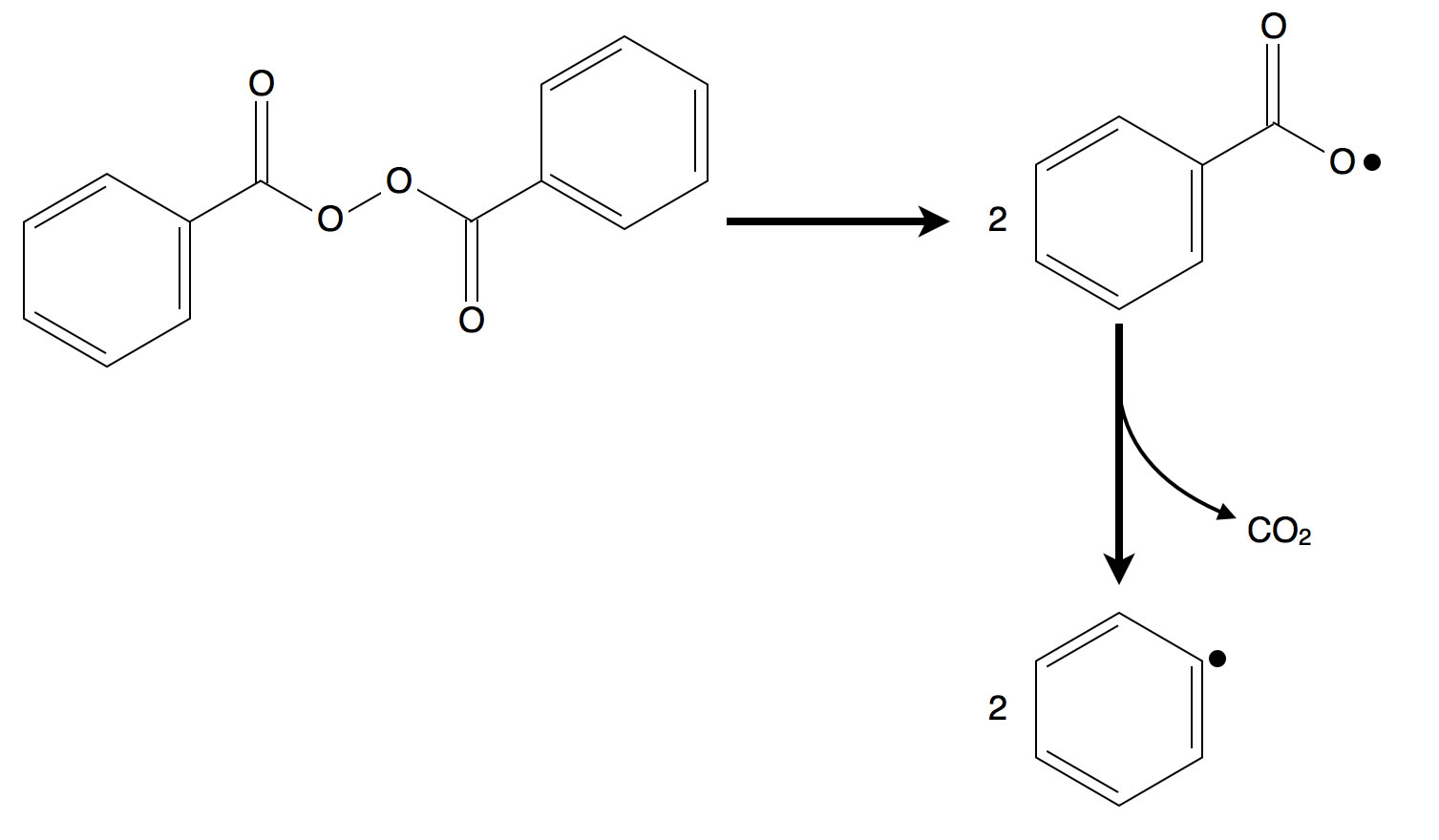
Durch Homolyse von Dibenzoylperoxid entstehen zunächst instabile Radikale wie unter Punkt 1 beschrieben. Durch Eliminierung von Kohlendioxid bilden sich dann Phenylradikale.
Streng genommen, könnte man sagen, dass dies eigentlich keine weitere Möglichkeit der Radikalbildung ist. Denn es ist ja bereits ein Radikal durch homolytische Spaltung entstanden, und dieses Radikal gibt nur Teile seines Moleküls ab, bleibt aber im Prinzip das gleiche Radikal.
5. Einelektronenübertragung
Bei bestimmten organischen Reaktionen findet eine sogenannte Einelektronenübertragung (single electron transfer = SET) statt. Durch Anlagerung eines Elektrons (das von einem Elektronendonator wie zum Beispiel Natrium oder Lithium stammen muss) wird aus einem neutralen Molekül ein negativ geladenes Radikal, ein Radikalanion.
Gibt dagegen ein Teilchen mit einem freien Elektronenpaar eines dieser Elektronen an einen Elektronenakzeptor ab, so erhält dieses Teilchen eine einfach besetzte Kugelwolke und wird zu einem Radikalkation[4].
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- engl. Wikipedia, Artikel DPPH, Zugriff am 04.02.2019
- Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie, John Wiley & Sons, 2011, S. 627f.
- Wikipedia, Artikel Einelektronenübertragung, Zugriff am 04.02.2019
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.