Struktur
Zitronensäure oder Citronensäure ist eine Tricarbonsäure, also eine Carbonsäure mit drei Carboxygruppen. Hier die Strukturformel der Zitronensäure:
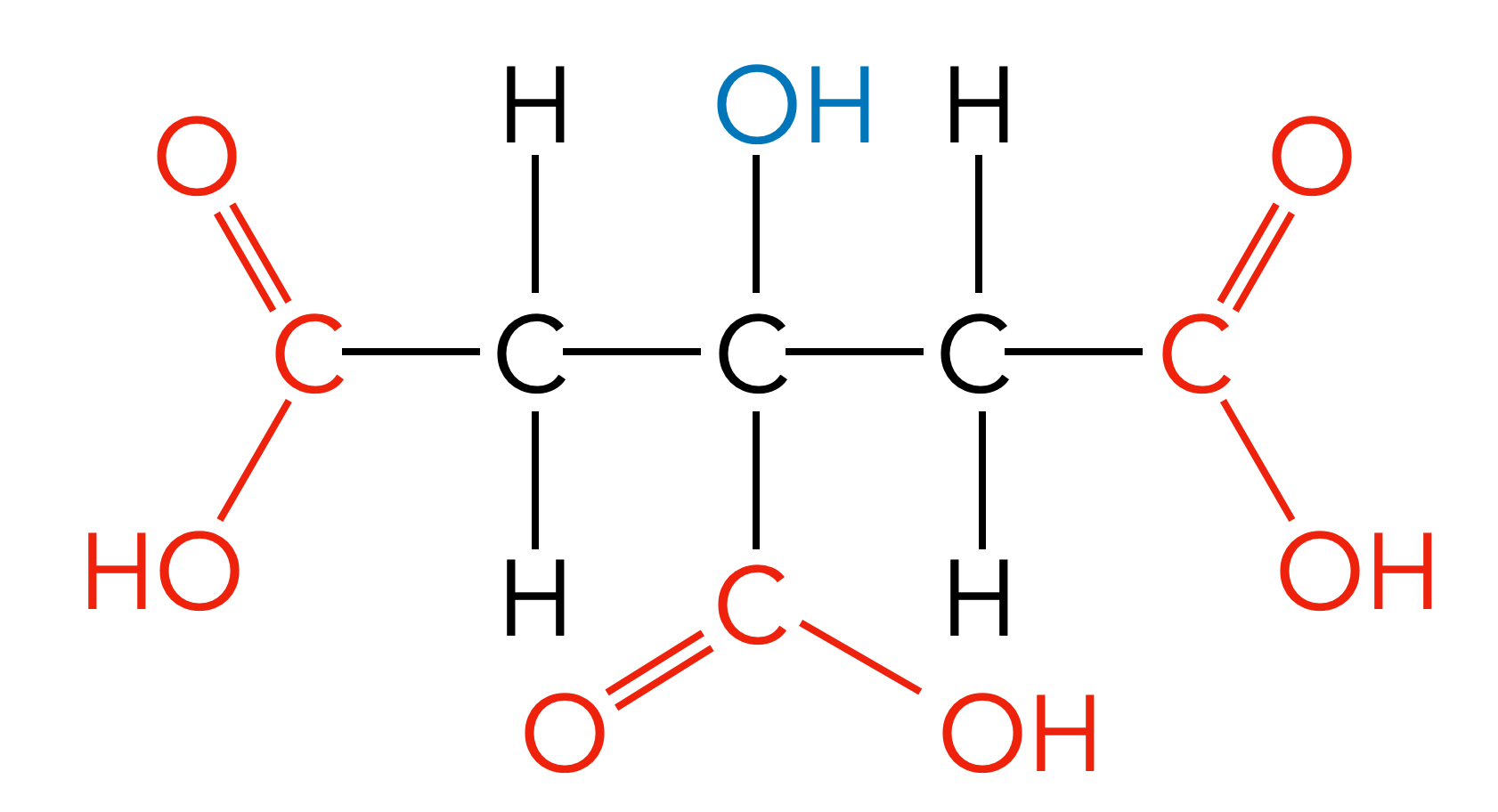
Die Strukturformel der Zitronensäure
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Der korrekte IUPAC-Name der Zitronensäure leitet sich aus dem Propan-Grundgerüst her: 2-Hydroxypropan-1,2,3-tricarbonsäure.
Da die längste durchgehende Kohlenstoffkette jedoch ein Pentan ist, könnte man die Zitronensäure aber auch als 3-Hydroxy-3-carboxy-pentandisäure bezeichnen.
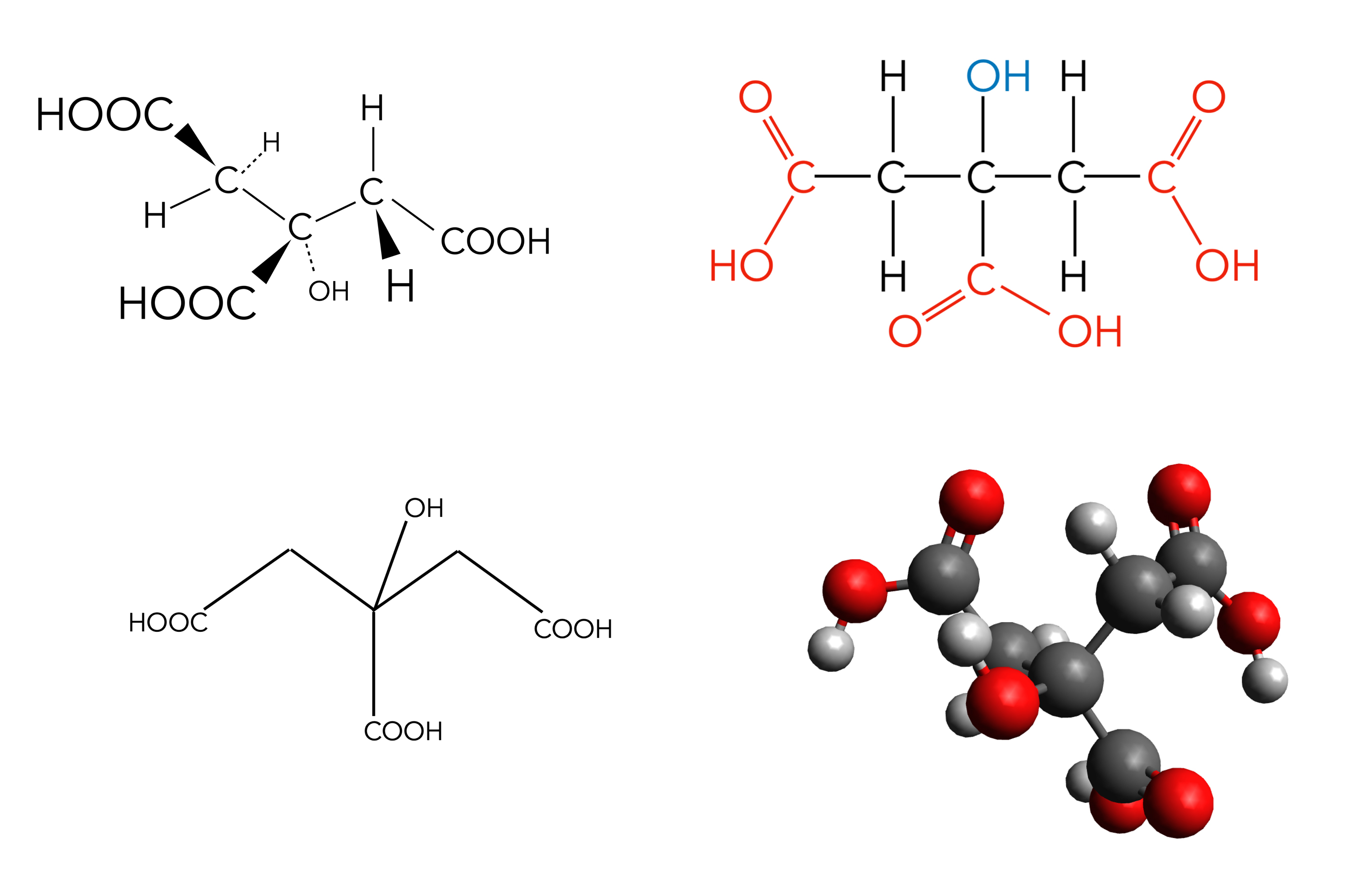
Weitere Darstellungsmöglichkeiten der Zitronensäure
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Auf diesem Bild sieht man neben der "normalen" Strukturformel (oben rechts) noch eine räumliche Strukturformel (oben links), eine Skelettformel (unten links) und ein Molekülmodell (unten rechts) des Zitronensäure-Moleküls.
Physikalische Eigenschaften
Die Eigenschaften der Zitronensäure und andere wichtige Fakten werden in der Wikipedia, auf der Seite von Thomas Seilnacht und auf der Seite von Prof. Blume hervorragend dargestellt. Daher möchte ich hier nur die wichtigsten Eigenschaften zusammenfassen.
Die Zitronensäure (oft auch "Citronensäure" geschrieben) ist eine farblose, bei Zimmertemperatur feste Verbindung mit sehr saurem Geschmack. Der Schmelzpunkt der wasserfreien Zitronensäure liegt bei 153 ºC. Meistens kommt die Zitronensäure aber als Hydrat vor (Im Kristall sind also Wasser-Moleküle regelmäßig eingelagert, und zwar ein H2O-Molekül pro Zitronensäure-Molekül), der Schmelzpunkt dieses Hydrats liegt bei 100 ºC.
Einen Siedepunkt hat die Zitronensäure nicht, sie zersetzt sich nämlich schon vorher bei 175 ºC.
Chemische Eigenschaften
Säurestärke
Zitronensäure ist eine dreiprotonige Säure und hat daher drei pKS-Werte: 3,13 - 4,76 - 6,4. Wenn wir den ersten pKS-Wert mit dem der Essigsäure vergleichen - 4,76 - dann kann man wohl feststellen, dass die Citronensäure mehr als vierzig mal so sauer ist wie die Essigsäure.
Hier für interessierte Leute, die sich mit dem pKS-Wert auskennen, die Rechnung:
- 10-3,13 = 0,000 741 310
- 10-4,76 = 0,000 017 378
- 741/17 = 43,6
Falls Sie "Nachhilfe" zum Thema pKS-Wert brauchen, gehen Sie doch einfach auf meine Seite über den pKS-Wert auf dieser Homepage.
Die Salze der Zitronensäure heißen übrigens Citrate.
Chemische Reaktionen
Wie alle Carbonsäuren kann Zitronensäure mit Alkoholen Ester bilden. Eine - vor allem in biologischen Systemen auftretende Reaktion - ist die Oxidation der Zitronensäure.
Das Musterbeispiel ist wohl der Zitronensäurezyklus oder Citratzyklus, der in jeder aerob lebenden Zelle abläuft. Im ersten Oxidationsschritt des Citratzyklus wird Zitronensäure zu Oxalsuccinat oxidiert, die OH-Gruppe am C-Atom Nr. 2 verliert dabei ihr H-Atom, es bildet sich eine Oxo-Tricarbonsäure, also eine Säure mit drei COOH-Gruppen und einer Ketogruppe.
In der Wikipedia werden außerdem noch die Halogenierung (also die Anlagerung von Chlor- oder Brom), die Anhydridbildung (also die Abspaltung von Wasser) sowie die Amidierung (also die Anlagerung von Ammoniak) erwähnt.
Verwendung
Wegen ihrer kalklösenden Wirkung ist Zitronensäure oft in biologischen Reinigungsmitteln enthalten. Auch zur Konservierung von Lebensmitteln und als Säuerungsmittel wird Zitronensäure häufig eingesetzt (Lebensmittelzusatzstoff E 330). Wegen ihres natürlichen Vorkommens als Fruchtsäure findet sich Zitronensäure auch in vielen Fruchtsäften.
Zitronensäure im Chemieunterricht
Im Chemieunterricht spielt die Zitronensäure an mehreren Stellen eine Rolle. Bei der Behandlung der Zitronenbatterie wird noch nicht so sehr auf die Zitronensäure eingegangen, wohl aber bei der Besprechung von Säure-Base-Titrationen zur Konzentrationsbestimmung, denn die Zitronensäure ist ein schönes Beispiel für eine dreiprotonige Säure. Manchmal wird auch die Isolierung von Zitronensäure aus Zitronen im Chemieunterricht behandelt, ein sehr aufwändiges Verfahren übrigens.
Im Chemie-Leistungskurs wird vielleicht auch gelegentlich über den Citratzyklus und die zentrale Stellung der Zitronensäure in diesem Stoffwechselvorgang gesprochen.