Wasser - seine Bedeutung für das Leben
Eine Eukaryotenzelle besteht im Schnitt zu 80 bis 85% aus Wasser. Wasser ist nicht nur ein wichtiges Strukturelement der Zellen, sondern spielt auch als Lösemittel und als Transportmittel eine wichtige Rolle. Auch bei vielen in der Zelle ablaufenden Reaktionen spielt Wasser eine Rolle als Edukt oder Produkt.
Bei Hydrolysen beispielsweise werden organische Makromoleküle (Eiweiße, Polysaccharide etc.) mit Hilfe von Wasser in ihre Bausteine zerlegt (Aminosäuren, Monosaccharide), und bei Kondensationsreaktionen (wenn sich die Bausteine von Makromolekülen zusammenschließen) wird Wasser als Nebenprodukt freigesetzt. Bei der Oxidation von Kohlenhydraten entsteht Wasser ebenfalls als Nebenprodukt. Für manche Wüstentiere ist dies sogar essentiell, das Oxidationswasser stellt oft die einzige Quelle von Wasser dar.
Auch unter evolutionsbiologischen Aspekten ist Wasser essentiell für das Leben auf der Erde. Alles Leben ist im Wasser entstanden, Themen wie "Der Landgang der Wirbeltiere" oder "Die Eroberung des Landes durch die Pflanzen" sind Standard-Inhalte des Biologie-Unterrichts.
Beschäftigen wir uns zunächst mit dem Aufbau des Wasser-Moleküls.
Aufbau des H2O-Moleküls
Zusammenfassung
Ein Wasser-Molekül setzt sich aus einem Sauerstoff-Atom (O) und zwei Wasserstoff-Atomen (H) zusammen und hat daher die Summenformel H2O. Die drei Atome werden durch gemeinsame Elektronenpaare zusammengehalten (Elektronenpaarbindung, kovalente Bindung) und bilden einen Winkel von 104,5º. Die Bindungslänge der H-O-Bindung beträgt 96,5 pm [2]. Die H-O-Bindung ist stark polar, da das Sauerstoff-Atom die beiden Bindungselektronen der H-O-Bindung stärker anzieht als das H-Atom. Außerdem besitzt das O-Atom des H2O-Moleküls noch zwei freie Elektronenpaare, die wesentlichen Einfluss auf die Eigenschaften des Wasser-Moleküls haben.
Einzelheiten
Wir wollen uns nun näher anschauen, wie ein solches Wasser-Molekül aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen entsteht. Dazu betrachten wir das folgende Bild. Kenntnisse des Orbitalmodells sind dazu nicht notwendig, aber das Kugelwolkenmodell sollte man schon verstanden haben.
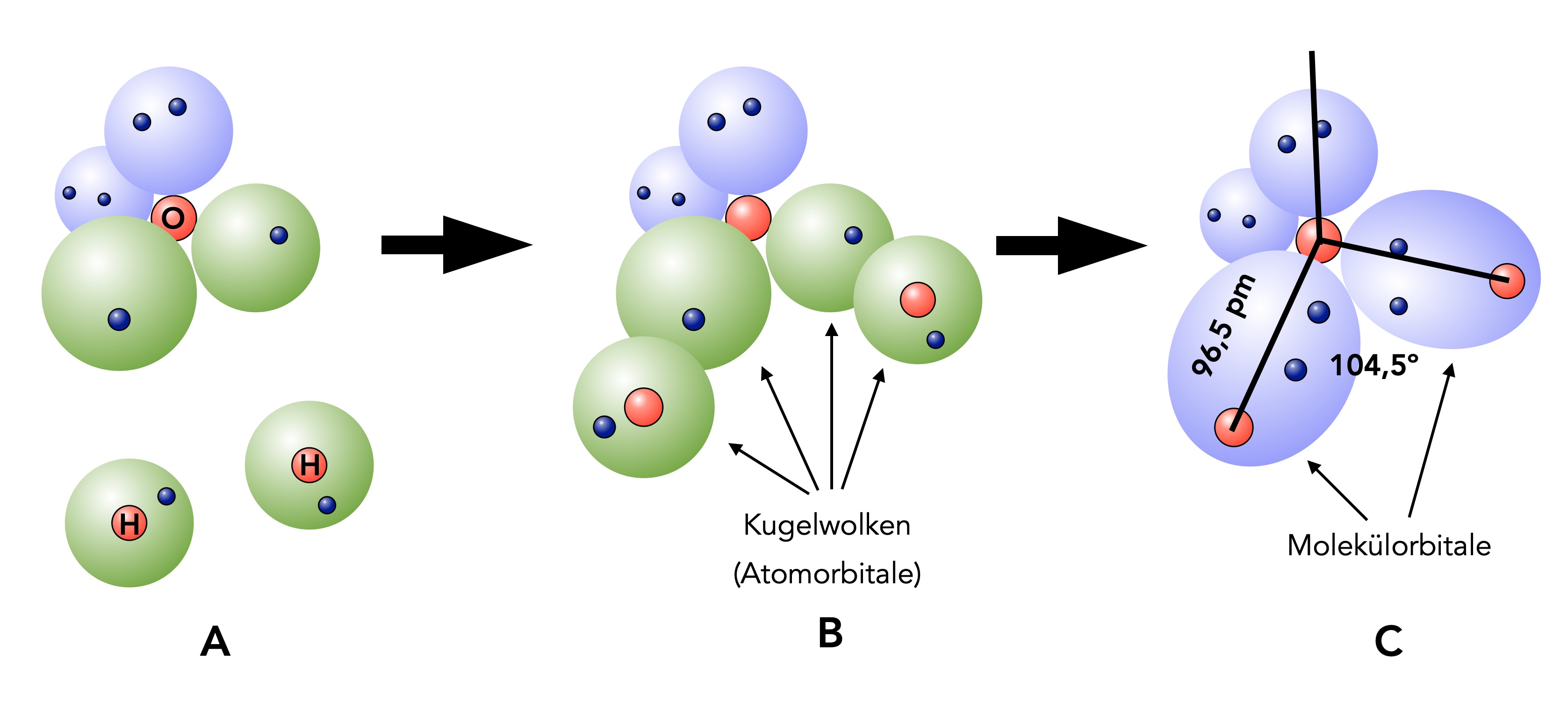
Bildung eines Wasser-Moleküls
Autor: Ulrich Helmich 02/2024, Lizenz: siehe Seitenende
A) Ganz links im Bild sehen wir ein Sauerstoff-Atom, so wie es sich im Kugelwolkenmodell darstellt. Zwei Kugelwolken sind mit zwei Elektronen besetzt (blau gezeichnet), und zwei Kugelwolken sind nur mit je einem Elektron besetzt (grün gezeichnet). Außerdem sehen wir hier zwei Wasserstoff-Atome, deren Kugelwolken (bzw. s-Orbitale, wenn Sie schon Ahnung vom Orbitalmodell haben) nur einfach besetzt sind, daher sind diese Orbitale auch in grün gehalten.
B) In der Mitte des Bildes haben sich die drei Atome schon stark angenähert. Ein H2O-Molekül ist aber noch nicht entstanden.
C) Das gebildete H2O-Molekül sehen wir dann ganz rechts im Bild. Die einfach besetzten Kugelwolken der beiden H-Atome überlappen nun mit je einer einfach besetzten Kugelwolke (bzw. sp3-Hybridorbital) des O-Atoms. Aus den Kugelwolken bzw. Atomorbitalen entstehen durch diese Überlappung gemeinsame Kugelwolken bzw. Molekülorbitale, die mit je zwei Elektronen besetzt sind. Daher sind die beiden entstandenen Molekülorbitale in blau gezeichnet.
Verständnisfrage:
Der Tetraederwinkel beträgt 109,5º, und nach dem Kugelwolkenmodell sollte der H-O-H-Bindungswinkel genau diesen Wert haben.
Begründen Sie, wieso der H-O-H-Bindungswinkel im Wasser-Molekül nur 104,5º beträgt!
Antwort:
Die beiden freien Elektronenpaare am O-Atom sind dafür verantwortlich. Sie stoßen die Bindungselektronen der beiden H-O-Bindungen elektrisch ab, daher verringert sich der H-O-H-Bindungswinkel um fünf Grad.
Wasser ist ein polares Molekül
Wegen der hohen Elektronegativität des Sauerstoff-Atoms werden die Bindungselektronen der H-O-Bindungen von dem O-Atom stärker angezogen als von dem H-Atom. Die beiden H-O-Bindungen sind also keine einfachen kovalenten Bindungen, sondern polare kovalente Bindungen mit dem negativen Pol am O-Atom und dem positiven Pol am H-Atom.
Graphisch drückt man diese Polarität der Bindungen bzw. die Polarität des Wasser-Moleküls dann so aus:
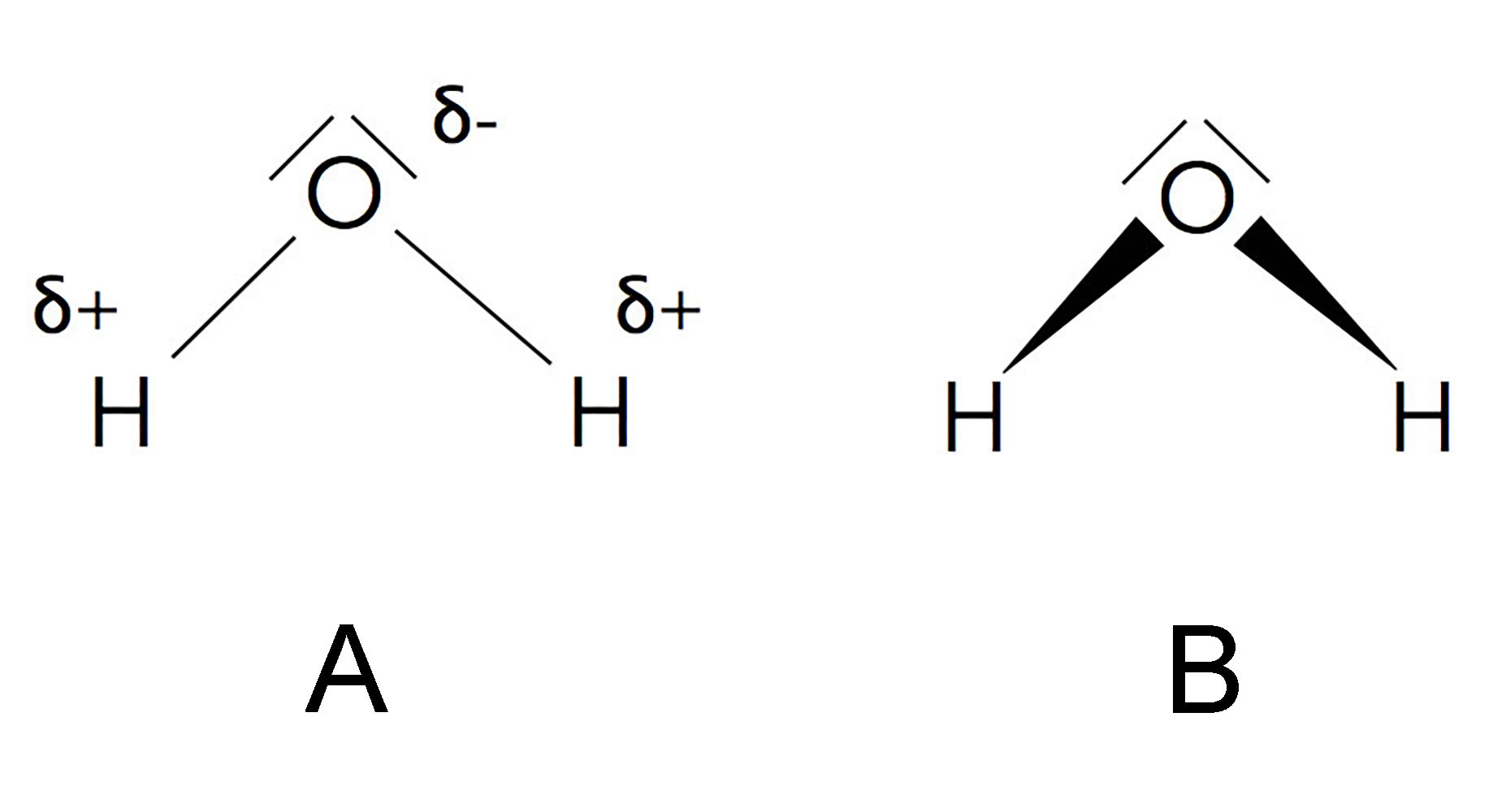
Graphische Darstellung der Polarität der H-O-Bindungen
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
A) Der negative Pol der polaren H-O-Bindung ist mit dem Zeichen δ- gekennzeichnet, der positive Pol mit dem Zeichen δ+. Der griechische Buchstabe δ soll anzeigen, dass es sich nur um eine kleine Teilladung handelt.
Wäre das O-Atom komplett negativ und das H-Atom komplett positiv geladen, hätten wir ja keine kovalente Bindung mehr, sondern eine Ionenbindung. Wasser wäre dann bei Zimmertemperatur keine Flüssigkeit mehr, sondern würde in festen Brocken aus der Dusche rieseln, wie ein Salz.
B) Hier sehen wir eine alternative Darstellung der Polarität. Die H-O-Bindungen werden nicht mehr durch einfache Striche dargestellt, sondern durch Keile. Das dicke Ende eines solchen Keils steht für hohe Elektronendichte, das dünne Ende entsprechend für geringe Elektronendichte.
Dieser Keildarstellung der polaren Bindung kann leicht verwechselt werden mit der räumlichen Darstellung von Molekülen. Würde man die beiden Keile in B) als räumliche Darstellung interpretieren, würde das bedeuten, dass sich das O-Atom weiter vorn befindet und die beiden H-Atome weiter hinten.
Wasser-Moleküle sind Dipole
Die Polarität der O-H-Bindung hat weitreichende Folgen für die Eigenschaften des Wassers und das Verhalten der Wasser-Moleküle. Wasser-Moleküle sind Dipole; so heißen Moleküle mit einem (leicht) positiven und einem (leicht) negativen Ende. Zwei Dipol-Moleküle können sich gegenseitig anziehen:
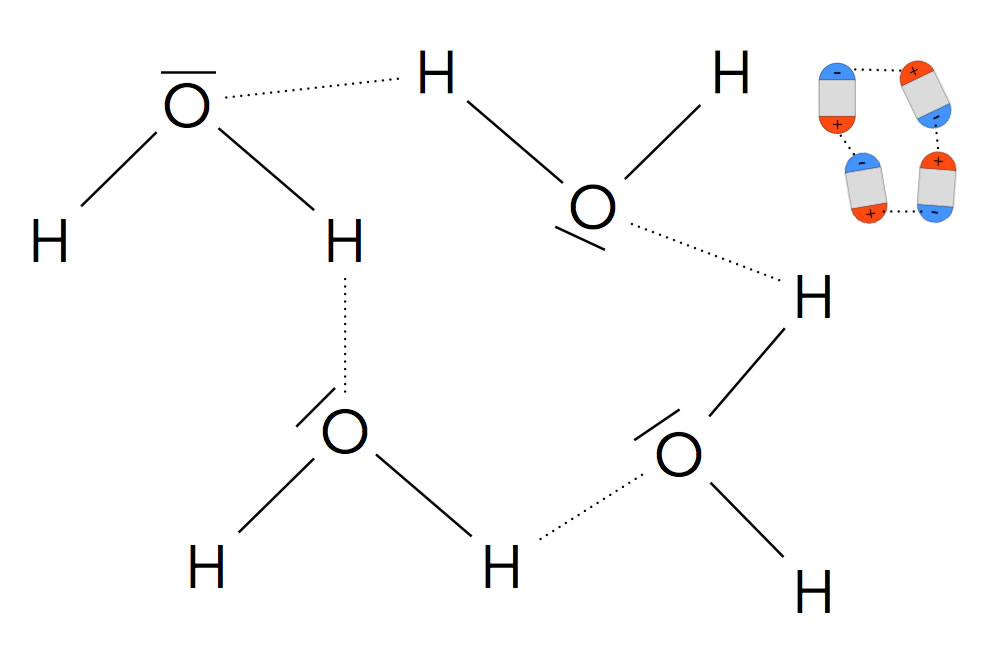
Vier Wasser-Moleküle ziehen sich gegenseitig an
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Das Bild zeigt einen Ausschnitt aus flüssigem Wasser. Dargestellt sind vier Wasser-Moleküle, die sich gegenseitig anziehen. Die leicht negativ geladenen O-Atome der Moleküle ziehen die leicht positiv geladenen H-Atome benachbarter Moleküle elektrostatisch an. Rechts oben sieht man eine vereinfachte Darstellung dieses Phänomens. Die Wasser-Moleküle sind als Dipole mit einem negativen (blau) und einem positiven (rot) Ende dargestellt.
Wasser-Moleküle bilden H-Brücken
Wir wir im vorherigen Abschnitt gesehen haben, sind H2O-Moleküle Dipole, die sich gegenseitig elektrostatisch anziehen können.
Auch H2S-Moleküle (Schwefelwasserstoff) sind Dipole, die sich gegenseitig anziehen. Schwefel steht im Periodensystem unter dem Sauerstoff, Schwefel-Atome sind also schwerer als Sauerstoff-Atome, und daher sollte man meinen, dass die Verbindung H2S eine höhere Dichte und einen höheren Siedepunkt hat als Wasser. Wasser siedet bei 100 ºC, und Schwefelwasserstoff sollte dann vielleicht bei 150 ºC sieden.
Schauen wir doch mal in der Wikipedia nach, ob Schwefelwasserstoff tatsächlich einen solch hohen Siedepunkt hat.
Oh nein! Schwefelwasserstoff hat einen Siedepunkt von -60,2 ºC. Wie kann das denn sein?
Offensichtlich herrschen zwischen H2O-Molekülen viel stärkere Anziehungskräfte als zwischen H2S-Molekülen. Mit den elektrostatischen Dipol-Dipol-Anziehungskräften können wir den viel höheren Siedepunkt des Wassers nicht erklären. Würden zwischen H2O-Molekülen wirklich nur diese Dipol-Dipol-Kräfte herrschen, müsste der Siedepunkt von Wasser noch unter dem von Schwefelwasserstoff liegen, vielleicht bei -100 ºC. Zwischen den Wasser-Molekülen müssen also noch weitere Anziehungskräfte bestehen, die wir bisher noch nicht berücksichtigt haben.
Wasserstoffbrücken-Bindungen
Um den wichtigen Begriff der Wasserstoffbrücken-Bindung (kurz: H-Brücke) zu erklären, schauen wir uns folgendes Bild an:
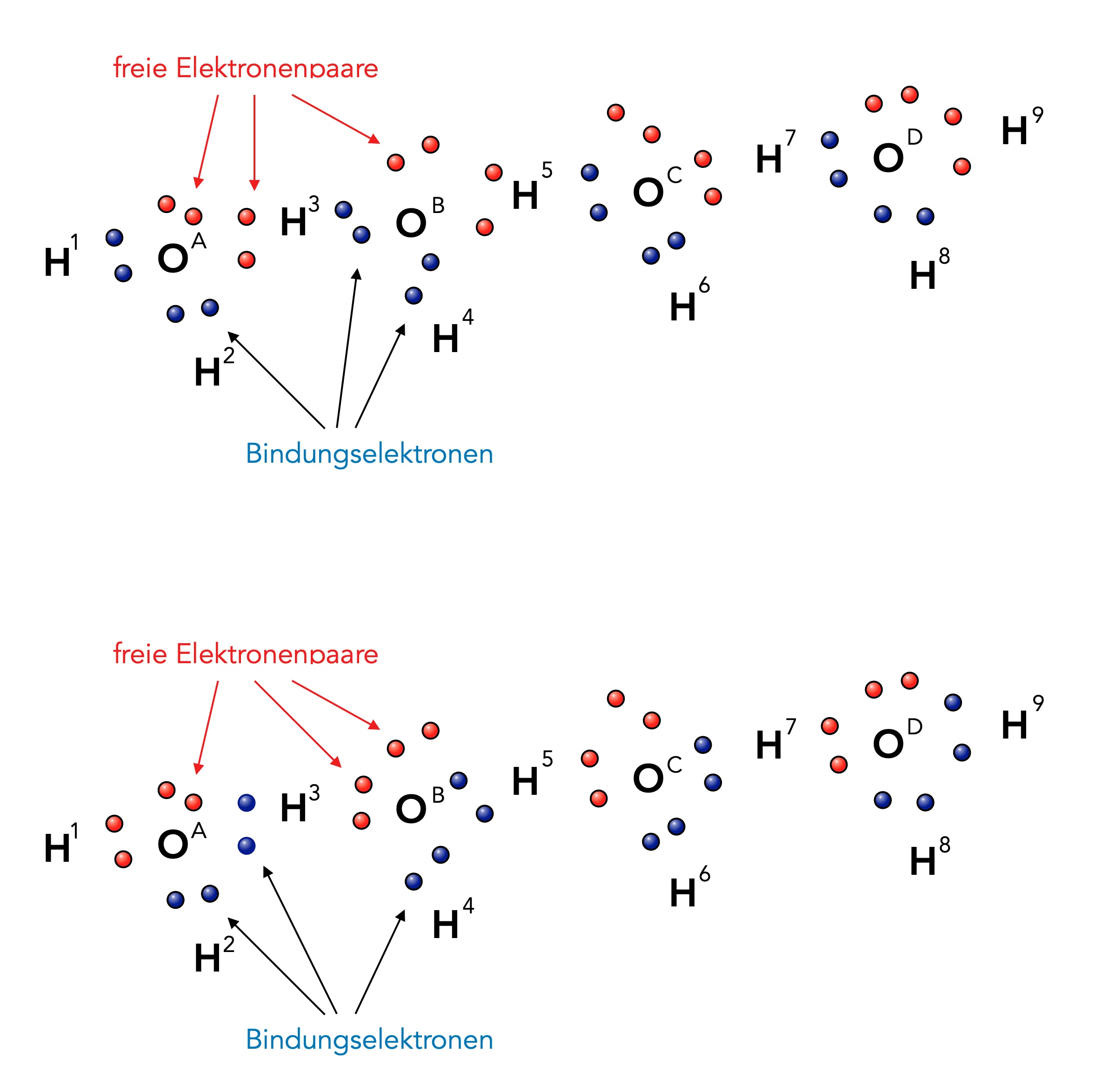
Zwei Wasser-Moleküle sind durch eine Wasserstoffbrücke miteinander verbunden
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Wir sehen hier vier H2O-Moleküle nebeneinander. Die Kugelwolken bzw. Orbitale sind bewusst nicht mit eingezeichnet worden, sondern nur die Bindungselektronen (blau) und die freien Elektronenpaare der O-Atome (rot).
Vergleichen wir nun die obere Reihe mit der unteren Reihe. Die Position der H- und O-Atome hat sich hier um keinen Deut geändert. Aber aus freien Elektronenpaaren sind plötzlich Bindungselektronen geworden, und umgekehrt sind aus Bindungselektronen jetzt freie Elektronenpaare entstanden. Das H-Atom H3 war beispielsweise vorher mit dem O-Atom OB verbunden, im unteren Bild ist H3 aber mit OA verknüpft.
Im Linder, einem sehr guten Biologie-Lehrbuch für die Oberstufe, wird das folgendermaßen erklärt: "Aufgrund der positiven Teilladung können die Wasserstoffatome eines Wassermoleküls mit einem freien Elektronenpaar eines benachbarten Wassermoleküls in Wechselwirkung treten. SO entsteht eine Wasserstoffbrückenbindung" [3]
Für Experten
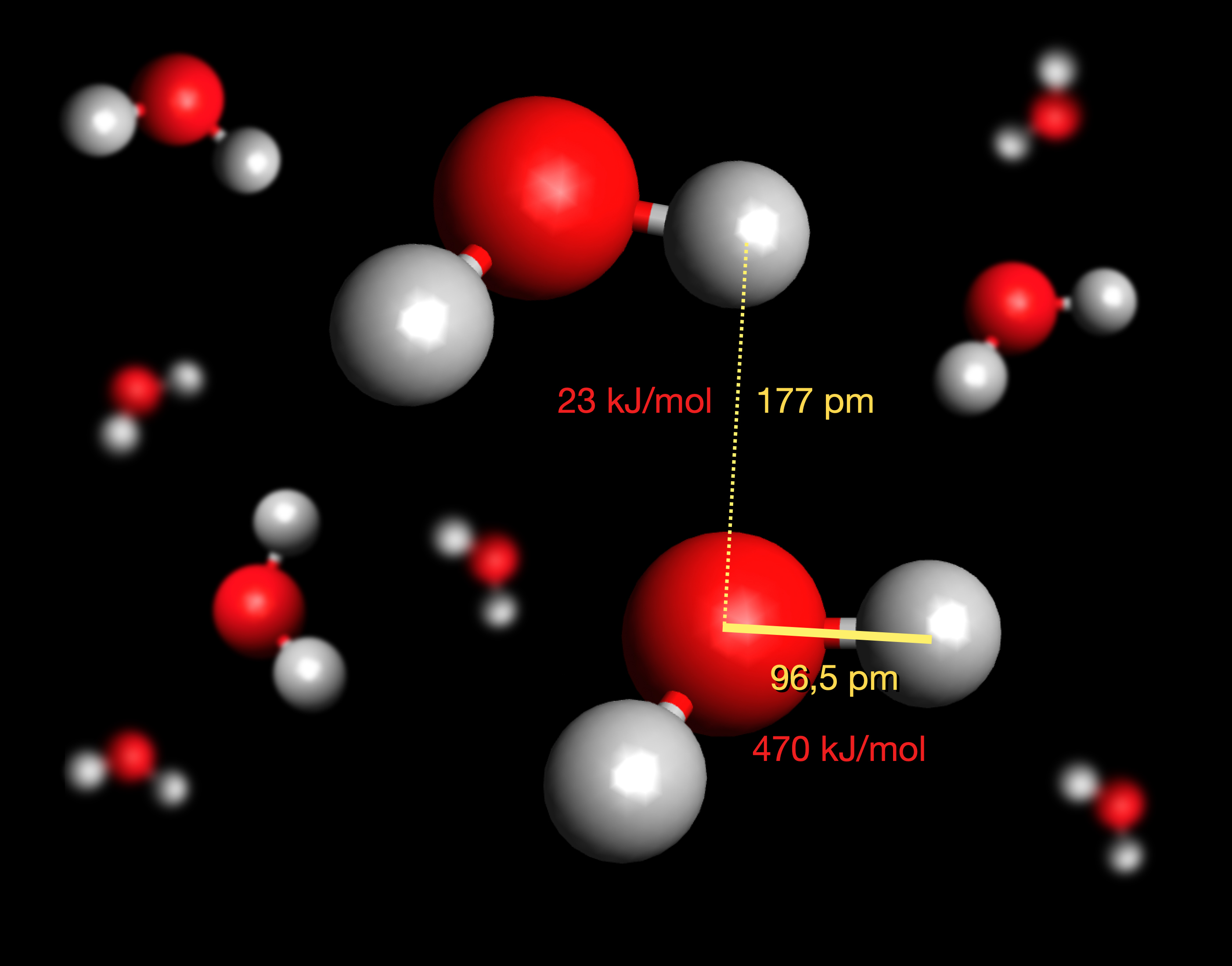
Quantitative Betrachtungen zu H-Brücken
Autor: Ulrich Helmich 02/2024, Lizenz: siehe Seitenende
Eine H-Brücke ist mit 177 pm recht lang im Vergleich zu einer normalen H-O-Bindung mit 96,5 pm [2]. Wenn man dies bedenkt, müsste man jetzt eigentlich die vorherige Abbildung kritisieren, denn dort sind alle H-O-Bindungen, egal ob kovalent oder H-Brücke, gleich lang.
Noch interessanter ist die Energie, die man aufwenden muss, um eine Bindung zu trennen. Für die kovalente H-O-Bindung ist eine Bindungsdissoziationsenergie von 470 kJ/mol notwendig, für eine H-Brücke aber nur 23 kJ/mol [2]. Eine H-Brücke ist also ca. 20 mal schwächer als eine kovalente Bindung. Da der kovalente Anteil an einer H-Brücke aber ca. 10% ausmacht (90% sind elektrostatische Wechselwirkungen) [2], ist eine H-Brücke immer noch wesentlich stärker als eine rein elektrostatische Anziehung, wie wir weiter oben am Beispiel Schwefelwasserstoff gesehen haben.
Im aktuellen Lehninger [2] finden wir auch Angaben zur zeitlichen Dimension von H-Brücken. Die Lebensdauer einer H-Brücke liegt zwischen 1 und 20 Picosekunden. Eine Picosekunde ist der billionste Teil einer Sekunde, also 1 ps = 10-12 s. Sobald sich im Wasser eine H-Brücke auflöst, bildet das H2O-Molekül innerhalb von 0,1 ps eine neue H-Brücke.
Ein H2O-Molekül kann mit maximal vier anderen Wasser-Molekülen solche H-Brücken bilden. In flüssigem Wasser sind die Moleküle allerdings in ständiger Bewegung, so dass ein H2O-Molekül durchschnittlich mit 3,4 anderen H2O-Molekülen über H-Brücken verbunden ist [2].
Weitere Informationen zu diesem Thema finden Sie auf der Seite im Chemie-Lexikon.
Konsequenzen für Lebewesen
Für Lebewesen hat die Polarität des Wasser-Moleküls und seine Fähigkeit, H-Brücken untereinander und mit anderen Verbindungen zu bilden, wichtige Konsequenzen. Dadurch, dass sich Wasser-Moleküle so stark gegenseitig anziehen können, hat Wasser ganz spezielle Eigenschaften. Es hat zum Beispiel eine hohe Oberflächenspannung. Die Wasser-Moleküle bilden ein Netzwerk, das tragende Eigenschaften hat. Obwohl eine aus Metall bestehende Stecknadel eine viel größere Dichte hat als Wasser, schwimmt sie auf der Wasseroberfläche, wenn man sie vorsichtig auf eine ruhige Wasseroberfläche legt. Diese Oberflächenspannung nutzen viele wasserlebende Kleintiere aus, zum Beispiel Wasserläufer, Wasserwanzen etc. Diese Tiere können auf dem Wasser eines Sees oder einer Pfütze laufen, als wäre das nichts Besonderes.
Auf die Bildung von H-Brücken ist auch die sogenannte Dichteanomalie des Wasser zurückzuführen. Normale Stoffe haben im festen Zustand eine höhere Dichte als im flüssigen Zustand. Gibt man beispielsweise ein Stück festes Eisen in eine Eisenschmelze, so sinkt das feste Eisen sofort ein. Nicht so bei Wasser und Eis. Eis schwimmt bekanntlich oben auf dem Wasser, weil es eine geringere Dichte hat als flüssiges Wasser. Das ist für die Fische, Insekten und anderen Tiere gut, die in einem See leben. Im Winter friert der See nämlich von oben nach unten zu. Da flüssiges Wasser eine höhere Dichte hat als Eis, ist unten im See auch im kältesten Winter immer noch flüssiges Wasser anzufinden, in dem die Tiere überwintern können. Vorausgesetzt, der See ist hinreichend tief. In flachen Gewässern kann es durchaus passieren, dass komplett alles zufriert.
Für Experten
Im letzten Expertenkasten hatten wir festgestellt, dass in flüssigem Wasser ein H2O-Molekül durchschnittlich mit 3,4 anderen H2O-Molekülen über H-Brücken verbunden ist. Im Idealfall kann ein H2O-Molekül aber mit vier anderen H2O-Molekülen H-Brücken bilden. Beim festen Wasser, dem Eis, ist das dann auch so. Im Eis ist jedes H2O-Molekül mit vier anderen H2O-Molekülen über H-Brücken verbunden, es bildet sich ein regelmäßiges Kristallgitter aus.
Wie wir ebenfalls im vorherigen Expertenkasten gesehen haben, ist eine H-Brücke zwischen einem H- und einem O-Atom mit 177 pm deutlich länger als eine normale kovalente H-O-Bindung mit nur 96,5 pm. Wenn im Eis mehr H-Brücken gebildet werden als im flüssigen Wasser, dann ist es logisch, dass die Abstände zwischen den H2O-Molekülen im Eis größer sind als im flüssigen Wasser.
Und genau das ist der springende Punkt, wenn es um die Frage geht, wie die Dichteanomalie des Wassers zustande kommt. "Normale" Flüssigkeiten schrumpfen zusammen, wenn es kälter wird, weil die Abstände zwischen den Molekülen kleiner werden. Beim Wasser dagegen nehmen die Abstände zwischen den Molekülen zu, wenn es gefriert, da sich zusätzliche H-Brücken ausbilden. Daher hat Eis eine geringere Dichte als flüssiges Wasser und schwimmt auf der Wasseroberfläche.
Wenn Eis schmilzt, werden einige der H-Brücken wieder aufgelöst, und die Wasser-Moleküle rücken näher zusammen, die Dichte des Wasser nimmt zu, bis zu einer Temperatur von 4 ºC. Wenn es noch wärmer wird, bewegen sich die Wasser-Moleküle stärker und die Abstände werden wieder größer, die Dichte des Wassers nimmt also wieder ab. Bei 4ºC hat das Wasser also sein Dichtemaximum erreicht.
Quellen:
- "So viel Wasser gibt es auf der Erde" auf www.quarks.de
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Linder Biologie, Braunschweig 2019.
Seitenanfang -
Weiter mit Wasser als Lösemittel...