Mit dem Gorter-Grendel-Versuch von 1925 wurde nachgewiesen, dass die Membran von roten Blutkörperchen aus zwei Lipidschichten besteht, das entsprechende Membranmodell, das von Gorter und Grendel aufgestellt wurde, heißt daher auch Lipid-Doppelschicht-Modell. Auf dieser Seite wollen wir uns kurz die Membranmodelle anschauen, die nach Gorter und Grendel entwickelt worden sind. Einzelheiten zu den Membranmodellen finden Sie dann auf den Vertiefungsseiten, die hier verlinkt sind.
Das Sandwich-Modell 1935
Danielli und Davson schlugen 1935 ein Sandwich-Modell vor.
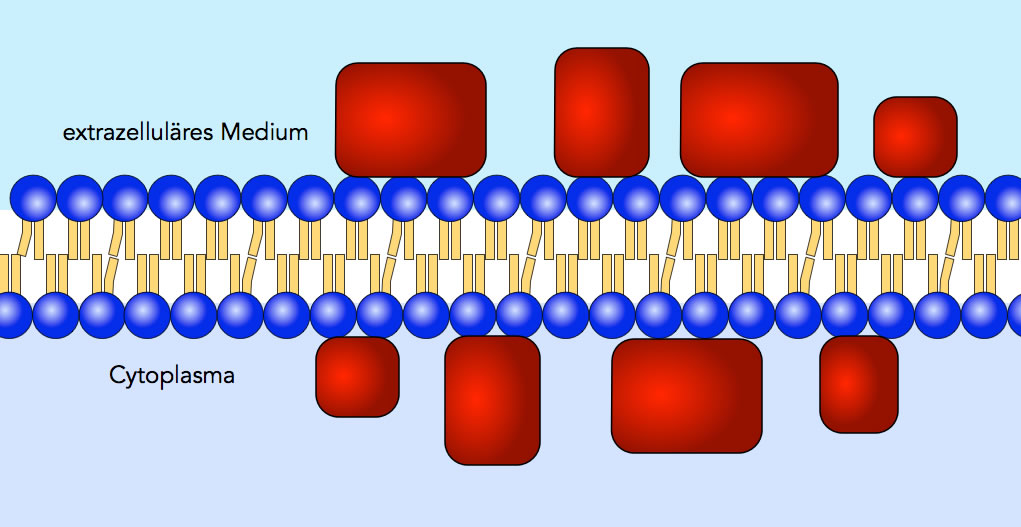
Das Sandwich-Modell nach Danielli und Davson
Autor: Ulrich Helmich, Lizenz: Public domain
Danach besteht eine Membran aus einer Lipid-Doppelschicht, wie sie schon von Gorter und Grendel vorgeschlagen wurde. Aber auf der Außenseite und auf der Innenseite dieser Lipid-Doppelschicht sind Proteine aufgelagert.
Auf dieser Seite finden Sie weitere Einzelheiten zur Entwicklung des Membranmodells von Davson und Danielli.
Die Einheitsmembran 1957
Kurze Zeit nach den Entdeckungen und Modellvorstellungen von Davson und Danielli (Sandwich-Modell) wurde das Elektronenmikroskop entwickelt. Als man zum ersten Mal Zellen mit diesem neuen Gerät untersuchte, sahen die Membran so aus wie im nächsten Bild:
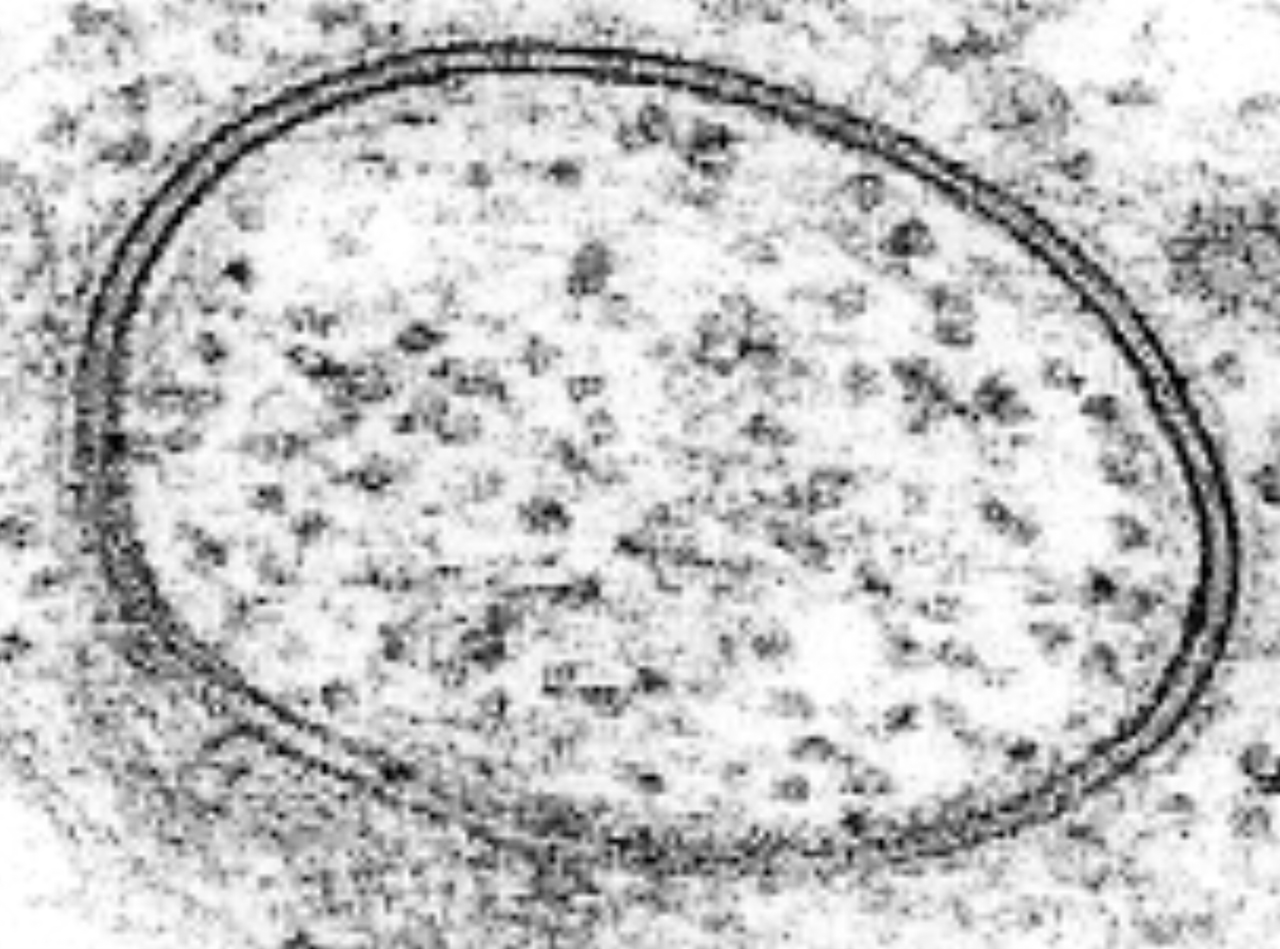
EM-Bild eines Lipid-Vesikels
Autor: Sandraamurray, Lizenz: Public Domain.
Man sah einen dunklen, für Elektronen wenig durchlässigen Strang auf der Außenseite der Membran, einen etwas elektronendurchlässigeren hellerer Strang in der Mitte, und einen zweiten dunklen Strang auf der Zellinnenseite der Membran. Man wusste aus anderen Untersuchungen bereits, dass Proteine die Elektronen stark absorbieren, während Lipide die meisten Elektronen durchlassen. Diese Beobachtungen bestätigten damit das Sandwich-Modell.
J. David Robertson schlug dann 1957 das Modell der Einheitsmembran (engl.: unit membrane) vor [7]. Er machte sehr viele Aufnahmen mit dem Elektronenmikroskop und stellte fest, dass alle Membranen der Zelle einen ähnlichen Aufbau hatten und auf den ersten Blick wie Eisenbahnschienen von oben aussahen.
Das Benson-Green-Modell 1966
Nach der Entwicklung des Elektronenmikroskops wurden neue Techniken entwickelt, um die Bestandteile von Zellmembranen sichtbar zu machen. Eine dieser Techniken ist die Gefrierbruchtechnik. Die Probe mit den Zellen wird tiefgefroren und dann mit einem sehr scharfen "Messer" aufgeschnitten bzw. aufgebrochen. Mit einigem Glück werden dabei auch Lipid-Doppelschichten auseinander gerissen, so dass man im Elektronenmikroskop quasi auf die Fettsäure-Reste einer Einzelschicht blicken kann. Nach dem Modell der Einheitsmembran hätte man auf diesen EM-Aufnahmen nur die Fettsäuren sehen dürfen. Man sah aber jede Menge Proteine zwischen den Fettsäuren. Die Schlussfolgerung war dann, dass es Proteine gibt, die die Membran zumindest zur Hälfte, wenn nicht sogar ganz durchdringen. Solche Proteine wurden dann als integrale Proteine bzw. Transmembranproteine bezeichnet.
Die beiden Forscher Benson und Green beschäftigten sich in den 60er Jahren vor allem mit den Membranen der Chloroplasten (Benson) und Mitochondrien (Green). Auf den Gefrierbruchtechnik-Aufnahmen sah man sehr viele Proteine, viel mehr Proteine, als die Einheitsmembran von Robertson dies vorsah und vor allem Proteine, die die Membran komplett durchdrangen.
Die Zellmembran (und andere Membranen) besteht zu ca. 80% aus Lipiden und zu 20% aus Proteinen. Bei den inneren Mitochondrien- und Chloroplastenmembranen ist es fast umgekehrt: 20 bis 25% Lipide, 75 bis 80% Proteine. Hier sieht es also auf den ersten Blick so aus, als ob nicht die Lipid-Doppelschicht die "Basis" für die Membran darstellt, sondern die Proteine.
Daher schlugen Benson und Green ein neues Membranmodell vor. Danach sollte nicht eine Lipid-Doppelschicht die "Basis" der Membran sein, sondern eine Reihe von Proteinen - keine Doppelschicht, sondern eine einzige Lage von Proteinen. In den hydrophoben Bereichen zwischen den Proteinen sollten dann die Lipide mit ihren Fettsäureresten verankert sein, während die hydrophilen Köpfe der Lipide aus der Proteinschicht herausragen sollten.
Kurze Zeit später wurden jedoch die Arbeiten von Frye und Edidin sowie von Singer und Nicolson veröffentlicht, die dieses völlig andere Membranmodell dann "außer Betrieb" setzten.
Das Flüssig-Mosaik-Modell 1972
1972 entwickelten Singer und Nicolson das Flüssig-Mosaik-Modell, nach dem die Lipid-Doppelschicht eine zweidimensionale Flüssigkeit bildet, in der die Proteine frei beweglich in zwei Dimensionen schwimmen.
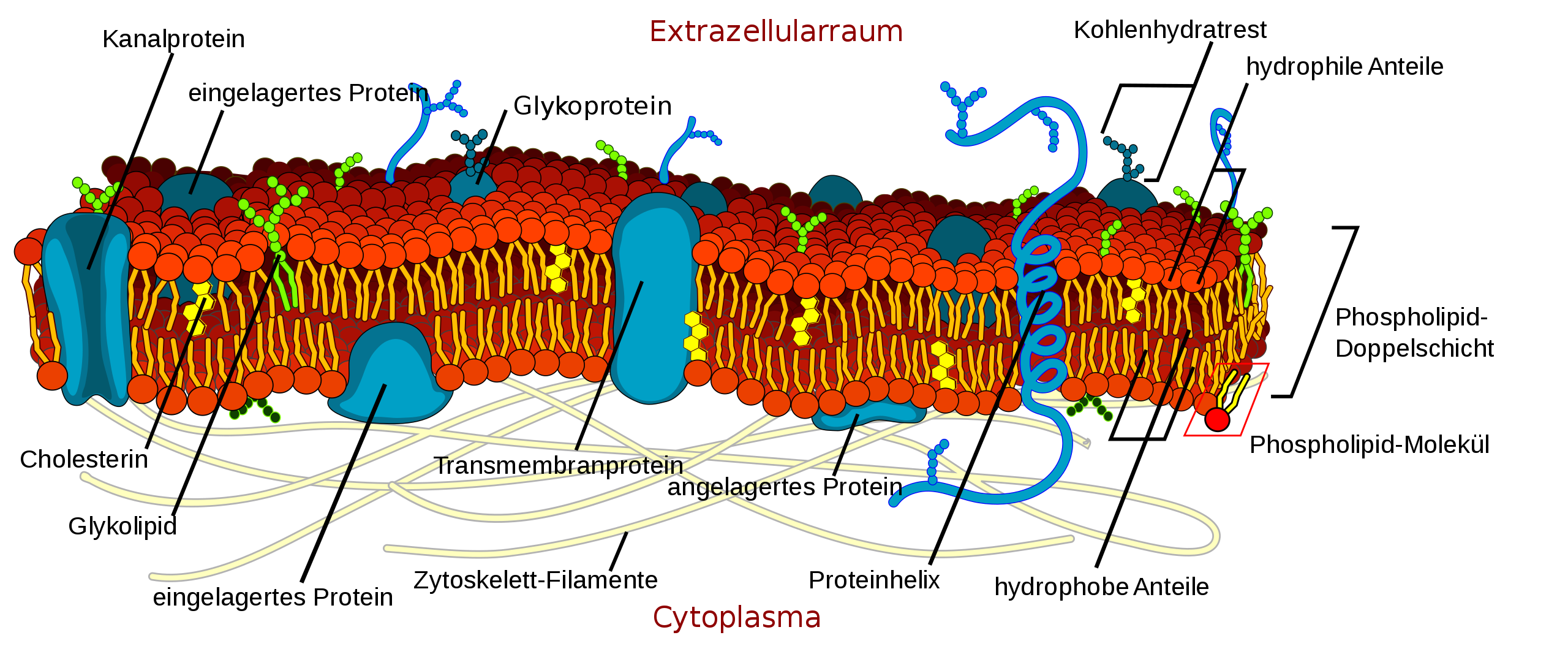
Das Flüssig-Mosaik-Modell
Quelle: Wikipedia, Artikel "Biomembran", Autor: LadyofHats, Lizenz: public domain.
Vielen Dank an die Autorin Mariana Ruiz Villarreal oder "LadyofHats", die dieses tolle Bild gezeichnet und als public domain der Allgemeinheit zur Verfügung gestellt haben.
Ein wichtiger Versuch auf dem Weg zu diesem Flüssig-Mosaik-Modell (fluid-mosaic-model) waren die Versuche, die Frye und Edidin 1970 durchgeführt hatten. Diese Versuche wurden mit Zellen der Maus und des Menschen durchgeführt [1].
Auf dieser Seite finden Sie weitere Einzelheiten zur Entwicklung des Membranmodells von Singer und Nicolson sowie zum berühmten Versuch von Frye und Edidin.
Das Lipid-Floß-Modell 1997
Das Fluid-mosaic-model hatte ca. 20 Jahre Bestand und wurde in allen Schulbüchern der Oberstufe präsentiert. Ende der 80er, Anfang der 90er Jahre wurde jedoch entdeckt, dass nicht alle Proteine der Zellmembran so frei beweglich sind, wie Singer und Nicolson das postuliert hatten.
Versuche von Henis et al.
Henis et al. arbeiteten 1990 mit einer Methode, die als "Fluorescence recovery after photobleaching", auf Deutsch in etwa "Fluoreszenz-Erholung nach Lichtbleiche" bezeichnet und meistens einfach mit "FRAP" abgekürzt wird [6].
Lipide oder Proteine in der Membran von Tierzellen werden mit Fluoreszenz-Farbstoffen markiert, die im UV-Licht unter dem Lichtmikroskop grün aufleuchten. Mit einem Laserstrahl werden in einem eng begrenzten Bereich der Zelle die Farbstoffe ausgebleicht, sie produzieren dann bei UV-Bestrahlung kein grünes Licht mehr. Im Lichtmikroskop ist dann quasi ein "Loch" in dem grün leuchtenden Umfeld zu sehen. Nach einiger Zeit jedoch verschwindet dieses Loch wieder, weil nicht gebleichte Lipide oder Proteine in diesen Bereich hineinwandern - ganz wie das Fluid-mosaic-model ja auch vorhersagt.
Allerdings stieg die Fluoreszenz bei diesen Versuch nicht wieder auf den ursprünglichen Wert an. Die Erklärung hierfür: Nicht alle Proteine sind in der Membran frei beweglich und können lateral diffundieren; einige Proteine scheinen offensichtlich fixiert zu sein, können also nicht diffundieren [3]. Je nach Zelltyp liegt der Anteil der frei beweglichen Proteine zwischen 30 und 90% [5]. 10 bis 70% der Proteine sind also irgendwie in der Beweglichkeit eingeschränkt.
Das Lipid-Floß-Modell
Das heißt jetzt nicht, dass diese Proteine völlig unbeweglich in der Zellmembran fixiert sind. Aber sie bewegen sich sehr viel langsamer als die frei beweglichen Proteine. Ihre Diffusionsrate ist deutlich kleiner als die Diffusionsrate frei beweglicher Proteine.
Man hat den Diffusionskoeffizienten von Lipid-Molekülen in reinen (künstlichen) Lipid-Doppelschichten bestimmt, der Wert liegt bei ca. mit 10-7 cm2/s. Macht man die gleiche Untersuchung bei echten Biomembranen, sinkt der Diffusionskoeffizient um das Zehnfache, er liegt nur noch bei 10-8 cm2/s. Man vermutet, dass die Lipide in der echten Membran durch bestimmte unbewegliche Proteine an der freien Bewegung gehindert werden [5].
Manche Proteine hängen eng zusammen und bilden lokale Ordnungsstrukturen, auch als Mikrodomänen bezeichnet, wie zum Beispiel Proteinkomplexe, die zudem mit dem Zellskelett verbunden sind und daher an bestimmte Positionen der Zellmembran fixiert sind. Diese Entdeckungen finden sich in dem Konzept der lipid rafts wieder, das sind spezielle Bereiche der Zellmembran, die wie Flöße (rafts) auf der zweidimensionalen Lipid-Doppelschicht schwimmen [4]. Im Deutschen wird dieses moderne Membranmodell als Lipid-Floß-Modell bezeichnet (Lipid-raft-model von Simons et.al, 1997).
Quellen:
- Urry, Cain, Wassermann, Minorsky, Reece, Campbell Biologie, Hallbergmoos 2019, 11.Auflage
- The rapid intermixing of cell surface antigens after formation of mouse-human heterokaryons. L. D. Frye and M. Edidin. J. Cell Sci 7, 319-335 (1970).
- Harvey Lodish et al. Molecular Cell Biology, New York 2004
- Lipid Raft (Wikipedia)
- Darnell, Lodish, Baltimore, Molekulare Zellbiologie, Berlin 1994.
- Fluorescence recovery after photobleaching, engl. Wikipedia, abgerufen am 4. Juli 2021.
- Luckey, Mary. Membrane Structural Biology. Cambridge University Press 2014.
Seitenanfang -
Weiter mit der Fluidität von Membranen...