Das Protein Actin
Actin ist ein wichtiger Bestandteil des Cytoskeletts eukaryotischer Zellen und bildet die Actin-Filamente.
Das Cytoskelett wird auf dieser Lexikonseite ausführlich beschrieben.
Primärstruktur
Die Primärstruktur von Actin wurde 1973 von Elzinga et al. aufgeklärt. Das Actin-Molekül besteht aus 374 Aminosäuren und hat eine molare Masse von ca. 42 kD. Der N-Terminus enthält vorwiegend saure Aminosäuren, der C-Terminus hauptsächlich basische.
Actin ist evolutionsbiologisch gesehen hochkonservativ, das heißt, es hat sich im Laufe der Evolution so gut wie nicht in seiner Aminosäure-Sequenz verändert. Die Actin-Gene von Algen und Menschen stimmen beispielsweise zu 85% in ihrer Basensequenz überein [5].
Tertiärstruktur
Actin-Monomere (auch als G-Actin bezeichnet, wegen der globulären Struktur) bestehen aus zwei Domänen mit je zwei Unterdomänen [5]:
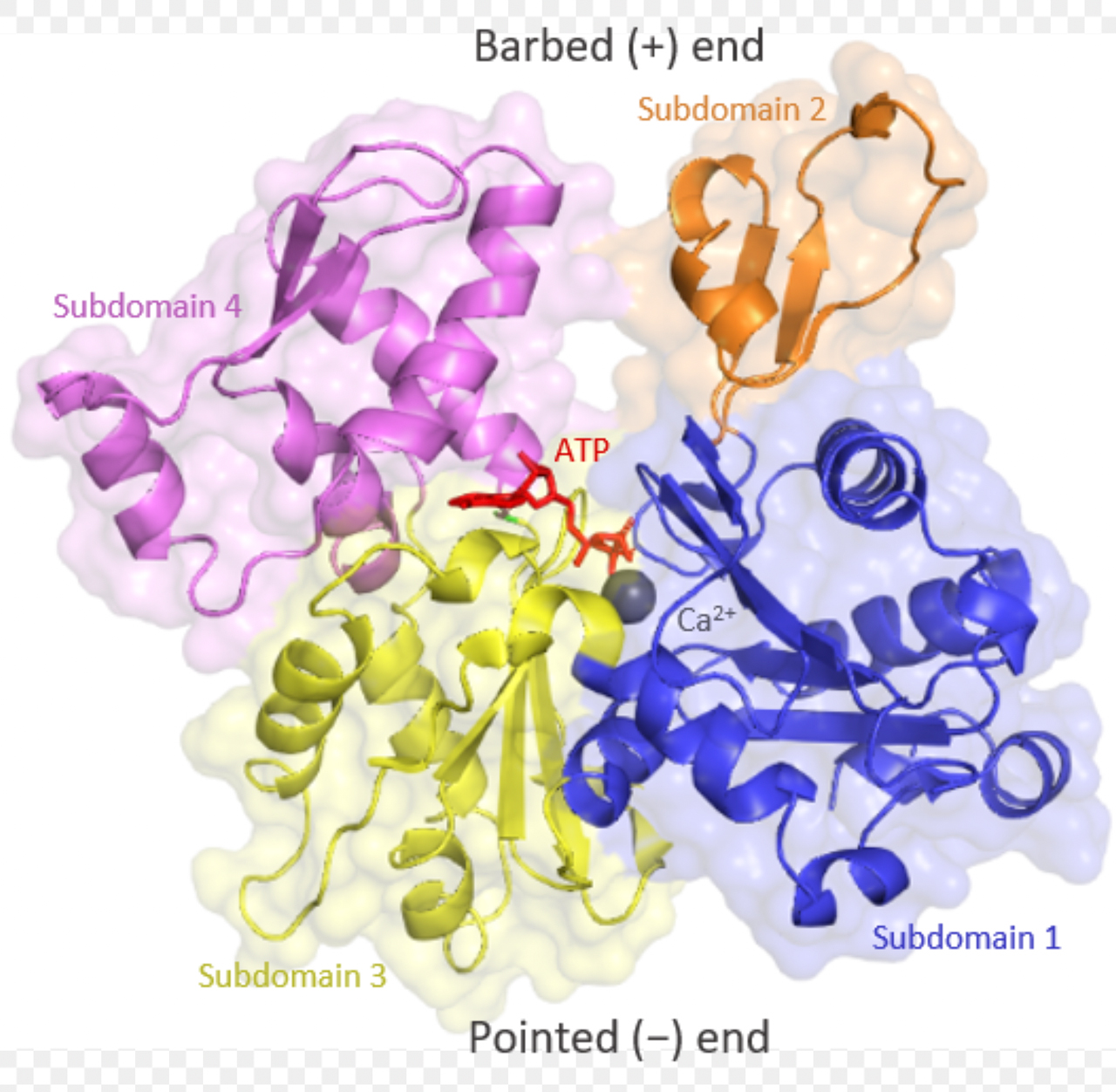
Actin besteht aus zwei Domänen mit je zwei Unterdomänen
Ajpolino, CC BY-SA 4.0, via Wikimedia Commons
Zwischen diesen beiden Domänen befindet sich ein Spalt, in den sich ATP- und ADP-Moleküle sowie Ca2+-Ionen setzen können. Das gebundene ATP bzw. ADP stabilisiert die Tertiärstruktur des G-Actins, ohne gebundenes ATP oder ADP denaturiert das Protein sehr schnell.
Die exponierten Bereiche der Unterdomänen 2 und 4 bilden das Plus-Ende des G-Actins, die exponierten Bereiche der Unterdomänen 1 und 3 das Minus-Ende. Das Plus-Ende wird im Englischen oft als "Barbed end" bezeichnet, das heißt so viel wie "mit Widerhaken versehen". Mit diesen "Widerhaken" kann sich ein G-Actin-Monomer in das Minus-Ende eines anderen Monomers einhaken [5].
Filamentbildung
Die Bildung von Actin-Filamenten ist auf dieser Lexikon-Seite ausführlich beschrieben, auch die Rolle von ATP und ADP bei der Filament-Bildung wird erläutert. Wer all diese Detail-Informationen nicht benötigt, liest einfach auf dieser Seite den folgenden Abschnitt.
Jedes Actin-Molekül hat zwei Enden, die als Plus- und Minus-Ende bezeichnet werden. Mit Hilfe dieser beiden Enden kann sich ein Actin-Molekül an ein anderes heften und so lange Fäden bilden, die sogenannten Actin-Filamente. Das folgende Bild zeigt die Bildung eines solchen Actin-Filaments in drei Schritten:
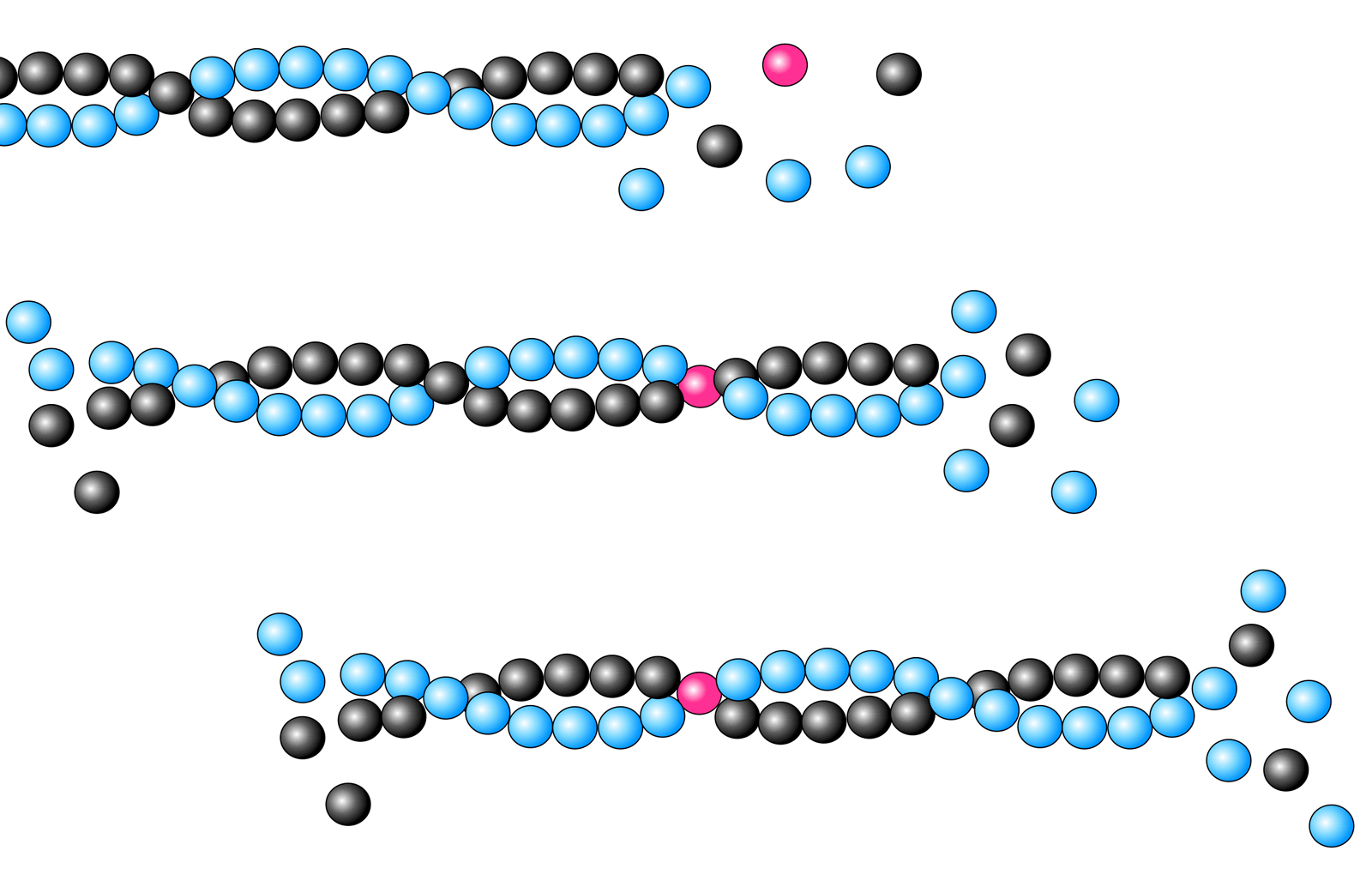
"Wanderung" eines Actin-Moleküls durch das Actin-Filament
Autor: Ulrich Helmich 2023, Lizenz: CC BY-NC-SA 4.0
Das rot markierte G-Actin-Molekül setzt sich zunächst an das sogenannte Plus-Ende des Actin-Filaments (im Bild rechts). Im Laufe der nächsten Millisekunden lagern sich weitere G-Actin-Monomere an das Filament an, das markierte G-Actin-Molekül "wandert" dadurch in Richtung Minus-Ende. Auf dem dritten Bild ist es schon ziemlich weit in die Nähe des Minus-Endes gekommen. Einige Millisekunden später befindet sich das markierte Monomer am Minus-Ende des Filaments und löst sich dann wieder von diesem. Es kann dann in ein neues Actin-Filament eingebaut werden.
In der Abbildung sind die drei Stadien räumlich versetzt eingezeichnet worden. Das hat den ganz einfachen Grund, weil sich das Actin-Filament tatsächlich auf diese Weise fortbewegt, es wandert durch ständiges Wachstum am Plus-Ende und gleichzeitiges Auflösen am Minus-Ende von links nach rechts.
Quellen:
- Plattner, Hentschel. Zellbiologie, 5. Auflage. Stuttgart 2017.
- Savada, Hillis, Heller, Hacker: Purves Biologie, Springer Verlag Deutschland 2019, 10. Auflage. Herausgegeben von Jürgen Markl.
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Urry, Cain, Wassermann, Minorsky, Reece. Campbell Biologie, Hallbergmoos 2019, 11.Auflage.
- engl. Wikipedia, Artikel "Actin".
- Alberts, Bruce et al. Lehrbuch der Molekularen Zellbiologie, 5. Auflage, Weinheim 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Kadereit , Körner, Nick, Sonnewald: Strasburger - Lehrbuch der Pflanzenwissenschaften, 38. Auflage, Springer Berlin Heidelberg 2021.