Calcium-Kanäle sind integrale Membranproteine, die in der Lage sind, zweiwertig positive Calcium-Ionen mit dem Konzentrationsgefälle, also passiv, zu transportieren. Man unterscheidet grundsätzlich zwei Typen von Calcium-Kanälen, nämlich spannungsabhängige und ligandenabhängige Calcium-Kanäle.
Spannungsabhängige Calcium-Kanäle
Die für den Biologie-Unterricht wichtigsten Calcium-Kanäle sind die spannungsabhängigen Calcium-Kanäle in dem synaptischen Endknöpfchen. Durch ein Aktionspotenzial aktiviert, öffnen sich diese Calcium-Kanäle, und Calcium-Ionen strömen mit dem Konzentrationsgradienten passiv in das Endknöpfchen ein, wo sie dann dafür sorgen, dass die synaptischen Vesikel mit der präsynaptischen Membran verschmelzen, so dass die Neurotransmitter in den synaptischen Spalt gelangen.
Spannungsgesteuerte Calcium-Kanäle sind nicht nur für Ca2+-Ionen durchlässig, sondern auch für Ba2+-, Sr2+- und Mg2+-Ionen. Die Schwermetall-Ionen Ni2++, Co2+ und Cd2+ blockieren dagegen die spannungsabhängigen Calcium-Kanäle und verhindern so die synaptische Übertragung [2]. Dies ist eine mögliche Erklärung für die toxische Wirkung dieser Schwermetalle.
Die meisten Leute machen sich überhaupt keine Vorstellung, wie stark die Leitfähigkeit eines Calcium-Kanals ist. Es werden sage und schreibe 10 Millionen Ca2+-Ionen pro Sekunde transportiert![5]
Einteilung
Funktionell lassen sich die spannungsabhängigen Ca2+-Kanäle (VGCCs, voltage-gated calcium channels) in zwei Gruppen einteilen, nämlich die hochspannungsregulierten und die niedrigspannungsregulierten Calcium-Kanäle. Diese Unterscheidung trifft man seit 1975. Die niedrigspannungsregulierten Calcium-Kanäle öffnen sich bereits bei sehr leichten Depolarisierungen der Zellmembran, während die hochspannungsregulierten Kanäle recht große Depolarisierungen benötigen, wie sie zum Beispiel während eines Aktionspotenzials herrschen. Für den Biologie-Unterricht in der gymnasialen Oberstufe sind also nur die hochspannungsregulierten Calcium-Kanäle von Bedeutung.
Hochspannungsregulierte Calcium-Kanäle
Diese Ca2+-Kanäle, die sich erst bei Depolarisierungen von -10 mV oder mehr öffnen, werden nochmals in zwei Gruppen eingeteilt, nämlich die L-Typ-Calcium-Kanäle und die non-L-Typ-Calcium-Kanäle.
L-Typ-Kanäle
Die L-Typ-Kanäle werden durch klassische Calcium-Kanal-Blocker gehemmt, zum Beispiel Dihydropyridine, Phenylalkylamine oder Benzothiazepine[1]. L-Typ-Kanäle spielen in der Skelettmuskulatur und bei Herzmuskelzellen eine wichtige Rolle.
non-L-Typ-Kanäle (N-Typ-Kanäle)
Diese Calcium-Kanäle werden durch die "klassischen" Blocker nicht gehemmt, wohl aber durch bestimmte Spinnen- oder Meeresschnecken-Gifte, meistens kurze Peptide. Das Schneckengift Conotoxin beispielsweise blockiert den Calcium-Kanal, indem es sich in die Pore setzt und diese verschließt. Die non-L-Typ-Calcium-Kanäle sind übrigens die Calcium-Kanäle, die in der motorischen Endplatte (der "Schulbuch-Synapse") eine große Rolle spielen. Sie öffnen sich, wenn ein Aktionspotenzial am Endknöpfchen ankommt. Die einströmenden Calcium-Ionen sorgen dann für die Neurotransmitter-Freisetzung.
Niedrigspannungsregulierte Calcium-Kanäle
Diese Ca2+-Kanäle, oft auch als T-Typ-Calcium-Kanäle bezeichnet, öffnen sich bereits bei -70 mV und schließen sich wieder, wenn das Membranpotenzial Werte von -40 mV oder "höher" erreicht (also zum Beispiel -30 mV). Diese Art von Calcium-Kanälen findet man im ZNS, im Herz und in der Niere, in der Muskulatur und in vielen anderen Geweben. Man fragt sich jetzt zu Recht, welche Bedeutung solche niedrigschwelligen Ionenkanäle haben. Im Herzmuskelgewebe spielen diese Calcium-Kanäle die Rolle von Schrittmachern. Sie sorgen letzten Endes dafür, dass das Herz regelmäßig schlägt.
1989 wurde ein zweiter Typ der niedrigspannungsregulierten Calcium-Kanäle entdeckt, der dann als P-Typ bezeichnet wurde [2]. Allerdings beträgt das Schwellenpotenzial hier nicht -70 mV wie bei den T-Typ-Kanälen, sondern -50 mV. Die P-Typ-Kanäle kommen auch nur in den sogenannten Purkinje-Zellen des Kleinhirns vor. Ihre Funktion ist noch unbekannt.
Aufbau
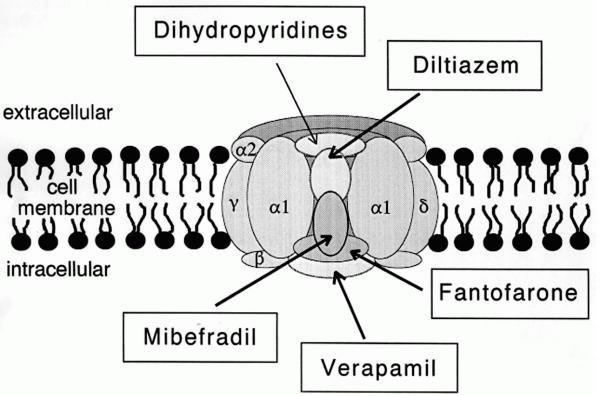
Aufbau eines L-Typ-Calcium-Kanals.
Quelle: Wikipedia, Autor: Vet vijayraj, Lizenz: public domain
Wie man auf dieser Abbildung gut sehen kann, besteht ein Calcium-Kanal aus mehreren Untereinheiten, von denen die alpha-Untereinheit wohl die wichtigste ist, weil sie die eigentliche Pore bildet, durch die die Calcium-Ionen in die Zelle eintreten können. Der Autor des public-domain-Bildes hat die Zeichnung noch um verschiedene Drogen/Gifte ergänzt, die auf die Untereinheiten einwirken können.
Alpha1-Untereinheit
Die alpha1-Untereinheit ist die Pore für die Calcium-Ionen und enthält auch den Spannungsfühler, mit dem der Calciumkanal auf die Veränderung des Membranpotenzials reagieren kann [2].
Die alpha1-Untereinheit ist ein großes Protein mit insgesamt 4 x 6 alpha-Helices, die sich durch die Membran winden. Im Grunde ist die alpha1-Untereinheit eines Calcium-Kanals ähnlich aufgebaut wie die entsprechende Untereinheit eines Natrium-Kanals, daher übernehme ich einfach mal das Bild für den Natrium-Kanal:
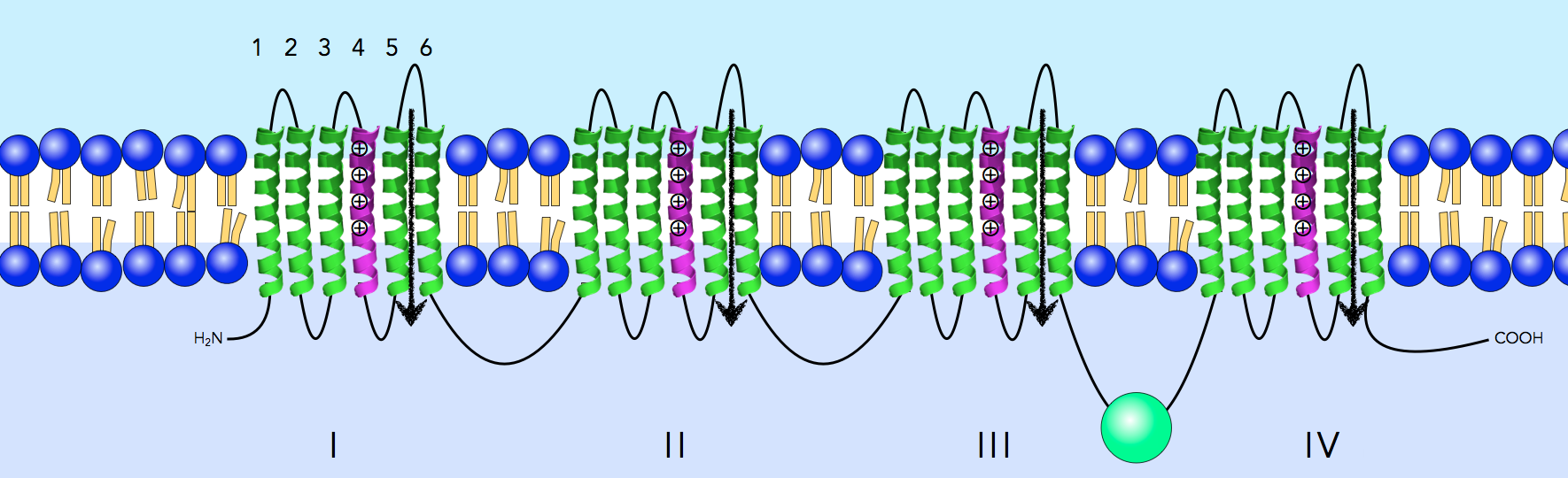
Schema der Alpha1-Untereinheit. Zellinneres blau gekennzeichnet (unten). N-Terminus des Proteins links, C-Terminus rechts.
Autor: Ulrich Helmich, Lizenz: Public domain
Das Protein besteht aus vier Domänen, und jede Domäne wiederum setzt sich aus sechs alpha-Helices zusammen, die quer durch die Membran gehen. Die grünblau gezeichneten alpha-Helices sind elektrisch weitgehend neutral nach außen, während die braun gezeichneten Helices positiv geladene Arginin- und Lysin-Seitenketten enthalten und daher insgesamt positiv geladen sind[3]. Diese positiv geladenen Helices sind die Spannungssensoren des Kanals, sie verändern ihre Lage innerhalb des Proteins, wenn die Membranspannung einen bestimmten Schwellenwert erreicht und führen dann zu einer Öffnung des Kanals.
Quellen:
- Dissertation von Kerstin Behnke, Köln 2007.
- Spektrum-Lexikon der Biologie, Artikel "Calciumkanäle"
- Dissertation von Monika Schwarz, München 2007.
- Dissertation von Rolf Vajna, Köln 2001
- Nayler, Amlodipin, Berlin 1993.