Als Gerüstproteine bezeichnet man Proteine mit vielen ungeordneten Bereichen, die mehrere Bindungsstellen für andere Proteine, RNA-Moleküle oder sonstige Moleküle zur Verfügung stellen.
Ein bekanntes Beispiel für ein Gerüstprotein ist das Disc-large-Protein (Dlg). Dieses aus ca. 900 Aminosäuren bestehende Protein bietet Bindungsstellen für sieben (oder mehr) andere Proteine.
DLG1
Der folgende Text stammt aus der engl. Wikipedia und wurde am 31.05.25 von ChatGPT auf Deutsch zusammengefasst, unter besonderer Berücksichtigung der Rolle als Gerüstprotein. Die Zusammenfassung wurde dann von mir bearbeitet.
Als Gerüstprotein spielt Dlg1 eine zentrale Rolle bei der Organisation und Stabilisierung von Proteinkomplexen in Zellen, insbesondere in Epithelzellen und im Gehirn. Es bindet verschiedene andere Proteine über spezielle Strukturdomänen. Dadurch vernetzt Dlg1 transmembrane Rezeptoren, Adapterproteine und Zytoskelettbestandteile miteinander und fördert so die Bildung stabiler Protein-Netzwerke.
Im Gehirn unterstützt Dlg1 den Transport von ionotropen Rezeptoren (z.B. AMPA-Rezeptoren) vom endoplasmatischen Retikulum zur Zellmembran. Diese Funktion ist besonders bei der synaptischen Plastizität wichtig – also der Fähigkeit von Synapsen, sich in ihrer Stärke zu verändern, was eine Grundlage für Lernen und Gedächtnis ist.
Die Struktur von Dlg1 ermöglicht diese Gerüstfunktion durch verschiedene Domänen, die spezifisch andere Proteine wie Rezeptoren oder Zelladhäsionsmoleküle binden oder die mit weiteren Gerüst- oder Signalproteinen interagieren oder die die Oligomerisierung mit anderen Gerüstproteinen erlaubt.
Durch diese vielseitigen Interaktionen sorgt Dlg1 als molekulares Gerüst für die strukturelle und funktionelle Integration zahlreicher Proteine an spezifischen Stellen der Zelle – etwa an Zell-Zell-Kontakten oder in Synapsen.
Klinische Relevanz: Mutationen im DLG1-Gen werden mit Morbus Crohn in Verbindung gebracht. Ein vollständiger Verlust von Dlg1 bei Mäusen führt zu schweren Entwicklungsstörungen, etwa Gaumenspalten und Nierenproblemen, was auf seine zentrale Rolle in der Zellorganisation hinweist.
In [1] findet man ein schönes Beispiel für die Wirkungsweise eines kleineren Gerüstproteins. Schauen wir uns dazu die folgende Zeichnung an, die von der Abb. 3.76 aus [1] inspiriert wurde:
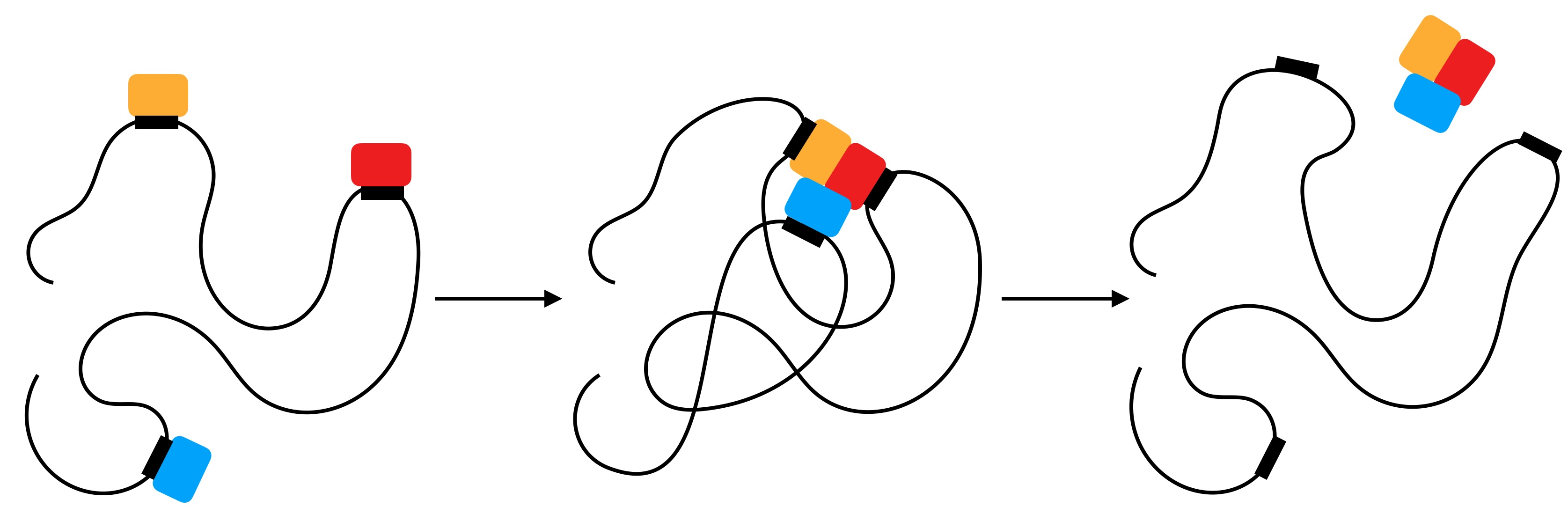
Katalytische Funktion eines Gerüstproteins
Autor: Ulrich Helmich 05/2025, Lizenz: Public domain
Das Gerüstprotein besteht hauptsächlich aus unstrukturierten Bereichen. Drei Domänen des Proteins können drei verschiedene Edukte binden, zum Beispiel andere Proteine oder RNA-Moleküle. Durch thermische Bewegungen kann das Gerüstprotein diese drei Komponenten nun zusammenbringen.
Gerüstproteine halten Kondensate zusammen
Haben Sie sich schon einmal den Aufbau eines Ribosoms näher angesehen? Ein eukaryotisches Ribosom besteht aus einer kleinen und einer großen Untereinheit. Die kleine Untereinheit (40S) besteht aus einer 18S-rRNA und 33 Proteinen, während die große Untereinheit (60S) aus drei rRNA-Molekülen (28S-, 5,8S- und 5S-rRNA) und 49 Proteinen besteht. Wie werden diese vielen Makromoleküle zusammengehalten?
Die rRNA- und Protein-Ketten bilden ein sogenanntes Biomolekulares Kondensat. Solche Kondensate bestehen aus mehreren bis vielen Molekülen und werden durch eine Vielzahl schwacher Wechselwirkungen zusammengehalten:
RNA-RNA-Wechselwirkungen über H-Brücken zwischen komplementären Nucleotiden
RNA-Protein-Wechselwirkungen über H-Brücken und elektrostatische Anziehungen zwischen Aminosäure-Seitenketten und Nucleotiden.
Protein-Protein-Wechselwirkungen, hier gibt es verschiedene Möglichkeiten nicht-kovalenter Bindungen wie H-Brücken, elektrostatische Anziehung, hydrophobe Wechselwirkung oder - ganz exotisch - gestapelte Phenylalanine.
Bei den gestapelten Phenylalaninen lagern sich die Benzolringe von zwei Phenylalanin-Seitenketten übereinander und bilden eine schwache chemische Bindung aus, die in der Chemie als π-π-Bindung bezeichnet wird und zu den van-der-Waals-Wechselwirkungen gehört.