Die drei van-der-Waals-Wechselwirkungen
Neben den starken chemischen Bindungen (kovalente Bindung, Ionenbindung und metallische Bindung) gibt es zwei Arten von schwachen chemischen Bindungen, nämlich die (relativ starken) Wasserstoffbrücken-Bindungen und die (relativ schwachen) van-der-Waals-Wechselwirkungen bzw. -bindungen bzw. -kräfte.
Grundsätzlich kann man drei Typen der van-der-Waals-Wechselwirkungen beobachten.
- Anziehung permanenter Dipol - permanenter Dipol (Keesom-Wechselwirkung, 2-25 kJ/mol)
- Anziehung permanenter Dipol - polarisierbares Teilchen (Debye-Wechselwirkung, 2-10 kJ/mol)
- Anziehung polarisierbares Teilchen - polarisierbares Teilchen (London-Wechselwirkung, 0,1-40 kJ/mol)
Die in vielen Schulbüchern genannte Anziehung permanenter Dipol - Ion zählt übrigens nicht zu den van-der-Waals-Kräften. Diese Anziehung ist wesentlich stärker als jede der drei oben genannten Kräfte, sogar stärker als eine Wasserstoffbrücken-Bindung!
Für Experten LK, Studium
Während bei Ionenbindungen (starke Bindung) die Anziehungskraft zwischen den Ionen mit der 2. Potenz des Radius abnimmt, gilt für die drei Typen der van-der-Waals-Wechselwirkung folgende Beziehung:
$F = k * \frac{z_{1}z_{2}}{r^{6}}$
mit F = Anziehungskraft, k = Konstante, z1, z2= Ladungen der beiden sich anziehenden Teilchen (eigentlich nur für permanente Dipole relevant). Die Anziehungskraft nimmt also mit der 6. Potenz des Radius ab. Das heißt, die Anziehungskraft wird mit zunehmender Entfernung sehr viel schneller schwach als bei der Ionenbindung.
Angenommen, die Entfernung zwischen zwei Teilchen betrage 10 Einheiten und die Teilchen ziehen sich mit 4000 Einheiten gegenseitig an. Verdoppelt man die Entfernung jetzt auf 20 Einheiten, so würde bei einer Ionenbindung die Anziehungskraft auf 1/4, nämlich auf 1000 Einheiten reduzieren. Bei einer van-der-Waals-Wechselwirkung dagegen würde die Anziehungskraft auf 1/64, also auf 62,5 Einheiten reduziert werden.
Neuere Erkenntnisse
Allerdings ist nach neuesten wissenschaftlichen Erkenntnissen diese Formel inzwischen überholt. Forscher vom Fritz-Haber-Institut der Max-Planck-Gesellschaft in Berlin haben gemeinsam mit Kollegen in Italien und den USA Berechnungen durchgeführt, die zeigen, dass die van der Waals-Wechselwirkungen viel weitreichender sind als bisher angenommen.
"Dabei stellten sie unter anderem fest, dass die Van-der-Waals-Kraft bei zunehmender Entfernung deutlich langsamer abnimmt als bislang angenommen. Damit ist ihre Reichweite viel größer als aus dem herkömmlichen Modell zu schließen war." [4]
Die Anziehung bei der van der Waals-Wechselwirkungen soll demnach bis zu 100 nm wirken. Das ist weit mehr, als nach der klassischen Formel zu erwarten wäre. Außerdem haben die Forscher herausgefunden, dass es keinen festen Exponenten $r^{6}$ gibt, sondern dass der Exponent mit dem Abstand variiert [4]. Diese theoretischen Berechnungen decken sich nach Aussagen der MPG gut mit den Experimenten, die andere Forscher durchgeführt haben.
Und hier noch ein paar wichtige Fachbegriffe, damit Sie die folgenden Abschnitte besser verstehen können:
- permanenter Dipol: Ein Molekül mit Atomen unterschiedlicher Elektronegativität wie HCl, H2O, Acton etc. ist ständig ein Dipol.
- induzierter Dipol: Ein unpolares Molekül oder ein Atom wird durch Einwirkung äußerer Kräfte zu einem Dipol.
- temporärer Dipol: Ein unpolares Molekül oder ein Atom ist für eine extrem kurze Zeit (temporär) durch Ungleichverteilung von Elektronen zufällig zu einem Dipol geworden.
Falls Sie Schüler(in) der Stufe EF sind und sich nur dafür interessieren, warum sich Alkan-Moleküle gegenseitig anziehen, dann könnten Sie eigentlich die nächsten drei Abschnitte überspringen und gleich zum Abschnitt "Vertiefung: London-Wechselwirkungen" springen. LK-Schüler(innen) und Studierende sollten allerdings die nächsten drei Abschnitte lesen und verstehen.
1. Keesom-Wechselwirkung LK, Studium
Als Keesom-Kraft bezeichnet man Wechselwirkungen zwischen zwei
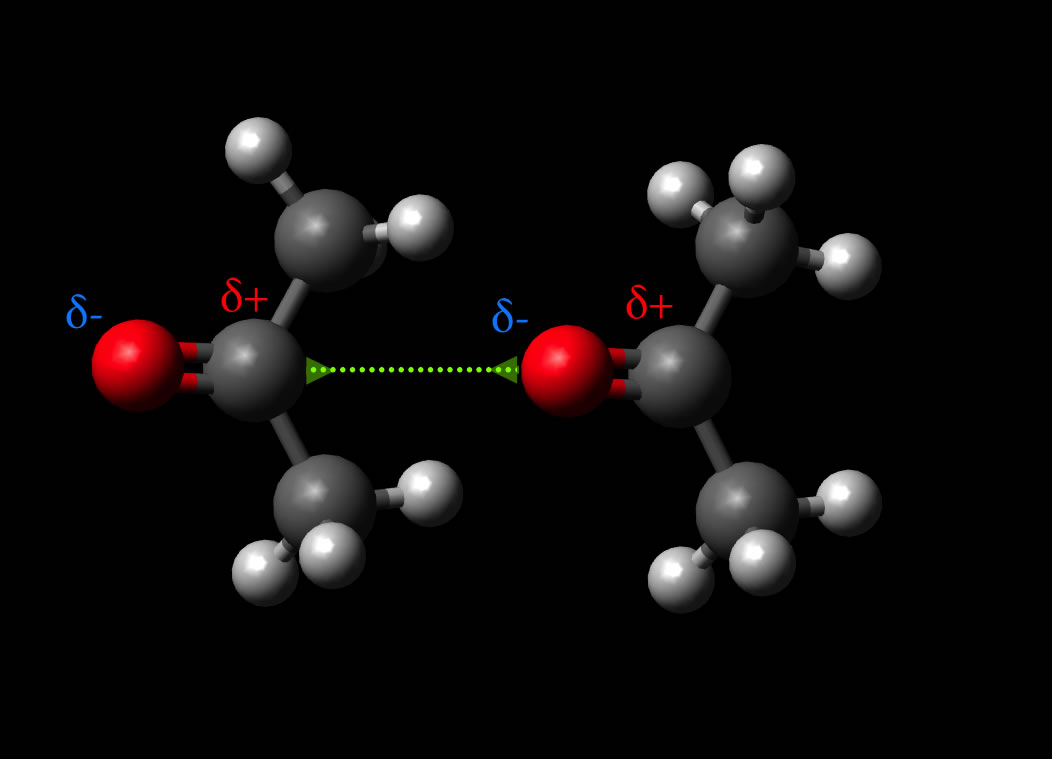
Dipol-Dipol-Wechselwirkung zwischen zwei Aceton-Dipolen
Autor: Ulrich Helmich, Lizenz: Public domain
Diese Art der Wechselwirkung wurde nach nach Willem Hendrik Keesom 1930 als Keesom-Wechselwirkung bezeichnet. Im Schulunterricht und auch an den meisten Hochschulen ist jedoch der Begriff Dipol-Dipol-Wechselwirkung gebräuchlicher, manchmal auch Dipol-Dipol-Kraft.
Interessant bei der Keesom-Wechselwirkung ist, dass sich die beiden permanenten Dipole zueinander ausrichten, so dass die Gesamtenergie des Systems sinkt. Allerdings funktioniert das nur bei relativ niedrigen Temperaturen. Bei höheren Temperaturen ist die thermische Energie der Dipole zu groß für eine solche Ausrichtung, mit anderen Worten: Die Teilchen bewegen sich einfach zu stark [3].
Die Stärke der Keesom-Wechselwirkung ist mit 2-25 kJ/mol recht variabel, sie hängt von den Dipolmomenten der Moleküle ab.
2. Debye-Wechselwirkung LK, Studium
Ein permanenter Dipol wie Aceton kann auch völlig unpolare Moleküle oder Atome anziehen, indem er in diesen Teilchen einen Dipol induziert. Zwischen Aceton und Pentan bestehen zum Beispiel solche Wechselwirkungen, die als Debye-Wechselwirkungen bezeichnet werden.
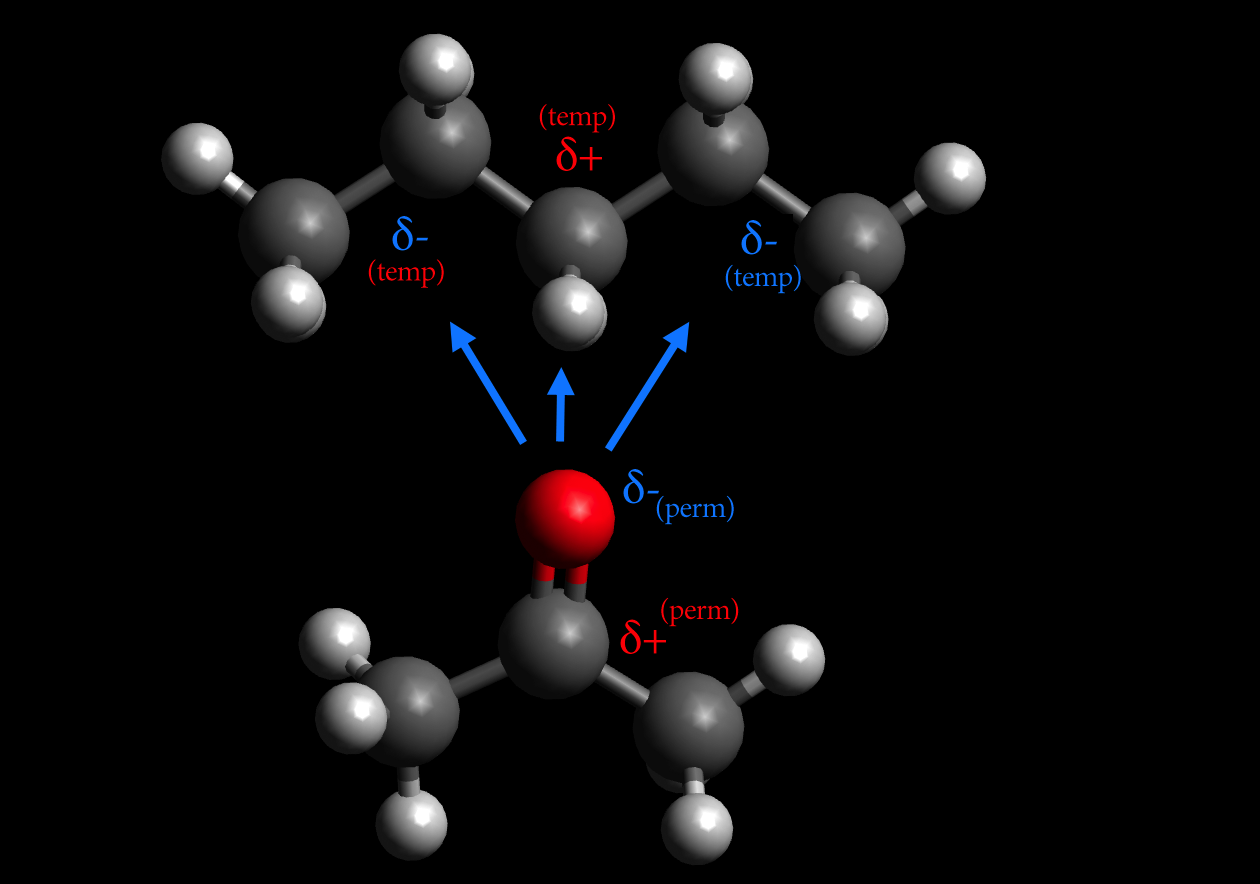
Debye-Wechselwirkung zwischen Acetion und Pentan
Autor: Ulrich Helmich, Lizenz: Public domain
Der permanente Aceton-Dipol verdrängt die Elektronen des Pentan-Moleküls, so dass dort ein temporärer Dipol entsteht (blaue Pfeile).
Ein anderes Beispiel ist das Brom-Molekül Br2, das leicht zu einem temporären Dipol umgewandelt werden kann, wenn es in die Nähe einer elektronenreichen C=C-Doppelbindung kommt, wie es beispielsweise bei der Bromierung eines Alkens der Fall ist. Die Doppelbindung zieht den Br2-Dipol dann an.
Die Stärke der Deybye-Wechselwirkung ist mit 2-10 kJ/mol deutlich schwächer als die Stärke der Keesom-Wechselwirkung.
3. London-Kräfte LK, Studium
London-Kräfte bestehen zwischen Molekülen oder Atomen, die nicht polar sind, also keinen permanenten Dipol darstellen. Das klassische Beispiel sind zwei H2-Moleküle oder zwei Alkan-Moleküle.
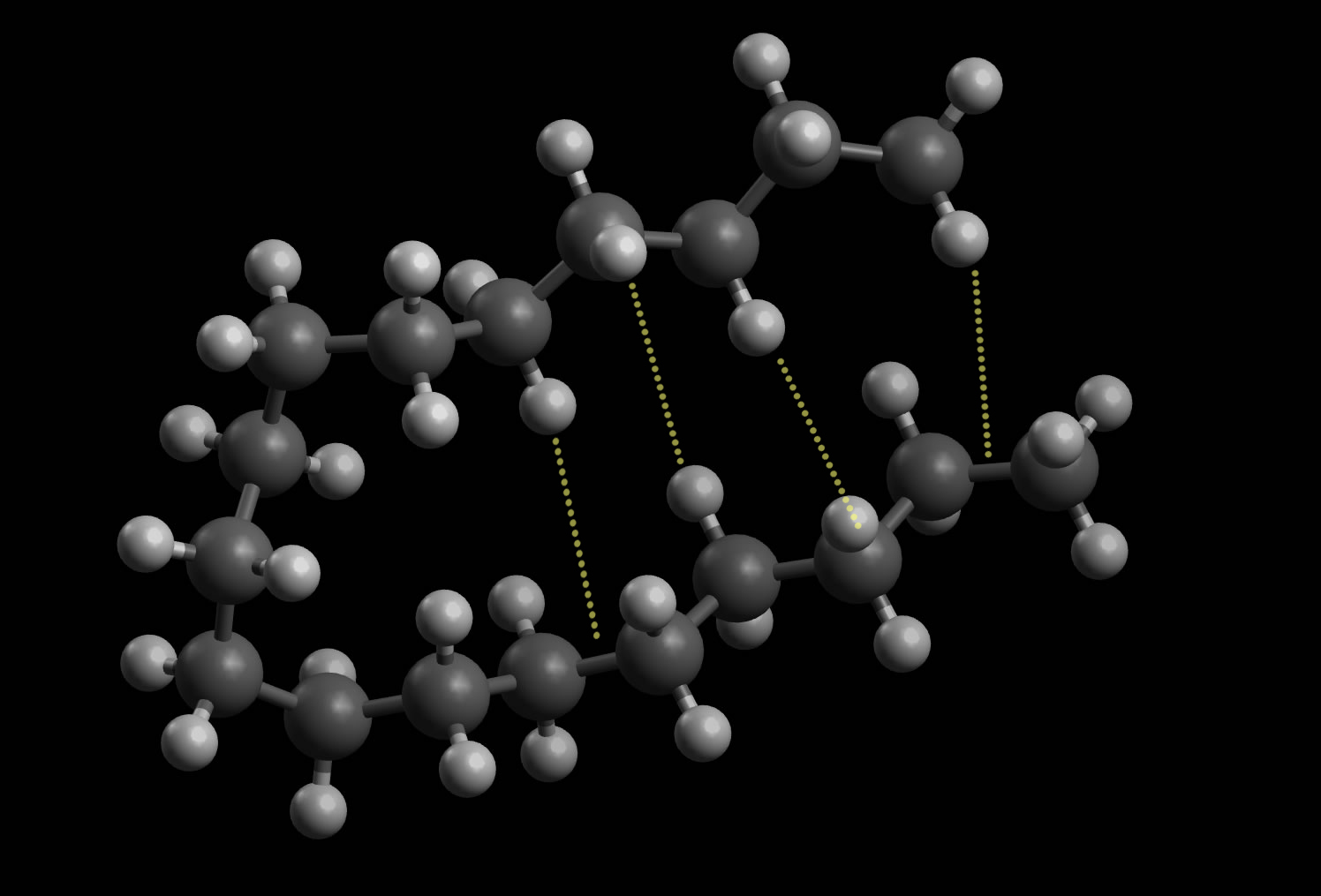
London-Wechselwirkungen innerhalb eines langen Alkan-Molekükls
Autor: Ulrich Helmich, Lizenz: Public domain
Langkettige Alkan-Moleküle mit mehr als 16 C-Atomen bilden Haarnadelschleifen, die von schwachen London-Wechselwirkungen zusammengehalten werden [2].
Die Stärke der London-Wechselwirkung ist mit 0,1-40 kJ/mol extrem variabel, sie hängt von der Kontaktfläche zwischen den Molekülen sowie von der Polarisierbarkeit der Moleküle ab. Große Iod-Atome sind beispielsweise viel leichter polarisierbar als kleine Chlor-Atome, daher kann in der Elektronenhülle der Iod-Atome sehr leicht ein temporärer Dipol erzeugt werden.
Zu dieser wichtigen und von vielen Leuten unterschätzten zwischenmolekularen Kraft gibt es jetzt eine eigene Seite in diesem Lexikon. Hier wir die London-Kraft mit der Keesom-Kraft verglichen. Dabei stellen wir fest, dass die angeblich "schwache" London-Kraft einen viel größeren Einfluss hat als im Chemieunterricht vermittelt wird.
π-π-Wechselwirkungen LK, Studium
Zwischen zwei aromatischen Molekülen gibt es eine besondere Art der van der Waals-Wechselwirkungen, nämlich die sogenannten π-π-Wechselwirkungen [3]. Diese schwache Art der Wechselwirkung ist so benannt, weil die delokalisierten pi-Elektronen der beiden Moleküle miteinander wechselwirken. Die pi-pi-Wechselwirkungen sind stärker als die London-Kräfte, was daran liegt, dass die pi-Elektronen delokalisiert und damit viel beweglicher sind. Die Induktion eines Dipols ist somit wesentlich einfacher als beispielsweise in einem Cycloalkan-Molekül gleicher Größe.
Zwei Protein-Moleküle können beispielsweise eine schwache Bindung eingehen, wenn sich die Benzolringe von zwei Phenylalanin-Seitengruppen überlagern.
Auf dieser Lexikonseite, die weitgehend eine Zusammenfassung der englischen Wikipedia-Seite ist, erfahren Sie weitere Einzelheiten über diese Wechselwirkung.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Hoffmann R: Verbunden werden auch die Schwachen mächtig. Spektrum der Wissenschaft 01/2015, S. 72ff
- Chemgapedia.de: Schwache Wechselwirkungen in biologischen Systemen. Seite leider nicht mehr erreichbar!
- Max-Planck-Gesellschaft (mpg.de): Van-der-Waals-Kraft besser als gedacht. Ein Artikel vom 10.03.2016.