Proteinkinasen sind allgemein Enzyme, die eine Phosphatgruppe auf ein Protein übertragen, in der Regel durch Spaltung eines ATP-Moleküls, das dann zu ADP wird.
Protein + ATP → Protein-P + ADP
Die Proteinkinase A (kurz PKA) ist eine cAMP-abhängige Proteinkinase und gehört zu den Serin/Threonin-Kinasen. Das heißt, sie überträgt eine Phosphatgruppe vom ATP auf die Seitenkette der Aminosäure Serin oder Threonin in einem Protein.
Auf dieser Seite hier im Lexikon wird der Vorgang der Phosphorylierung von Proteinen näher erläutert.
Aufbau
Die Proteinkinase A der höheren Eukaryoten besteht aus vier Untereinheiten, zwei regulatorischen (R) und zwei katalytischen (C), es handelt sich also um ein Heterotetramer der Zusammensetzung R2C2. Bei eukaryotischen Einzellern ist die Proteinkinase A einfacher aufgebaut, als Heterodimer R1C1.
Bei Säugetieren gibt es vier Isoformen der R-Untereinheit und drei Isoformen der C-Untereinheit, daher gibt es recht viele Kombinationsmöglichkeiten der Untereinheiten und eine Vielfalt von verschiedenen Proteinkinasen A.
Es gibt spezielle Ankerproteine für die Proteinkinase A (A-Kinase-Ankerproteine oder AKAPs). Diese binden mit dem einen Ende an die regulatorischen Untereinheiten des PKA-Heterotetramers, und mit dem anderen Ende an das Cytoskelett oder die Membran eines Zellorganells [1].
Aktivierung
Wie man auf dem folgenden Bild sieht (A), sind die beiden katalytischen Untereinheiten des Enzyms im "Ruhezustand" durch die regulatorischen Untereinheiten verdeckt, so dass das Enzym inaktiv ist.
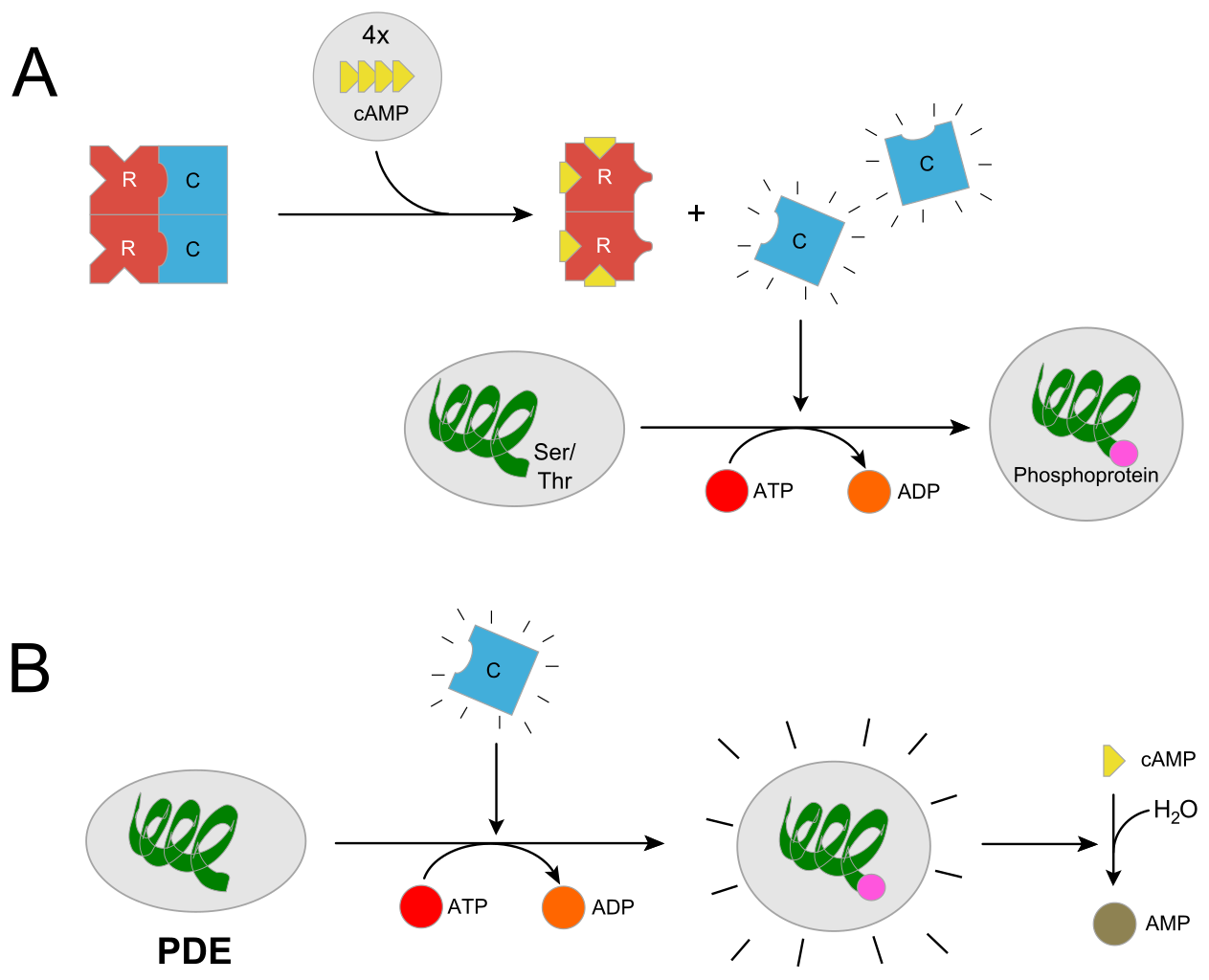
A) Aktivierung der Proteinkinase A durch cAMP
B) Aktivierung der Phosphodiesterase durch Proteinkinase A
Chris Yikrazuul, Public domain, via Wikimedia Commons
Wenn sich aber vier cAMP-Moleküle in die vier cAMP-Bindungsstellen der regulatorischen Untereinheiten setzen, ändern diese ihre Konformation und lösen sich als Homodimer aus dem Heterotetramer. Die beiden katalytischen C-Untereinheiten trennen sich und können jetzt aktiv werden. In dem Bild sieht man, wie eine dieser C-Einheiten eine Phosphatgruppe auf eine Serin- oder Threonin-Seitenkette überträgt.
In Teil (B) des Bildes sieht man, eine eine C-Untereinheit das Enzym Phosphodiesterase (PDE) phosphoryliert. Dieses Enzym dient zum Abbau von cAMP, wie bereits oben ausgeführt.
Im Grunde regelt also cAMP seinen eigenen Abbau, in dem es ein Enzym (PKA) aktiviert, das ein Enzym (PDE) aktiviert, das cAMP abbaut (negative Rückkopplung). Das ist eigentlich ein schönes Beispiel für die berühmte Endprodukthemmung: Wenn genügend cAMP vorhanden ist, fördert es seinen eigenen Abbau.
Was man auf dem Bild nicht sieht, aber auf jeden Fall noch erwähnt werden soll, ist die Tatsache, dass Mg2+-Ionen benötigt werden, wenn die PKA eine Phosphatgruppe auf Serin oder Threonin übertragen soll [3]. Durch die positiven Magnesium-Ionen werden die negativen Ladungen der drei Phosphatgruppen des ATP-Moleküls kompensiert, dadurch wird die Übertragung einer Phosphatgruppe erleichtert.
Biologische Funktion
Die katalytisch aktiven C-Einheiten der Proteinkinase A können frei im Cytoplasma diffundieren und auch durch die Kernporen in den Zellkern gelangen. Im Zellkern können dann bestimmte Transkriptionsfaktoren phosphoryliert werden, so dass die PKA im Grunde die Aktivität bestimmter Gene steuern kann.
In [1] finden wir ein konkretes Beispiel. In Zellen, in denen das Hormon Somatostatin gebildet wird, wird das Somatostatin-Gen durch einen Transkriptionsfaktor (CREB = cAMP response element binding protein).
Auch im Cytoplasma ist die PKA aktiv. Hier ein Beispiel aus [2]: Die Hydrolyse der Triglyceride wird durch PKA-regulierte Lipasen kontrolliert. Gleichzeitig hemmt PKA ein wichtiges Enzym der Fettsäure-Synthese, nämlich die Acetyl-CoA-Carboxylase.
In Muskelzellen bewirkt cAMP über die Proteinkinase A eine Aktivierung von ATPasen und so einen Anstieg der ATP-Konzentration - was ja auch sinnvoll ist für den Energie verzehrenden Prozess der Muskelkontraktion.
Die aktivierte PKA sorgt auch für den Abbau von Nährstoffen, für die Bildung von Magensäure, vermindert die Aggregation von Blutplättchen und spielt eine Rolle bei der Öffnung von Chloridkanälen - um nur ein paar Beispiele zu nennen [2,4].
Proteinkinase A und Cholera
Eine Krankheit, bei der die Proteinkinase A eine Rolle spielt, ist Cholera. Das Choleratoxin katalysiert eine kovalente und daher dauerhafte Veränderung eines wichtigen G-Proteins, so dass die α/GTP-Einheit des G-Proteins ständig aktiv ist. Das GTP kann nicht mehr in GDP umgewandelt werden, daher kann die Einheit nicht mehr in den inaktiven Zustand zurückkehren. Die α/GTP-Einheit aktiviert dann Adenylatcyclasen, diese produzieren cAMP, und das cAMP wiederum aktiviert eine Proteinkinase A, die dann zwei Dinge macht:
Erstens phosphoryliert sie Chlorid-Kanäle, und das hat zur Folge, dass ständig Cl--Ionen in die Zellen des Darms eindringen.
Zweitens phosphoryliert die Proteinkinase A die Na+/H+-Austauscher in den Darmzellen [4,5].
"Insgesamt hat die Phosphorylierung zur Folge, dass NaCl und Wasser in großen Mengen über den Darm verloren gehen. Patienten, die vier bis sechs Tage lang an Cholera leiden, geben bis zum Doppelten ihres Körpergewichts an Flüssigkeit ab." [4]
Glucosemangel
Wenn der Blutzuckerspiegel einen bestimmten Wert unterschreitet, beispielsweise wenn man länger nichts gegessen hat, steigt die Konzentration des Hormons Glucagon im Blut an. Dieses Hormon löst einen Anstieg der cAMP-Konzentration in den Zellen aus ("üblicher" Weg: Hormon dockt an Rezeptor an → G-Protein wird aktiv → Adenylatcyclase wird aktiviert). Das cAMP aktiviert dann die Proteinkinase A, das dann ein wichtiges Enzym des Glucose-Stoffwechsel aktiviert und so eine Gluconeogenese einleitet, also eine Neubildung von Glucose. Dadurch wird die Versorgung des Gehirns mit Glucose sichergestellt.
Arbeitsweise
Nicht jede Serin- oder Threonin-Seitenkette in einem Protein wird von der Proteinkinase A phosphoryliert. Bevorzugt werden sogenannte Konsensus-Sequenzen, nämlich Arg–Arg–X–Ser–Z oder Arg–Arg–X–Thr–Z, wobei X für eine kleine Aminosäure steht und Z für eine große hydrophobe Aminosäure [4].
Interessant ist auch, dass die regulatorischen Untereinheiten der Proteinkinase A ebenfalls eine Aminosäure-Sequenz enthalten, die der eben genannten Konsensus-Sequenz stark ähnelt: Arg–Arg–Gly–Ala–Ile. Aufgrund dieser Ähnlichkeit können diese fünf Aminosäuren jetzt an das aktive Zentrum der katalytischen Untereinheit binden und damit blockieren [4].
Quellen:
- Alberts et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Wikipedia-Artikel "Proteinkinase A"
- engl. Wikipedia, Artikel "Protein kinase A"
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- engl. Wikipedia, Artikel "Cholera"