Einteilung nach Stillwell
Stillwell [1] unterteilt die Transmembranproteine nach ihrer Struktur in vier Klassen:
- Single Transmembrane α-Helix
- Multiple Transmembrane Span by α-Helices
- Multiple Transmembrane Span by β-Barrels
- Lipid-Anchored Proteins
Single Transmembrane α-Helix
Diese Transmembranproteine bestehen aus drei Abschnitten: Einem globulären Abschnitt auf der einen Seite der Membran, einer alpha-Helix, die sich durch den hydrophoben Teil der Membran zieht, und einem globulären Abschnitt auf der anderen Seite der Membran. Ein schönes Beispiel für ein solches Transmembranprotein ist das Glycophorin in der Membran der roten Blutkörperchen (siehe Lexikon-Artikel "Glycophorin").
Multiple Transmembrane Span by α-Helices
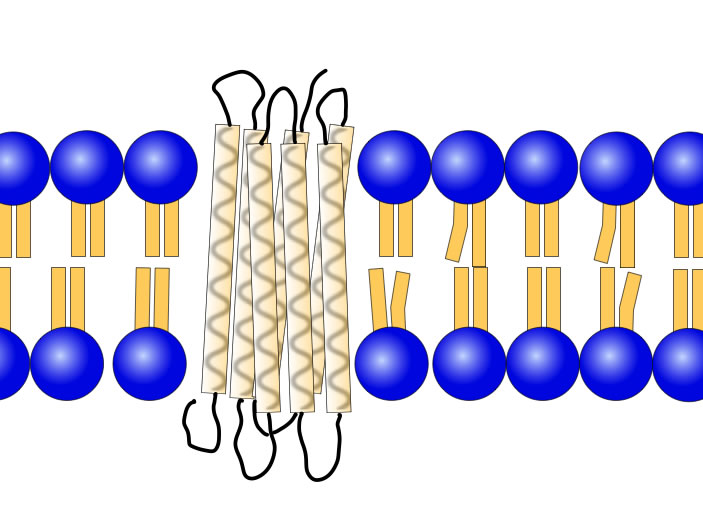
Die in Abbildung 1 gezeigten sieben α-Helices, welche das Kanalprotein in der Membran verankern, sind ein gutes Beispiel für ein solches Transmembranprotein. In der Tat gibt es sehr viele Membranproteine, die durch genau sieben α-Helices in der Membran verankert werden. Hier vier Beispiele, die vielleicht schon aus dem Biologie-Unterricht der Oberstufe bekannt sind:
- Rhodopsin in der Netzhaut
- Duftstoff-Rezeptoren in der Riechschleimhaut
- Spannungsgesteuerte Kaliumkanäle in der Membran von Nervenzellen
- Chloridkanäle
Es gibt noch viel mehr solcher 7-Helix-Proteine. Auch viele Hormonrezeptoren gehören dazu und die große Familie der G-Protein gekoppelten Rezeptoren (zum Beispiel Rhodopsin oder die Duftstoff-Rezeptoren).
Ein 7-Helix-Transmembranprotein
Autor: Ulrich Helmich, Lizenz: Public domain
Das am besten untersuchte 7-Helix-Protein ist Bacteriorhodopsin, das in der Membran salzliebender Archaeen vorkommt. Über 80% des Proteins bilden die sieben Helices, die restlichen < 20% bilden die Schleifen, mit denen die Helices verbunden sind. Jede Helix besteht aus ca. 20 meist unpolaren Aminosäuren.
Ein spannungsgesteuerter Natriumkanal
Quelle: engl. Wikipedia, Artikel "sodium channel", Bild bereitgestellt von JWSchmidt.
Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported.
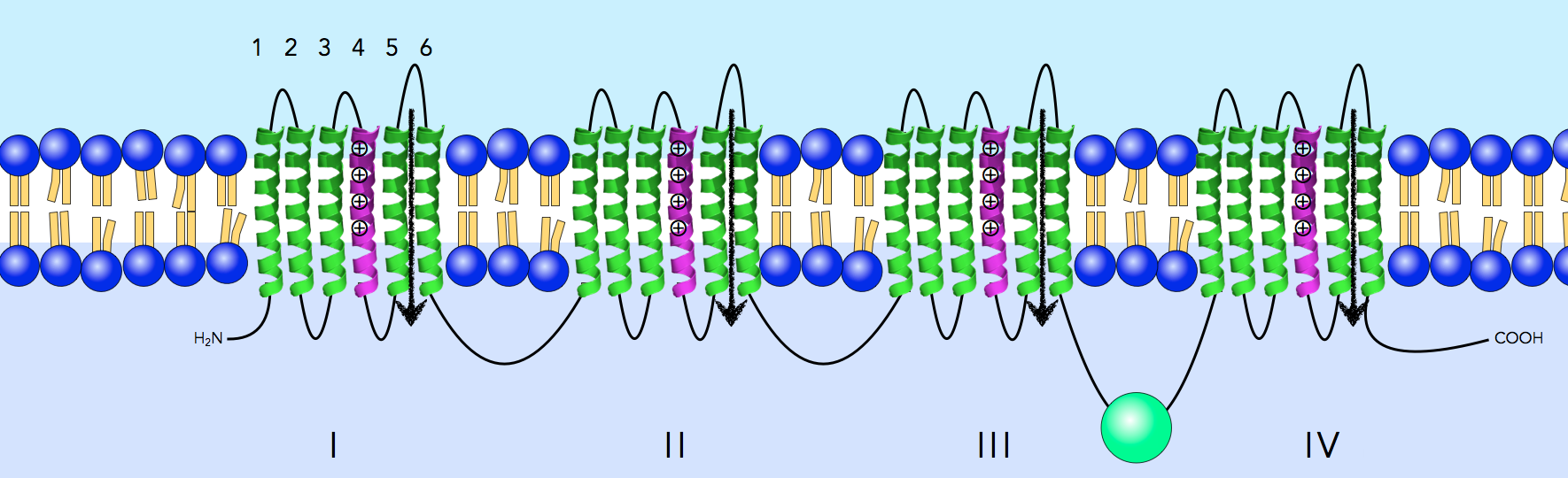
Das obige Bild zeigt einen spannungsgesteuerten Natriumkanal [3]. Er besteht aus vier Domänen, und jede Domäne des Proteins ist mit sechs α-Helices in der Membran verankert.
Luckey [5] bezeichnet solche Transmembranproteine als Typ III - Proteine oder Polytopic proteins.
Multiple Transmembrane Span by β-Barrels
Viele wichtige Transmembranproteine werden nicht durch α-Helices in der Membran verankert, sondern durch β-Faltblätter (engl. β-Barrels).
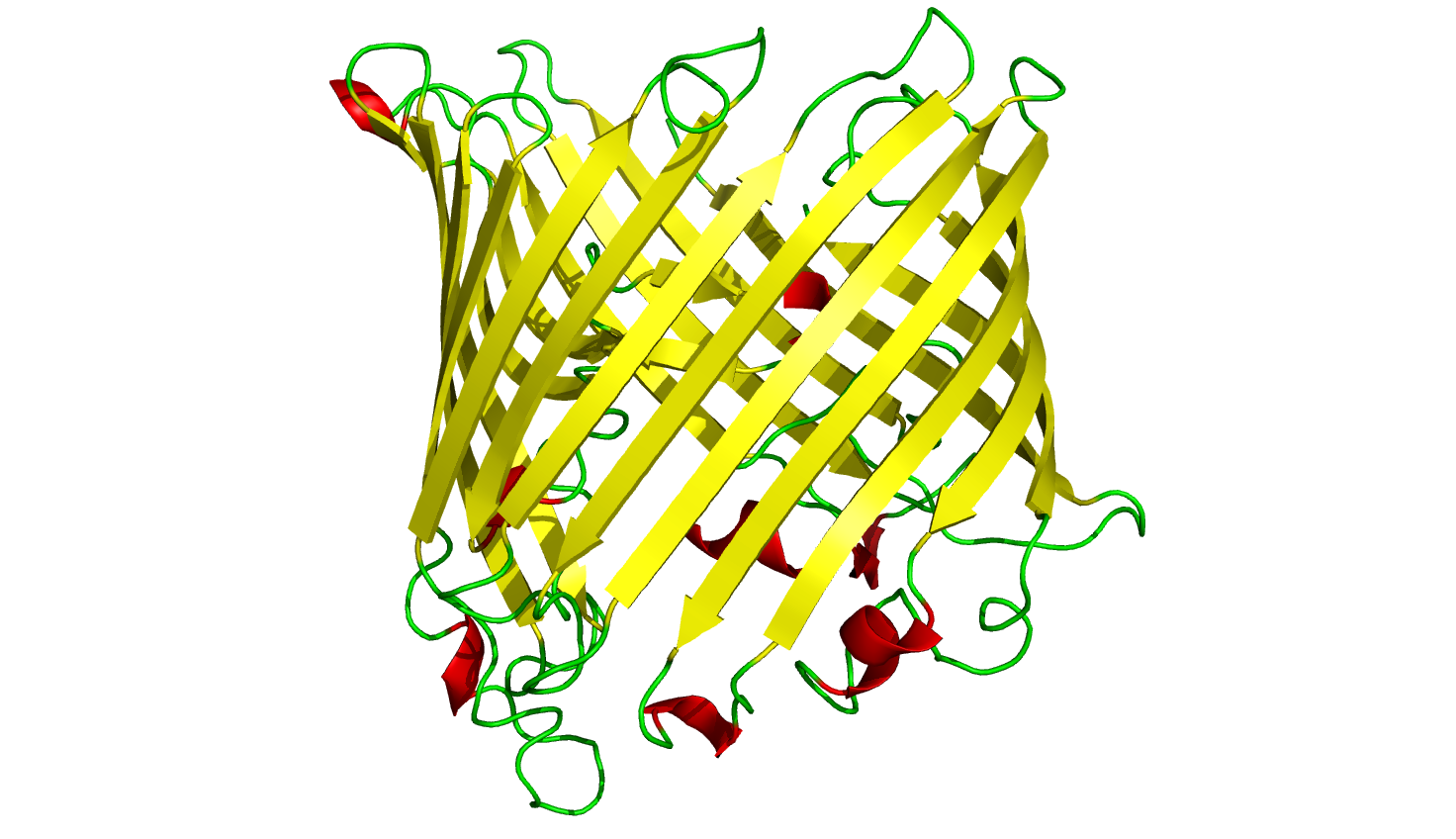
Bändermodell eines Saccharose-Kanals aus der Zellmembran von Salmonellen
Quelle: Wikipedia, Artikel "B-Fass", Autor: Opabinia regalis,
Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported
Hier sieht man ein Porin aus der Zellmembran von Salmonellen. Salmonellen sind Bakterien (Prokaryoten), und Porine sind Proteine, die eine Pore in der Zellmembran bilden, durch die hydrophile polare Stoffe wie zum Beispiel Saccharose die Membran passieren können. Porine kommen bei Prokaryoten und den von Prokaryoten abstammenden Mitochondrien und Chloroplasten vor (in der inneren Membran).
Porine bestehen aus einer Kette von 300–420 Aminosäuren, die 16 oder 18 β-Faltblätter bilden, die antiparallel und spiralig angeordnet sind, so dass sich ein fassartiger Hohlraum ergibt [4]. Jedes Faltblatt besteht aus einer überraschend kleinen Zahl von Aminosäuren, nämlich nur sieben bis neun [1]. Im Vergleich zu den ca. 20 Aminosäuren, aus denen eine α-Helix der durch Helices verankerten Transmembranproteine besteht, ist das recht wenig.
Genau wie in dem Schulbeispiel auf der Seite "Membranproteine" sind die β-Faltblätter so angeordnet, dass sich die hydrophoben Aminosäuren auf der Außenseite des Kanals befinden, die hydrophilen dagegen auf der Innenseite.
Lipid-Anchored Proteins
Kommen wir zur letzten Klasse der Transmembranproteine. Unter den lipid-verankerten Proteinen versteht man Transmembranproteine, die zusätzlich zu den α-Helices oder β-Faltblättern eine oder mehrere Fettsäuren kovalent gebunden haben, mit denen sie zusätzlich in der cytoplasmatischen Seite der Lipid-Doppelschicht verankert sind.
Weitere Einzelheiten zu den vier Typen der lipid-verankerten Proteine finden Sie auf der Lexikon-Seite "Lipid-Anker" auf dieser Homepage.
Einteilung nach Luckey / Lehninger
Nach Luckey [5] und Lehninger [2] kann man bei diesen Transmembranproteinen vier Typen unterscheiden:
Bitope Proteine mit nur einer Transmembran-Helix, N-Terminus auf der Außenseite (Typ I) oder N-Terminus auf der Innenseite (Typ II).
Polytope Proteine mit mehreren Transmembran-Segmenten in einem einzigen Polypeptid (Typ III).
Oligomere Proteine, die aus einzelnen Polypeptiden bestehen, die mit je einer Helix durch die Membran ziehen (Typ IV).
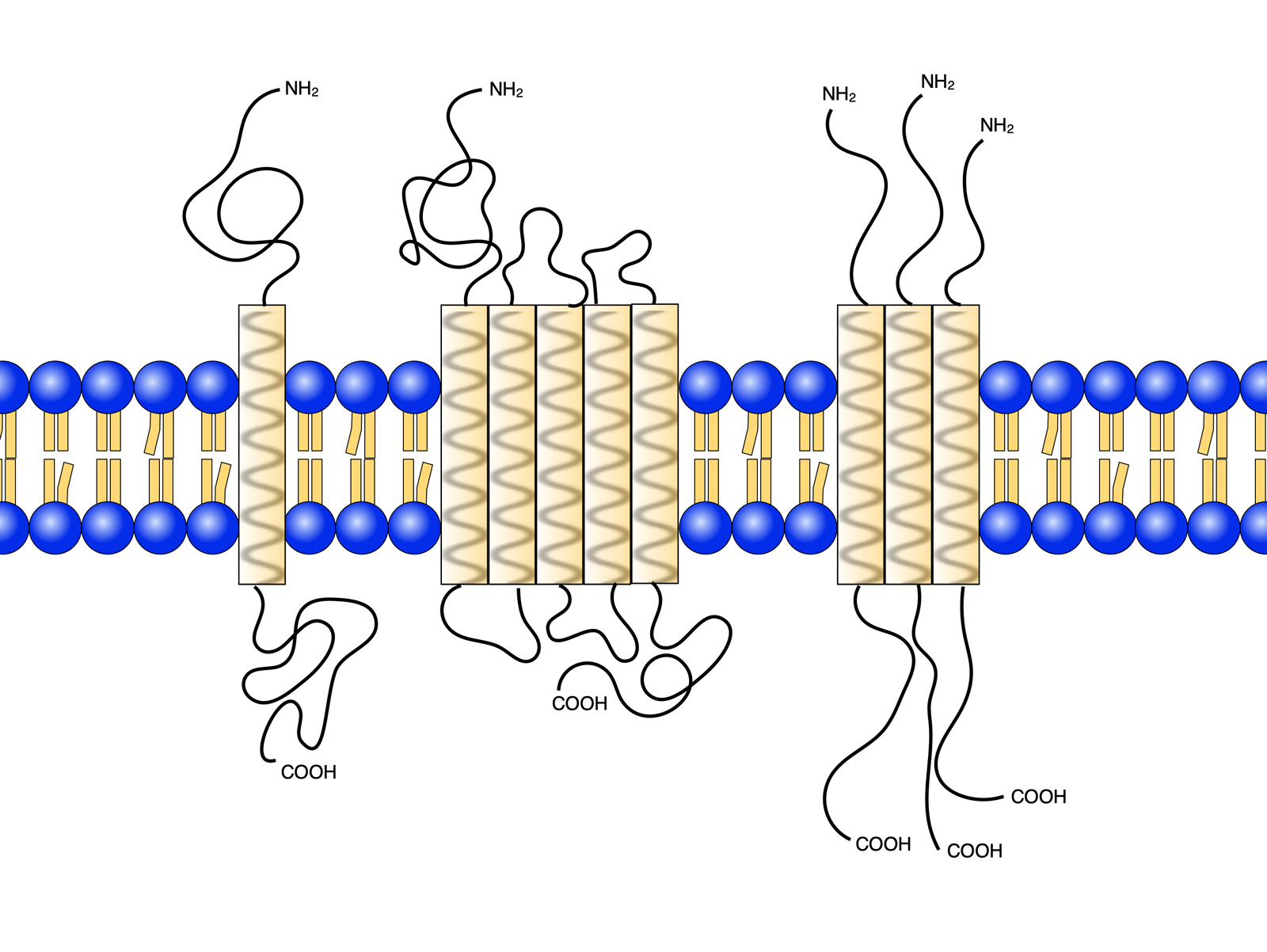
Biotope, polytope und oligomere integrale Membranproteine
Autor: Ulrich Helmich 2022, nach einem Bild aus Luckey, Lizenz: Public domain
Links auf diesem Bild sehen wir ein biotopes Protein mit nur einer Transmembranhelix, in der Mitte befindet sich ein polytopes Protein mit fünf Transmembranhelices, und rechts sehen wir ein aus drei Untereinheiten (Polypeptidketten) zusammengesetztes oligomeres Transmembranprotein.
Die Zahl der Transmembranhelices der polytopen Proteine kann zwischen 2 und 13 schwanken, besonders häufig findet man aber 4, 7 oder 12 Transmembranhelices bei diesen Proteinen [5].
Betrachten wir nun noch einmal den spannungsgesteurten Natrium-Kanal aus Abbildung 2. Hier haben sich vier Protein-Untereinheiten mit je sechs Transmembranhelices zu einem Transmembranprotein zusammengetan, sind aber durch Peptidschleifen miteinander verbunden, bilden also eine durchgehende Aminosäure-Kette. Streng genommen müsste man auch diesen Kanal als polytopes Membranprotein mit 24 Transmembranhelices bezeichnen, wegen der durchgehenden Peptidkette.
Einteilung nach Funktion
Man kann nach ihrer Funktion grob drei Klassen von Transmembranproteinen unterscheiden:
- Kanalproteine
- Carrierproteine
- Rezeptorproteine
Kanalproteine
Eine spezielle Klasse der Transmembranproteine sind die Kanalproteine, manchmal auch als Porenproteine bezeichnet. Das sind Transmembranproteine, die von einem hydrophilen Kanal durchzogen werden. Durch diesen Kanal können dann polare Verbindungen wie Wasser oder Glucose oder sogar elektrisch geladene Teilchen wie Natrium- oder Kalium-Ionen durch die Membran diffundieren. Kanalproteine, die Ionen durchlassen, werden als Ionenkanäle bezeichnet.
Neben einfachen Kanalproteinen gibt es auch Kanalproteine, die von der Zelle gesteuert werden können. Zu bestimmten Zeiten sind diese Kanalproteine geschlossen, zu anderen Zeiten geöffnet.
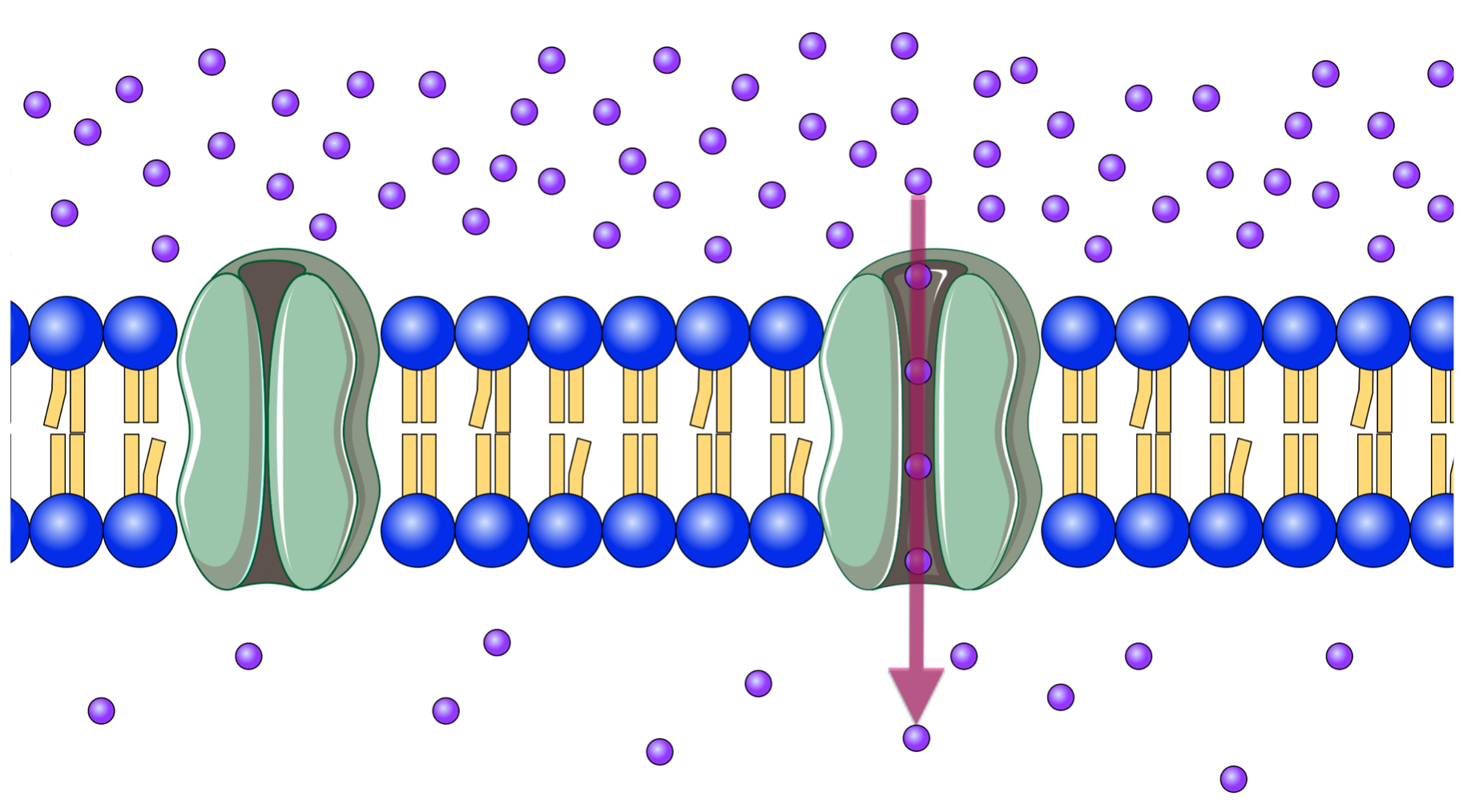
Ein Kanalprotein, geschlossen und geöffnet
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei Nervenzellen gibt es beispielsweise Natriumkanäle, die im Ruhezustand der Zelle geschlossen sind. Soll aber ein Aktionspotenzial gebildet werden, so ändert sich das Membranpotenzial und die Natriumkanäle öffnen sich, so dass viele Na+-Ionen in die Zelle strömen und das Membranpotenzial noch stärker verändern. Andere Kanalproteine können durch Liganden wie Acetylcholin geöffnet werden, und schließlich gibt es sogar Kanalproteine, die sich durch mechanische Einwirkungen öffnen oder verschließen. Man spricht dann von spannungsgesteuerten, ligandengesteuerten oder mechanisch gesteuerten Kanalproteinen.
Carrierproteine
Kanalproteine sind zwar teils recht spezifisch, sie lassen nur bestimmte Teilchen durch, aber die Selektivität ist oft nicht besonders groß. Viele Natriumkanäle von Nervenzelle lassen beispielsweise auch Kalium-Ionen passieren. Zucker-Moleküle kommen natürlich nicht durch die enge hydrophile Pore eines Natriumkanals, dafür sind sie einfach zu groß.
In der Membran gibt es aber auch Proteine, die eine wesentlich höhere Spezifität haben als einfache Kanalproteine, nämlich die sogenannten Carrierproteine.
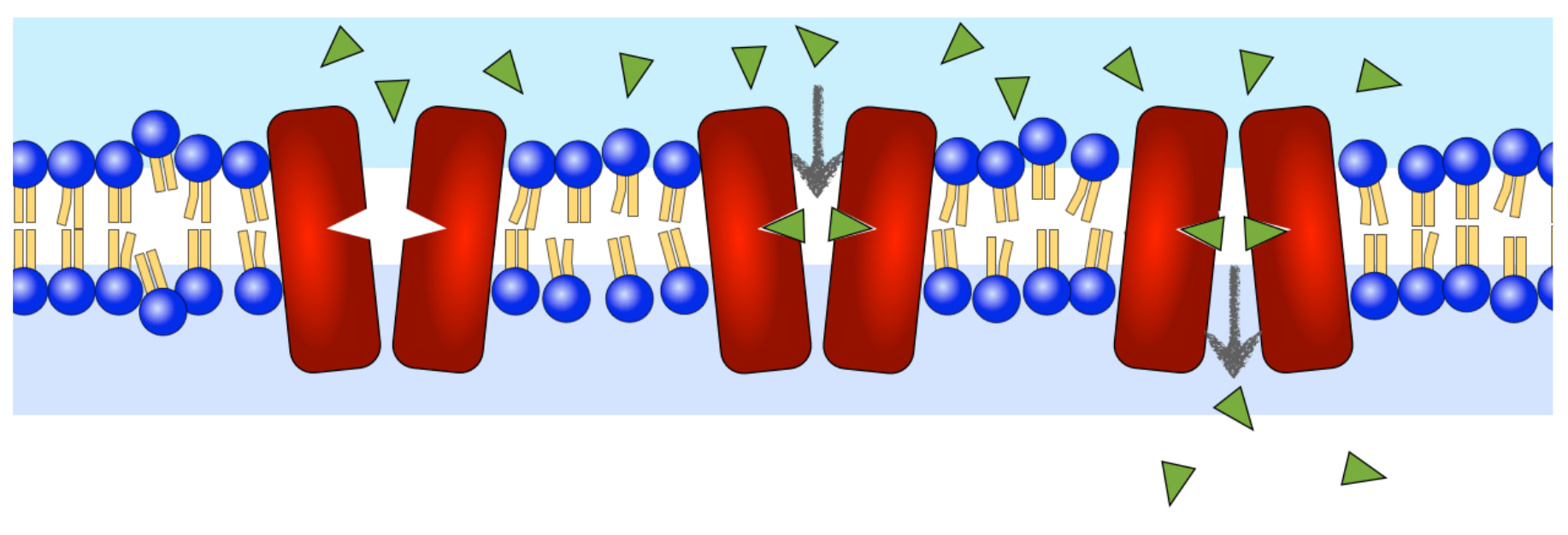
Ein Carrierprotein in Aktion
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Carrierproteine kommen stets in zwei Konformationen vor, in Abbildung oben kann man das gut sehen.
In der einen Konformationen (links) ist das Carrierprotein zur Zellaußenseite hin geöffnet. Das Carrierprotein besitzt ein aktives und spezifisches Zentrum, in das sich die. zu transportierenden Teilchen nach dem Schlüssel-Schloss-Prinzip hineinsetzen können. (Mitte).
Sobald das aktive Zentrum des Carrierproteins besetzt ist, ändert sich seine Konformation. Vorher war es zur Außenseite der Membran hin geöffnet, jetzt ist es zur Innenseite der Membran hin offen. Die im aktiven Zentrum gebundenen Moleküle oder Ionen können dieses Zentrum nun verlassen und gelangen so auf die Innenseite der Membran und von dort ins Cytoplasma oder in das jeweilige Zellorganell.
Aktiver und passiver Transport
Während Kanalproteine die Teilchen nur in Richtung des jeweiligen Konzentrationsgefälles durchlassen - man spricht hier auch von einem passiven Transport, können bestimmte Carrierproteine die Teilchen auch gegen ein bestehendes Konzentrationsgefälle transportieren. Man spricht dann von einem aktiven Transport oder von einem Bergauftransport. Allerdings benötigen solche Carrierproteine dann Energie, meistens in Form von ATP.
Ein bekanntes Beispiel für einen solchen aktiven Carrier ist die Natrium-Kalium-Pumpe der Nervenzellen. Dieser Carrier transportiert drei Na+-Ionen nach außen und im Gegenzug zwei K+-Ionen nach innen und verbraucht dafür ein ATP-Molekül. Nervenzellen verwenden ca. 60% ihres Energieumsatzes für den Betrieb dieser wichtigen Ionenpumpe.
Rezeptorproteine
Neben den Kanalproteinen und den Carrierproteinen wollen wir hier eine dritte Klasse von Transmembranproteinen kennenlernen, die Rezeptorproteine.
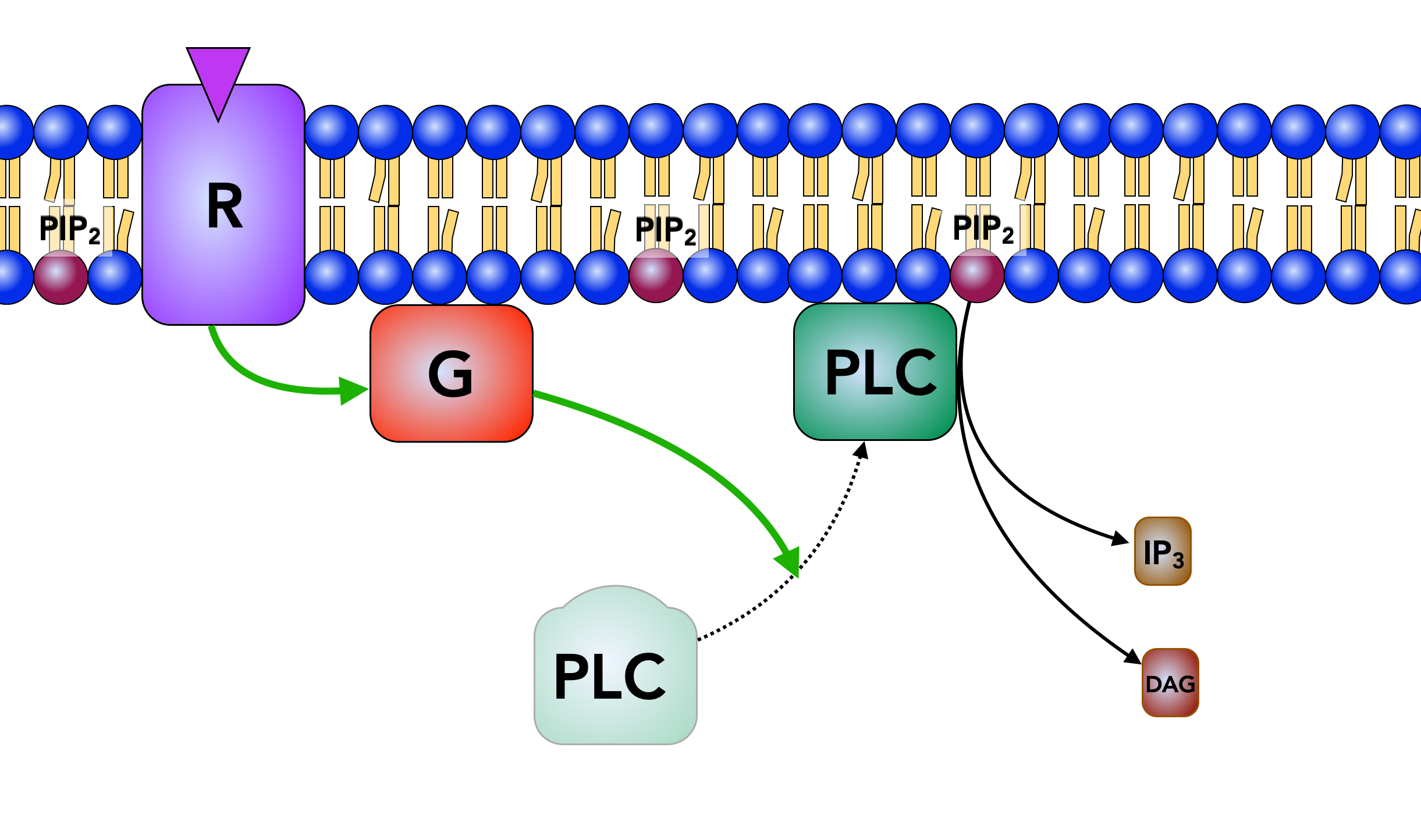
Phospholipase C wird durch ein G-Protein aktiviert
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Rezeptorproteine können Informationen aus der Umgebung der Zelle aufnehmen.
Fallbeispiel 1: In dem obigen Beispiel wird das Rezeptorprotein (R) durch einen Neurotransmitter oder ein Hormon aktiviert; dieser Reiz wirkt auf die Außenseite der Membran ein. Auf der Membraninnenseite ist das Transmembranprotein R mit einem sogenannten G-Protein verbunden, welches seinerseits eine Phospholipase C (PLC) aktiviert, die dann aus dem Membranlipid PIP2 zwei second messenger IP3 und DAG herstellt, die weitere zelluläre Prozesse einleiten.
Fallbeispiel 2: In unserer Riechschleimhaut beispielsweise sitzen die Riechsinneszellen, und diese haben Duftrezeptoren in ihrer Zellmembran. Das sind Transmembranproteine mit einem spezifischen Zentrum auf der Membranaußenseite, das einen bestimmten Duftstoff aufnehmen kann. Setzt sich ein passendes Duftstoff-Molekül in das Rezeptorprotein, dann aktiviert dieses Rezeptorprotein ein G-Protein auf der Membraninnenseite. Das aktivierte G-Protein aktiviert dann viele Exemplare des Enzyms Adenylatcyclase, das als peripheres Protein auf der Innenseite der Membran sitzt. Die Adenylatcyclase stellt dann aus dem universellen Energieträger ATP den second messenger her. Die Moleküle dieser Verbindung setzen sich nun in ligandengesteuerte Natriumkanäle - ebenfalls Transmembranproteine - und öffnen diese. Durch den massiven Einstrom von Na+-Ionen wird das Membranpotenzial der Riechsinneszelle verändert, es entstehen Aktionspotenziale, die über den Riechnerv schließlich zum Gehirn gelangen.
Fallbeispiel 3: Rhodopsin in der Säugetiernetzhaut und Bacteriorhodopsin in bestimmten Halobakterien sind sehr gut erforschte Beispiele für Transmembranproteine, die als Rezeptoren für Licht fungieren.
Quellen:
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- engl. Wikipedia, Artikel "sodium channel".
- Wikipedia, Artikel "Porine".
- Luckey, Membrane Structural Biology, 2. Auflage, Cambridge University Press 2014.