Was ist überhaupt ein Atommodell?
Aus der Stufe 7 kennt ihr sicherlich noch das Atommodell von Dalton. Wir wollen es hier einmal kurz rekapitulieren (wiederholen).
Das DALTONsche Atommodell
- Atome bestehen aus kleinen, massiven, unteilbaren Kugeln.
- Jedes Element besteht aus einer eigenen Atomsorte. Es gibt also genau soviele Atomsorten, wie es Elemente gibt.
- Jede Atomsorte hat einen bestimmten Radius und eine bestimmte Masse.
- Chemische Reaktionen sind Teilchengruppierungen. Bei einer Reaktion gruppieren sich die Atome der Ausgangsstoffe lediglich um. Weder werden Atome vernichtet, noch entstehen neue.
- Bei chemischen Reaktionen verbinden sich die Atome verschiedener Elemente in bestimmten konstanten Zahlenverhältnissen.
Leistungsfähigkeit des Dalton-Modells
An den meisten Schulen führt man das Atommodell von Dalton im Chemieunterricht der Klasse 7 ein. Ich selbst verwende dazu immer den Versuch zur Volumenreduktion.
Versuch: Volumenreduktion
Material:
2 möglichst genaue 100 ml-Messzylinder, dest. Wasser, Ethanol
Durchführung:
Der eine Messzylinder wird sorgfältig mit genau 50 ml dest. Wasser gefüllt, der andere Messzylinder mit genau 50 ml Ethanol (möglichst hochkonzentriert!).
Dann wird der Inhalt des einen Messzylinders vorsichtig in den anderen Messzylinder gegossen. Dabei dürfen keine Verluste auftreten, der erste Messzylinder muss komplett entleert werden.
Beobachtung:
Das Stoffgemisch hat nach dem Zusammengießen der beiden Flüssigkeiten ein Volumen von ca. 98 ml und nicht - wie erwartet - von 100 ml.
Deutung:
Wasser und Ethanol bestehen aus unteschiedlich großen kleinsten Teilchen, wobei die Ethanol-Teilchen größer sind als die Wasser-Teilchen. Die Wasser-Teilchen "rutschen" beim Zusammengießen in die Lücken zwischen den großen Ethanol-Teilchen.
Meistens wird dieser Versuch dann mit Hilfe von Erbsen und Senfkörnern verdeutlicht: Ein Messzylinder mit 50 ml Erbsen und ein Messzylinder mit 50 ml Senfkörnern werden zusammengemischt, das Volumen der Mischung ist dann deutlich kleiner als 100 ml.
Kritisch könnte man hier einwenden, dass sowohl Wasser wie auch Ethanol Verbindungen sind und daher nicht aus Atomen bestehen, sondern aus Molekülen, und dass Moleküle meistens nicht kugelförmig sind, sondern eine andere Form haben. Dieser Einwand ist völlig korrekt, tut der Sache aber trotzdem keinen Abbruch, wenn man nicht von "Atomen" spricht, sondern von "kleinsten Teilchen".
In den meisten Schulbüchern wird das Atommodell von Dalton auch gern benutzt, um die drei Aggregatzustände zu erklären:
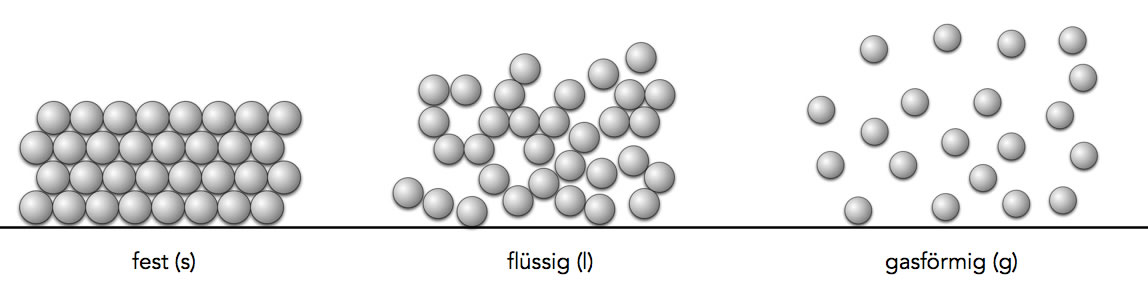
Die drei Aggregatzustände fest, flüssig und gasförmig
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Warum sich die Atome des Elementes im festen Zustand so stark gegenseitig anziehen, kann das Modell noch nicht erklären. Interessant ist aber, dass die Chemiker schon sehr früh, also ungefähr zu Daltons Zeiten, annahmen, dass hier elektrische Kräfte im Spiel sind.
Es gab allerdings auch schon zu Daltons Zeiten Probleme mit seinem Modell, teils wurde es von seinen Chemiker-Kollegen heftig kritisiert, als "schwammige Hypothese" abgetan.
Wer mehr über das Atommodell von Dalton und seine Kritiker wissen möchte, geht auf die entsprechende Seite in meinem Chemie-Lexikon.
Mit Hilfe des Atommodells von Dalton kann man auch die drei wichtigen chemischen Gesetze erklären, nämlich das Gesetz von der Erhaltung der Masse, das Gesetz der konstanten Proportionen und das Gesetz der multiplen Proportionen.
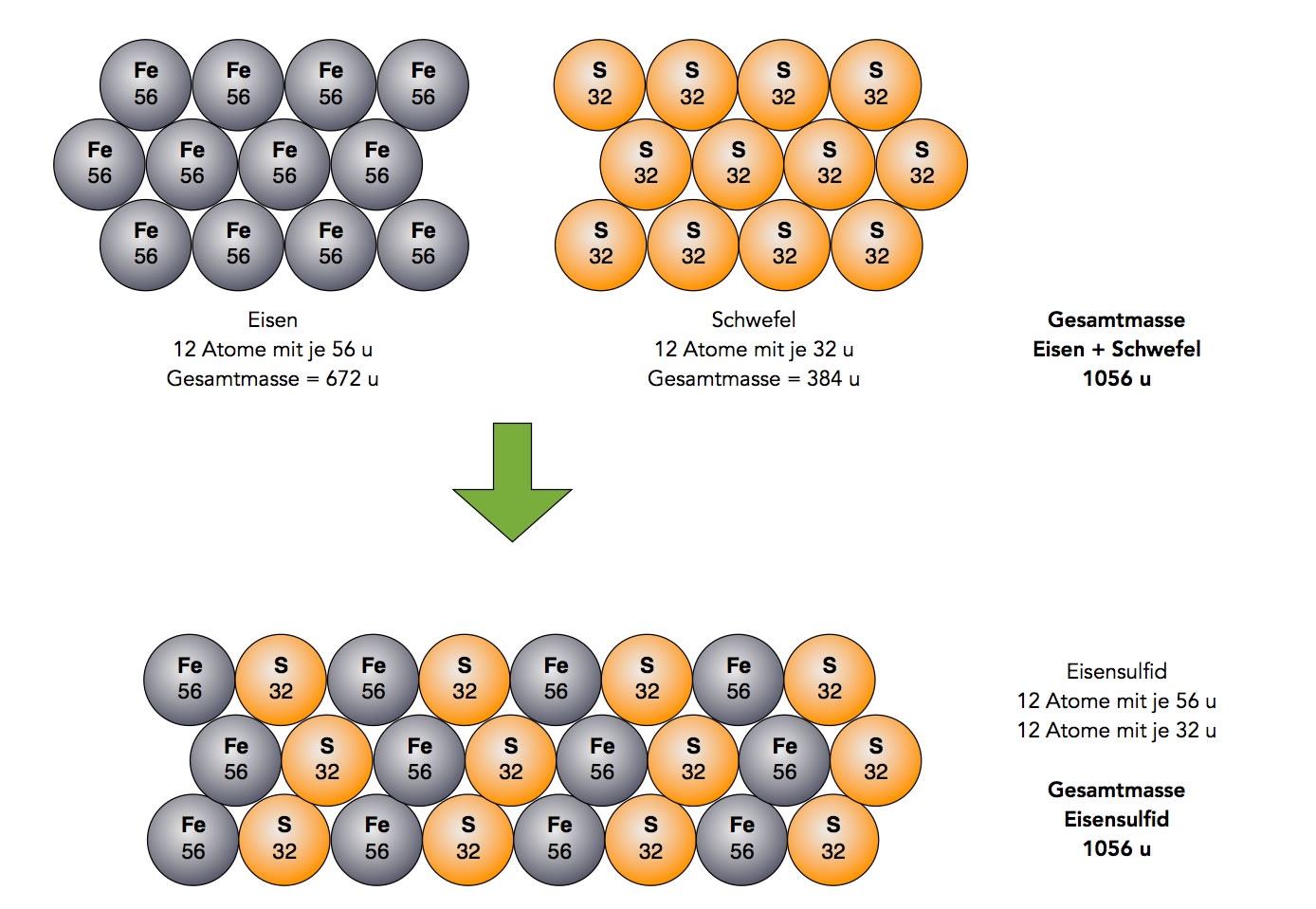
Gesetz von der Erhaltung der Masse
Das Gesetz von der Erhaltung der Masse
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Da Atome nach Dalton weder vernichtet werden noch neu entstehen können, ändert sich die Zahl der Atome bei einer chemischen Reaktion nicht, die vorhandenen Atome lagern sich lediglich um, wie man auf der Abbildung oben gut erkennen kann. 12 Eisen-Atome mit einer Gesamtmasse von 672 u reagieren mit 12 Schwefel-Atomen (Gesamtmasse = 384 u) zu Eisensulfid mit einer Gesamtmasse von 1056 u. Das entspricht genau der Gesamtmasse aus Eisen- und Schwefel-Atomen vor der Reaktion.
Gesetz der konstanten Proportionen
Dieses Gesetz - das übrigens schon vor Dalton bekannt war - besagt, dass sich die Stoffe bei chemischen Reaktionen immer in bestimmten konstanten Verhältnissen verbinden. Eisen und Schwefel verbinden sich bei der Bildung von Eisensulfid zum Beispiel immer im Verhältnis 7 : 4. Man muss also 7g Eisen und 4g Schwefel im Reagenzglas zusammen erhitzen, um einen optimalen Reaktionsablauf zu bekommen, bei dem weder Eisen noch Schwefel übrig bleiben.
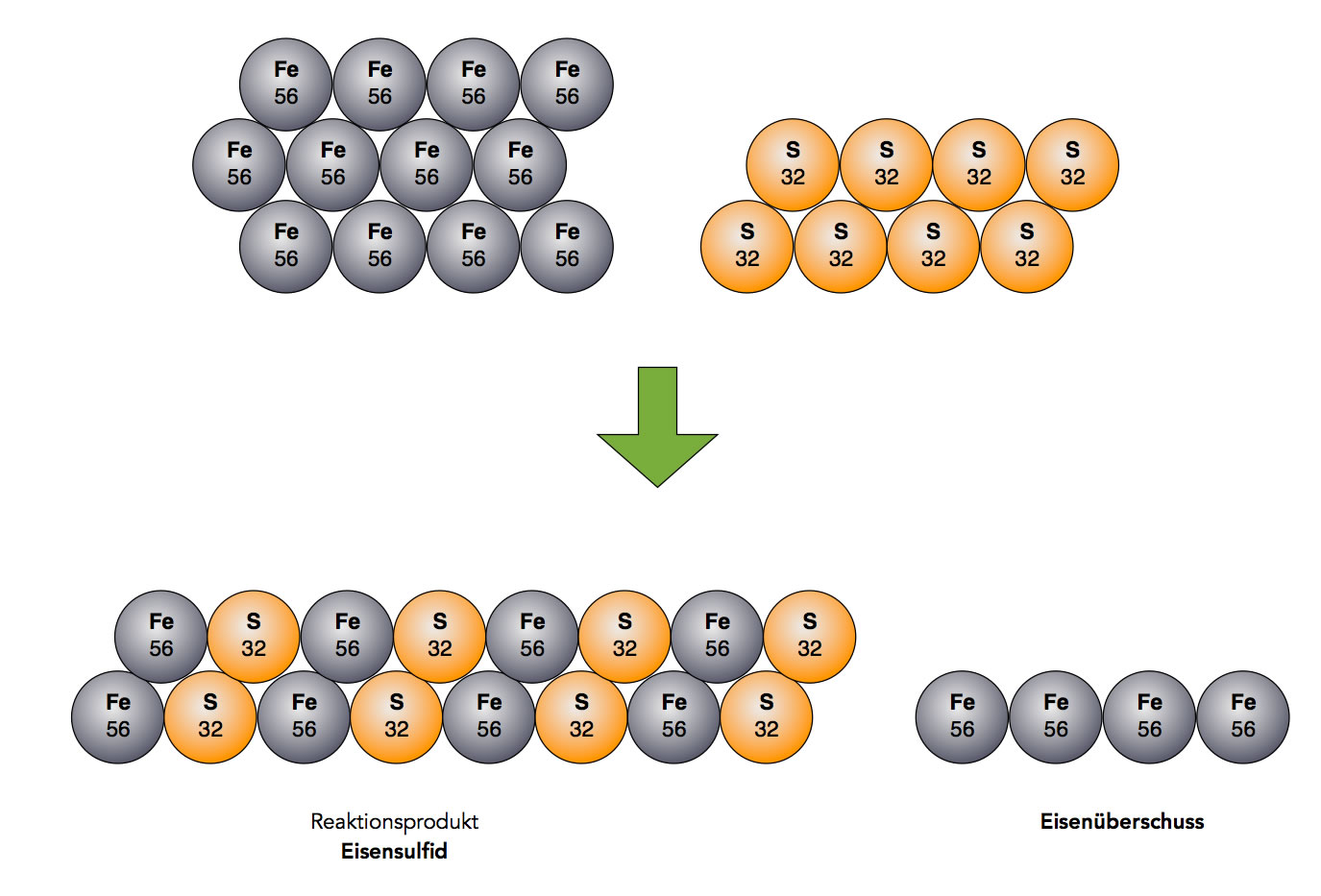
Gesetz der konstanten Proportionen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Die Abbildung zeigt, was geschieht, wenn man Eisen und Schwefel nicht im richtigen Verhältnis zusammen erhitzt. Es bildet sich zwar Eisensulfid, die Ausbeute ist aber nicht optimal. Nicht jedes Eisen-Atom kann sich mit einem Schwefel-Atom verbinden, Eisen-Atome bleiben übrig.
Gesetz der multiplen Proportionen
Manche Elemente können mehrere verschiedene Verbindungen bilden. Kohlenstoff beispielsweise kann sich mit Sauerstoff zu Kohlenmonoxid CO und Kohlendioxid CO2 verbinden. Aber auch hier gilt für jede der möglichen Verbindungen das Gesetz der konstanten Proportionen. Bei der Bildung von CO treten immer 3 Massenanteile Kohlenstoff mit 4 Massenanteilen Sauerstoff zu 7 Massenanteilen Kohlenmonoxid zusammen (die Atommassen betragen 12 bzw. 16 für Kohlenstoff bzw. Sauerstoff). Bei der Bildung von CO2 dagegen treten stets 3 Massenanteile Kohlenstoff mit 8 Massenanteilen Sauerstoff zusammen. Diese Massenanteile werden aber immer durch ganze Zahlen wiedergegeben, auch wenn zwei Elemente zu zwei oder mehr verschiedenen Verbindungen reagieren können.
Dalton konnte das Gesetz der multiplen Proportionen mit seiner Atomtheorie gut erklären. Bei der Bildung von Kohlenmonoxid reagiert stets ein Kohlenstoff-Atom mit einem Sauerstoff-Atom zu einem Kohlenmonoxid-Molekül. Kohlenstoff hat eine Atommasse von 12, Sauerstoff eine von 16. Daraus ergibt sich ein Massenverhältnis von 12:16 bzw. von 3:4, wenn man entsprechend kürzt. Bei der Bildung von Kohlendioxid reagiert jedes Kohlenstoff-Atom mit zwei Sauerstoff-Atomen, die Verhältnisformel von Kohlendioxid ist also 1:2. Multipliziert man diese Atomzahlverhältnisse mit den Atommassen, ergibt sich ein Massenverhältnis von 12 : 32, oder gekürzt 3 : 8.