für Experten:
Mathematisch Begabte fangen jetzt vielleicht an zu rechnen. Ionisierungsenergie von Wasserstoff: ca. 13 Einheiten; Ionisierungsenergie von Lithium ca. 5 Einheiten. Ladung von Wasserstoff = 1, Ladung von Lithium = 3.
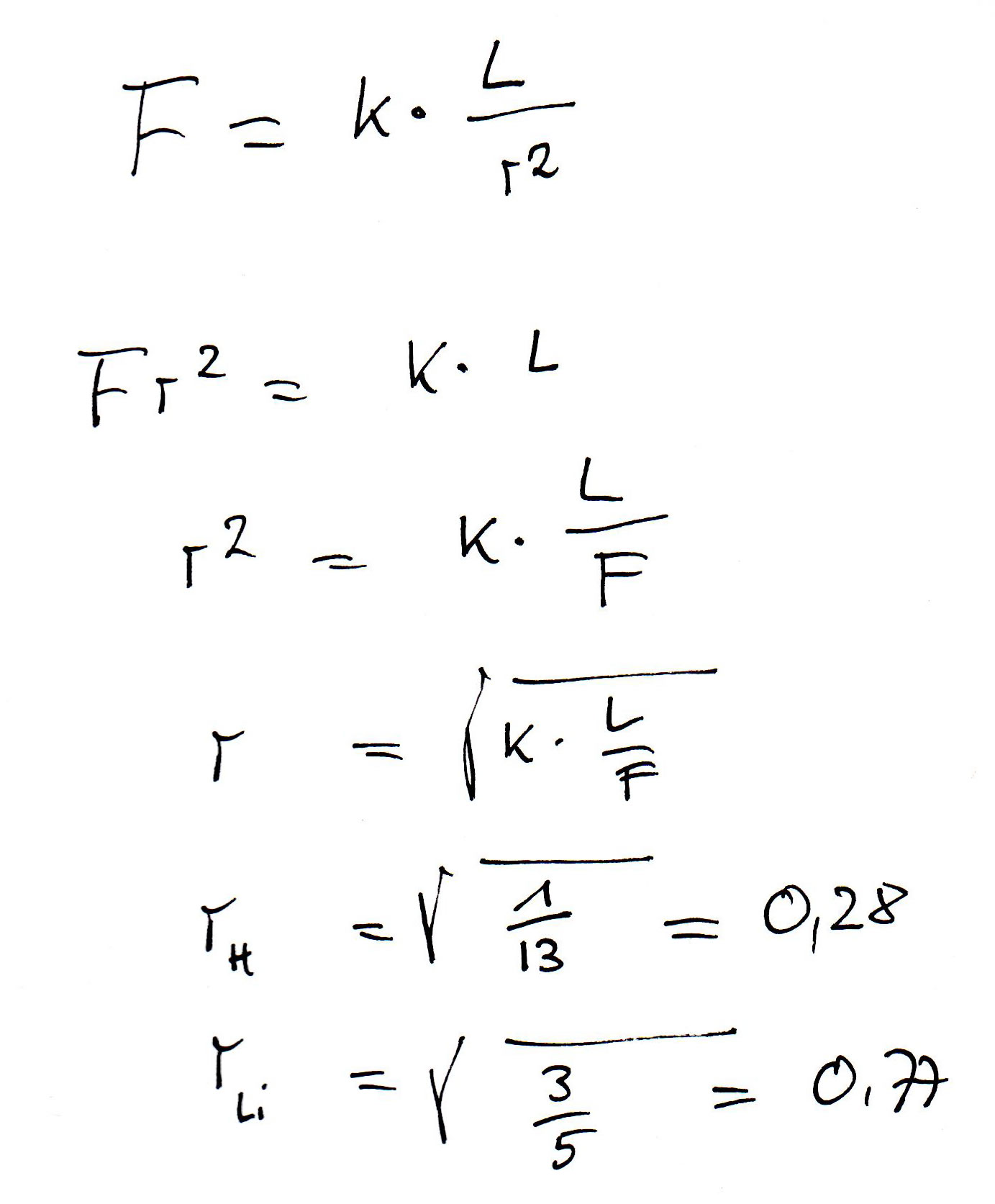
Die Berechnung eines begabten Schülers
Dieser begabte Schüler, dessen Schmierzettel hier gezeigt wird, hat zunächst die Coulomb-Formel nach $r$ aufgelöst. Dann hat er die Konstante k einfach auf 1 gesetzt und schließlich die Werte für Wasserstoff und Lithium eingesetzt. Mit den berechneten Werten 0,28 für Wasserstoff und 0,77 für Lithium kann man so direkt noch nichts anfangen, aber sie zeigen uns ungefähr, in welchem Verhältnis die Abstände stehen müssten, nämlich ungefähr 1 : 2,8. Das Elektron des Li-Atoms, das bei der Ionisierung entfernt wird, sollte also ca. 2,8 mal so weit vom Atomkern entfernt sein wie das Elektron des H-Atoms.
Das müssen wir doch gleich mal nachschlagen. Stichwort: Atomradien. Auf der Seite www.frustfrei-lernen.de findet man eine schöne Tabelle mit Atomradien. Danach hat das H-Atom einen Radius um 31 pm (Picometer = 1/1.000 Nanometer = 1/1.000.000 Mikrometer = 1/1.000.000.000 Millimeter), und das Li-Atom einen Radius um 128 pm. Diese Zahlen verhalten sich ungefähr wie 1 : 4. Das ist also noch extremer, als unser begabter Schüler ausgerechnet hat.
Auf der Seite www.uniterra.de findet sich übrigens eine sehr schöne Tabelle mit den Ersten Ionisierungsenergien der Elemente.