Die Zitronenbatterie
Bitte lies dir die Versuchsdurchführung sowie die Beobachtungen zu diesem Versuch aufmerksam durch.
Erklärung der Versuchsergebnisse
Wie kommt die kleine Spannung von 0,5 Volt oder etwas mehr zustande, wenn man eine Kupfer- und eine Zink-Elektrode in eine Zitrone sticht und mit einem Voltmeter verbindet?
Hier zunächst eine einfache Erklärung
Das Zink ist das unedlere Metall, hat also eine Neigung, Elektronen abzugeben, damit die Atome die Edelgaskonfiguration erlangen:
$Zn(s) \to Zn^{2+}(aq) + 2 \ e^{-}$
Das Kupfer ist das edlere Metall, es hat also die Neigung, Elektronen aufzunehmen.
$Cu^{2+}(aq) + 2 \ e^{-} \to Cu(s)$
Die Elektronen fließen also vom Zink zum Kupfer, und zwar durch den elektrisch leitenden Zitronensaft.
Ein kleines Problem
Wer von euch jetzt richtig aufgepasst hat, sieht hier jedoch ein kleines Problem. Das Kupfer liegt in der Zitronenbatterie bereits als Kupfer-Metall Cu(s) vor, nicht aber in Form von Kupfer-Ionen Cu2+(aq). Wie soll da die zweite Reaktion ablaufen, wenn das Kupfer bereits in der reduzierten metallischen Form vorliegt?
Wir brauchen also eine bessere Erklärung. Und um dieser besseren Erklärung "auf die Sprünge" zu helfen, betrachten wir erst einmal einen zweiten Versuch, der noch einfacher aufgebaut ist als die Zitronenbatterie, aber dafür jede Menge neuer Erkenntnisse liefert.
Die Wasserbatterie
Bitte lies dir auch diese Versuchsdurchführung sowie die Beobachtungen zu diesem Versuch aufmerksam durch.
Erklärung der Versuchsergebnisse
Wieso kann man eine Spannung von ca. 0,8 Volt messen, wenn man einfach einen Kupferstab und einen Zinkstab in Leitungswasser stellt und diese beiden Elektroden über ein Voltmeter verbindet? Der Versuch funktioniert sogar mit dest. Wasser!
Bitte fest anschnallen!
Die Erklärung dieses einfachen Versuchs ist nicht ganz so einfach, aber ich werde mich bemühen, alles logisch und kleinschrittig zu erklären, so dass alle von euch die Vorgänge verstehen, die bei diesem Versuch ablaufen.
Zucker in Wasser
Hast du schon einmal einen Teelöffel Zucker in eine Tasse mit heißem Tee gegeben und dich gewundert, warum sich der Zucker auflöst?
Es gibt da so einen Faktor in der Natur, der als Entropie bezeichnet wird. Unter diesem Begriff versteht man so etwas wie Unordnung. Dieses Phänomen kennst du sicherlich aus deinem Zimmer oder von deinem Schreibtisch, wenn du einen hast. Nach dem Aufräumen sieht alles ganz ordentlich aus, in den nächsten Tagen jedoch ist wieder der "normale" Zustand erreicht, in dem alles ganz unordentlich aussieht und alle Teile durcheinander liegen. Ein Physiker würde jetzt sagen: "Die Entropie in deinem Zimmer / auf deinem Schreibtisch hat stark zugenommen".
Bei vielen natürlich ablaufenden Prozessen nimmt die Entropie zu. Wenn du am Strand eine interessante Figur aus Sand gebaut hast und der Wind am nächsten Morgen alles wegfegt, wenn Blätter von den Bäumen fallen und von Mikroorganismen zersetzt werden, wenn Luft aus einem Reifen entweicht, wenn sich ein heißer Stein abkühlt und so weiter, bei all diesen Prozessen nimmt die Entropie zu. So ist das eben in der Natur.
Auch wenn sich fester Zucker in heißem Tee auflöst, ist das mit einer Entropiezunahme verbunden. Im festen Zucker liegen die Zucker-Moleküle in hochgeordneten Kristallen vor, und beim Auflösen geht diese hohe Ordnung verloren. Die Zucker-Moleküle bewegen sich im Tee wild hin und her, in alle möglichen Richtungen, völlig unordentlich.
Kommen wir nun zum Zink
Auch eine Zinkstange stellt einen Zustand hoher Ordnung und geringer Entropie dar. Die Zink-Atome würden sich auch gern "wild" in alle Richtungen bewegen, können das aber normalerweise nicht, weil sie ja ein festes Metallgitter bilden.
Stellt man eine Zinkstange jedoch in Wasser, dann schaffen es einige wenige Zink-Atome, sich aus dem festen Verband zu lösen und in das Wasser überzugehen. Allerdings müssen sie für diese "Freiheit" einen kleinen Preis zahlen: Die müssen nämlich die beiden Außenelektronen abgeben.
$Zn(s) \to Zn^{2+}(aq) + 2 \ e^{-}$
Dann läuft wieder diese Reaktion ab. Nur als Zink-Ionen können sich die Zink-Teilchen im Wasser lösen, Zink-Atome können das nicht. Unterstützt wird dieser Vorgang durch die Bildung von Hydrathüllen. Zink-Ionen sind positiv geladen, und Wasser-Moleküle haben am Sauerstoff-Atom einen negativen Pol. Also versammeln sich viele Wasser-Moleküle um die frisch gebackenen Zink-Ionen und umhüllen diese.
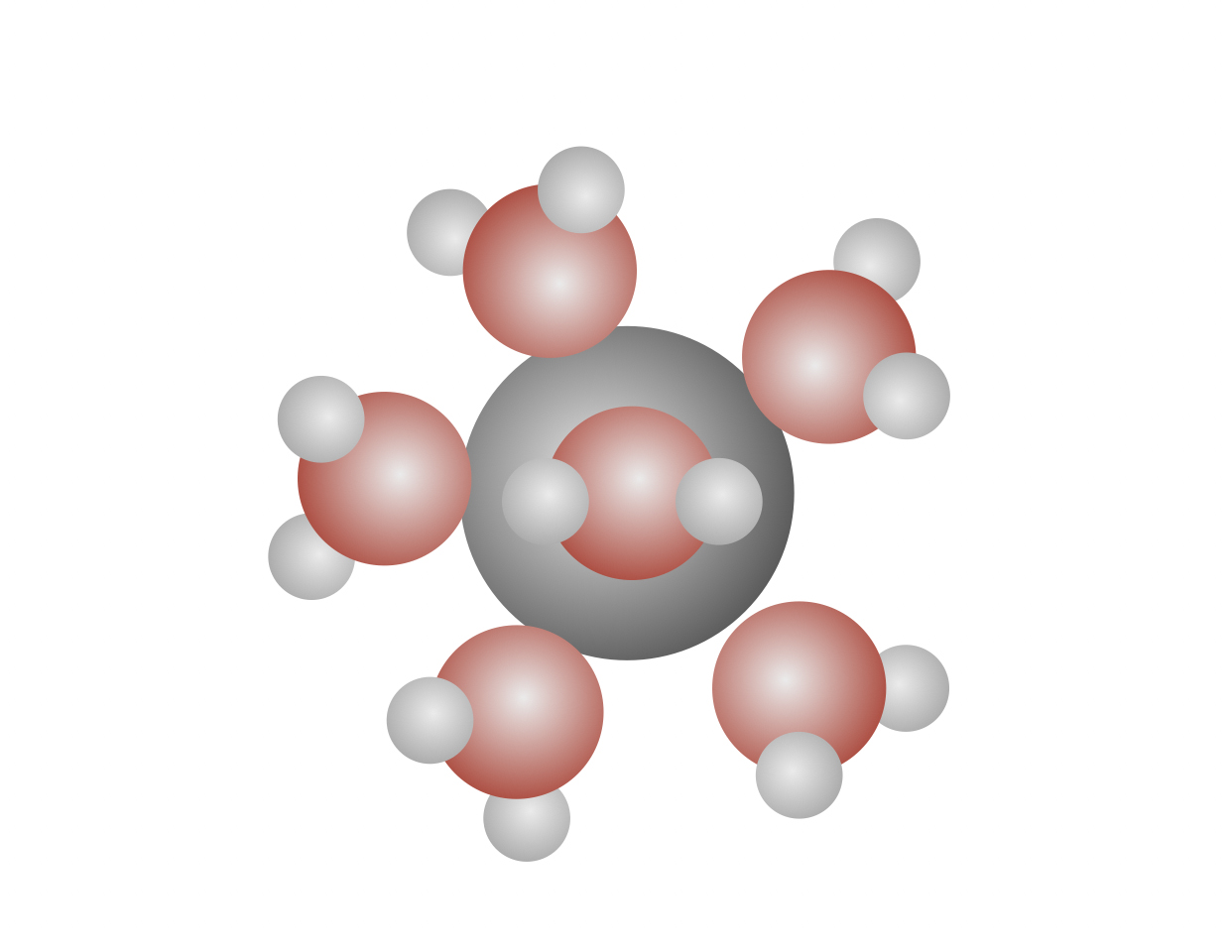
Wasser-Moleküle bilden eine Hydrathülle um ein Zn2+-Ion
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese Vorgang, der als Hydratisierung bezeichnet wird, ist recht exotherm und fördert somit das Ablösen von Zink-Atomen aus dem festen Verband und das Lösen der Zink-Ionen im Wasser.
Die Elektronen der Zink-Außenhüllen bleiben in der Zink-Elektrode zurück und laden diese negativ auf. Wenn sich 20 Zink-Atome als Zn2+(aq) im Wasser gelöst haben, befinden sich 40 Elektronen in der Zink-Elektrode. Haben sich 100 Zink-Atome gelöst, sind schon 200 Elektronen in der Elektrode (aufpassen mit diesen beiden Begriffen, die werden leicht verwechselt).
Aber warum löst sich eine Zinkstange nicht komplett auf, wenn man sie in Wasser stellt?
Wie du aus dem Physikunterricht sicherlich weist, ziehen sich positive und negative Ladungen an. Die Zink-Ionen im Wasser sind positiv geladen, die Zinkstange jedoch negativ, denn die Elektronen der Zink-Atome bleiben ja in der Zinkstange zurück und laden diese negativ auf.
Je mehr Zink-Atome es geschafft haben, sich als Zn2+(aq) im Wasser zu lösen, desto negativer wird die Zinkstange. Und das hat Folgen! Je negativer die Zinkstange nämlich ist, desto schwieriger wird es für die Zink-Ionen, sich von der Zinkstange zu lösen. Im Gegenteil, sie nehmen sogar wieder zwei Elektronen auf und verwandeln sich zurück in Zink-Atome Zn(s).
Diesen Vorgang kann man so formulieren:
$Zn^{2+}(aq) + 2 \ e^{-} \to Zn(s)$
Das ist quasi die Rückreaktion zum Auflösen des Zinks, chemisch betrachtet eine Reduktion, da Elektronen aufgenommen werden. Insgesamt läuft also folgende Reaktion ab:
$Zn(s) \rightleftharpoons Zn^{2+}(aq) + 2 \ e^{-}$
Am Anfang, wenn man die Zinkstange in das Wasser gestellt hat, überwiegt die Hinreaktion. Je negativer die Zinkstange allerdings wird, desto langsamer läuft diese Hinreaktion ab, und um so mehr kommt die Rückreaktion in Gang.
Wenn die Negativladung der Zinkstand einen bestimmten Wert erreicht hat, laufen beide Reaktionen mit der gleichen Geschwindigkeit ab, und es ist eine Art Gleichgewichtszustand erreicht. Es lösen sich zwar noch einige Zink-Atome als Zn2+(aq) im Wasser, aber genau so viele Zink-Ionen werden in der gleichen Zeit wieder zu Zink-Atomen. Die Zinkstange verändert sich jetzt nicht mehr. Das ist der Grund, warum sich Zink nicht komplett im Wasser auflöst.
Jetzt kommen wir zum Kupfer
Bei der Kupferelektrode laufen im Prinzip die gleichen Vorgänge ab:
$Cu(s) \rightleftharpoons Cu^{2+}(aq) + 2 \ e^{-}$
Allerdings ist das Kupfer edler als das Zink. Die Kupfer-Atome geben nicht so gern ihre Elektronen an die Kupferstange ab, und daher lösen sich auch nicht so viele Kupfer-Atome als Cu 2+(aq) im Wasser. Die Kupferstange lädt sich zwar auch negativ auf, genau wie die Zinkstange, aber die Negativladung ist im Gleichgewichtszustand wesentlich geringer als bei der Zinkstange.
Jetzt können wir die Spannung erklären
Auf der einen Seite haben wir also eine recht stark negativ geladene Zinkstange, auf der anderen Seite eine deutlich weniger negativ geladene Kupferstange. Es liegt also eine Ladungsdifferenz vor - die Zinkelektrode ist negativer geladen als die Kupferelektrode. Für eine solche Ladungsdifferenz haben sich die Physiker ein Wort ausgedacht, das man sich gut merken kann: "Elektrische Spannung" oder kurz "Spannung". Gemessen wird diese Spannung bekanntlich in Volt oder Millivolt.
Und zurück zur Zitronenbatterie
In der Zitronenbatterie laufen im Wesentlichen die gleichen Vorgänge ab wie in der Wasserbatterie, auch hier ist die Zinkelektrode stärker negativ geladen als die Kupferelektrode, so dass eine elektrische Spannung vorliegt, die vom Voltmeter angezeigt wird. Schließt man einen Elektromotor an, dann fließen die Elektronen von der Zinkstange durch den Motor in die Kupferstange und treiben dabei den Motor an.
Da die Zinkelektrode auf diese Weise Elektronen verliert, können sich jetzt neue Zink-Atome im Wasser bzw. im Zitronensaft lösen. Deren Elektronen verbleiben wieder zunächst in der Zink-Elektrode, fließen dann aber wieder durch den Motor zur Kupfer-Elektrode, so dass sich noch mehr Zink-Atome als Zn 2+(aq) im Wasser lösen können. Unter diesen Umständen kann sich die Zinkelektrode tatsächlich komplett im Wasser lösen, während die Kupferstange völlig unverändert bleibt.
Opferanoden
Wenn du diese ganzen Erklärungen verstanden hast, hast du soeben auch das Prinzip der Opferanode verstanden. Opferanoden finden in der Technik, beim Verlegen von Rohrleitungen, beim Brückenbau und so weiter Anwendung. Metalle wie Eisen und Stahl verrosten ja leicht, wenn sie Wind und Wetter ausgesetzt sind. Dabei laufen folgende Vorgänge ab:
$Fe(s) \to Fe^{2+}(aq) + 2 \ e^{-}$
$Fe^{2+}(aq) \to Fe^{3+}(aq) + e^{-}$
Es entstehen also Eisen(II)- und Eisen(III)-Ionen.
Wie kann man dieses Rosten verhindern oder zumindest ausbremsen? Indem man das Eisen- oder Stahlrohr oder -gerüst mit einer Opferanode verbindet. Diese muss aus einem unedleren Metall wie Zink oder Magnesium bestehen. Verbindet man die Opferanode elektrisch leitend mit dem zu schützenden Metallgegenstand, dann löst sich die Opferanode langsam auf. Die Elektronen verbleiben aber in der Opferanode und fließen dann zum Eisen oder Stahl, genau wie in der Zitronenbatterie. Die Opferanode löst sich im Laufe der Monate oder Jahre langsam auf, sie opfert sich also auf, während das Eisen oder der Stahl über diese Zeit unverändert bleiben.
Auf dieser Wikipedia-Seite findest du weitere Informationen zu Opferanoden.
Galvanische Zellen
Der italienische Arzt Luigi Galvani entdeckte 1780 mehr oder weniger zufällig, dass sich Muskeln zusammenziehen, wenn man sie mit zwei verschiedenen Metallen gleichzeitig berührt. 1790 bereits baute Alessandro Volta, ebenfalls Italiener, seine erste Batterie aus Kupfer- und Zinkplatten, die durch Papier getrennt waren, das mit Kochsalzlösung getränkt war.
Galvani zu Ehren werden solche Vorrichtungen, die aus zwei verschiedenen Metallen bestehen, die in einer (angedickten) Flüssigkeit stehen und Strom liefern, als galvanische Elemente oder galvanische Zellen bezeichnet. Und Volta zu Ehren hat man die physikalische Einheit der Spannung als Volt bezeichnet.