syn- und anti-Additionen
Bei einer elektrophilen Addition an eine C=C-Doppelbindung kann eine Verbindung X-Y auf zwei verschiedene Weisen addiert werden:
- X und Y greifen auf der gleichen Seite der Doppelbindung an: syn-Addition.
- X und Y greifen auf unterschiedlichen Seiten der Doppelbindung an: anti-Addition.
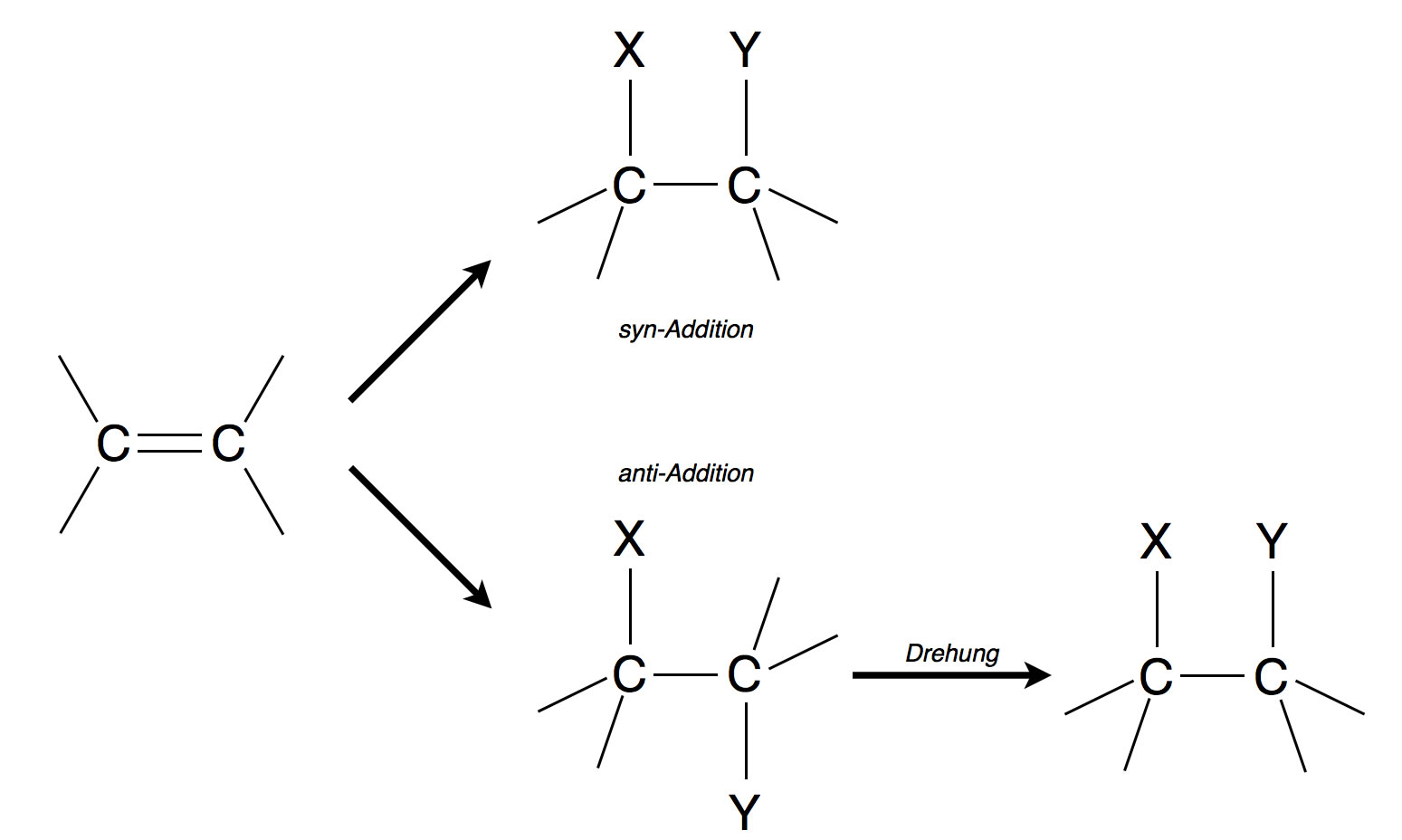
syn- und anti-Addition im Schema
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei symmetrisch aufgebauten Alkenen wie zum Beispiel Ethen oder 2-Buten kann das anti-Produkt durch einfache Drehung um die C-C-Einfachbindung in das syn-Produkt umgewandelt werden. Bei asymmetrischen Alkenen ist das allerdings nicht immer so, wie wir weiter unten noch sehen werden.
Das Musterbeispiel für eine syn-Addition
Eines der wichtigsten und immer wieder erläuterten Beispiele für eine syn-Addition ist die Bromierung eines Alkens über ein Bromonium-Ion:
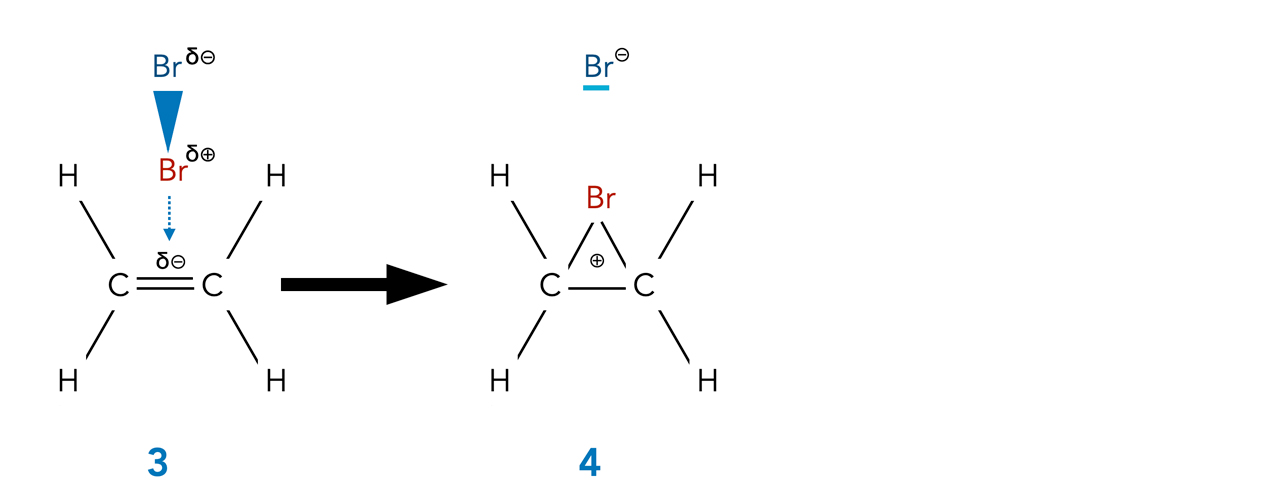
Bildung des Bromonium-Ions
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Bromid-Anion kann - sofern keine gravierende sterische Hinderung vorliegt - nur von der Rückseite her angreifen.
Bei einem symmetrisch aufgebauten Alken wie Ethen hat man keine Chance, nach Ablauf der Reaktion nachzuweisen, dass eine syn-Addition vorlag, weil sich das C-Atom mit dem zuletzt hinzugekommenem Brom-Atom ja leicht um die C-C-Einfachbindung drehen kann.
Bei Cycloalkenen ist dies aber anders. Hier ist die freie Drehbarkeit um C-C-Einfachbindungen durch die Ringbildung eingeschränkt:
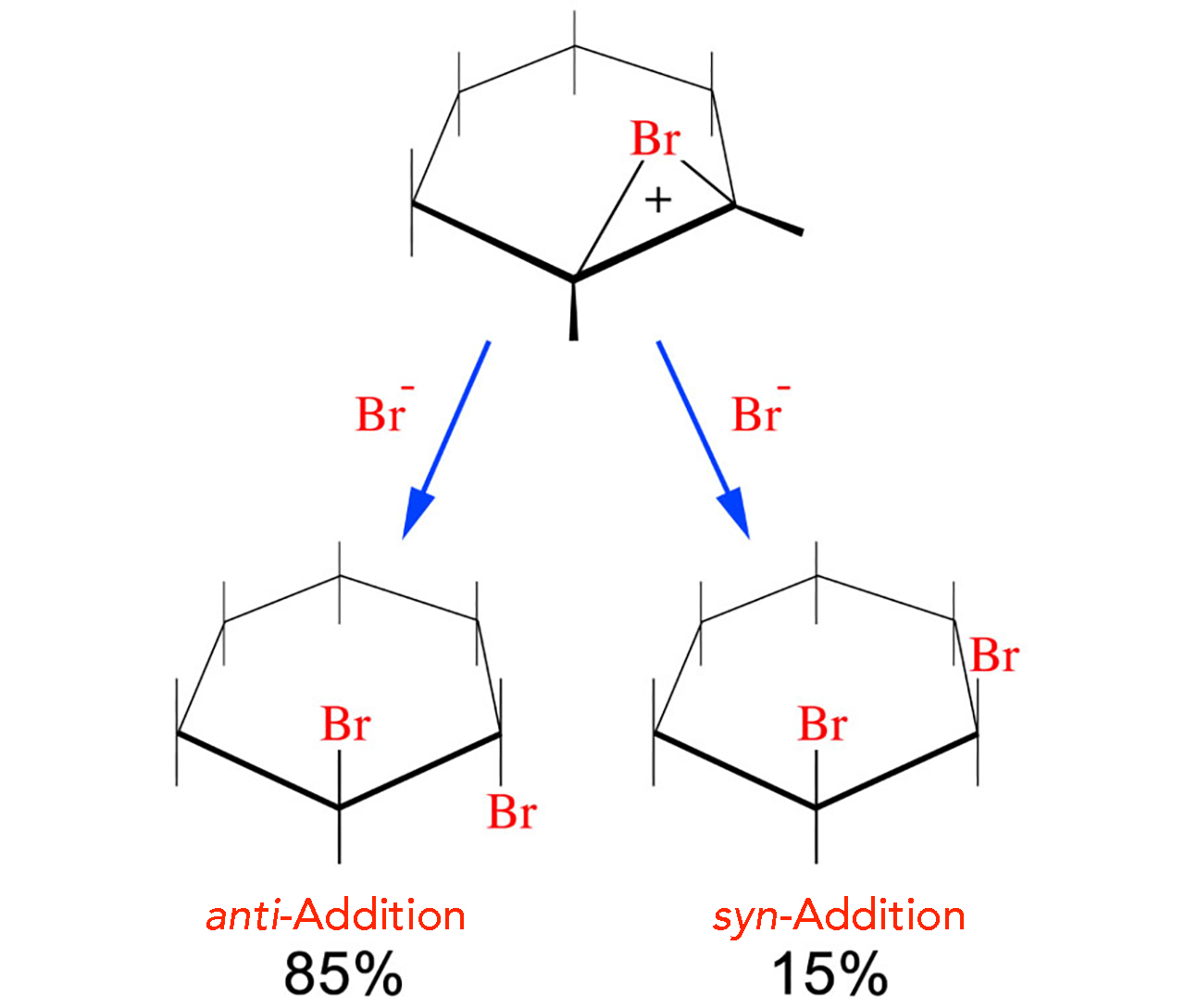
anti-Addition von Brom an Cyclohexen
Autor: Ulrich Helmich 2020, Lizenz: Public domain
Wie man hier gut sehen kann, überwiegt die anti-Addition mit 85% sehr deutlich, gelegentlich kann es aber auch zu einer syn-Addition kommen. Die anti-Addition führt dann zu einem trans-Produkt, die syn-Addition zu einem cis-Produkt.
Das Musterbeispiel einer syn-Addition
Hier könnte man die katalytische Addition von Wasserstoff an die C=C-Doppelbindung erwähnen. Die H-Atome werden auf der Oberfläche des Katalysators gebunden, das Alken nähert sich dieser Oberfläche von oben. Beide H-Atome setzen sich dann quasi von unten an die Doppelbindung.
Stereochemie der syn- und anti-Addition
Weiter oben hatten wir festgestellt, dass man bei symmetrisch aufgebauten Alkenen nicht feststellen kann, ob die Addition eine syn- oder anti-Addition war, wegen der freien Drehbarkeit um die C-C-Einfachbindung. Bei unsymmetrisch aufgebauten Alkenen ist das aber nicht immer so. Schauen wir uns dazu mal ein interessantes Beispiel an, nämlich die Hydrobromierung von 3-Methyl-3-hexen:
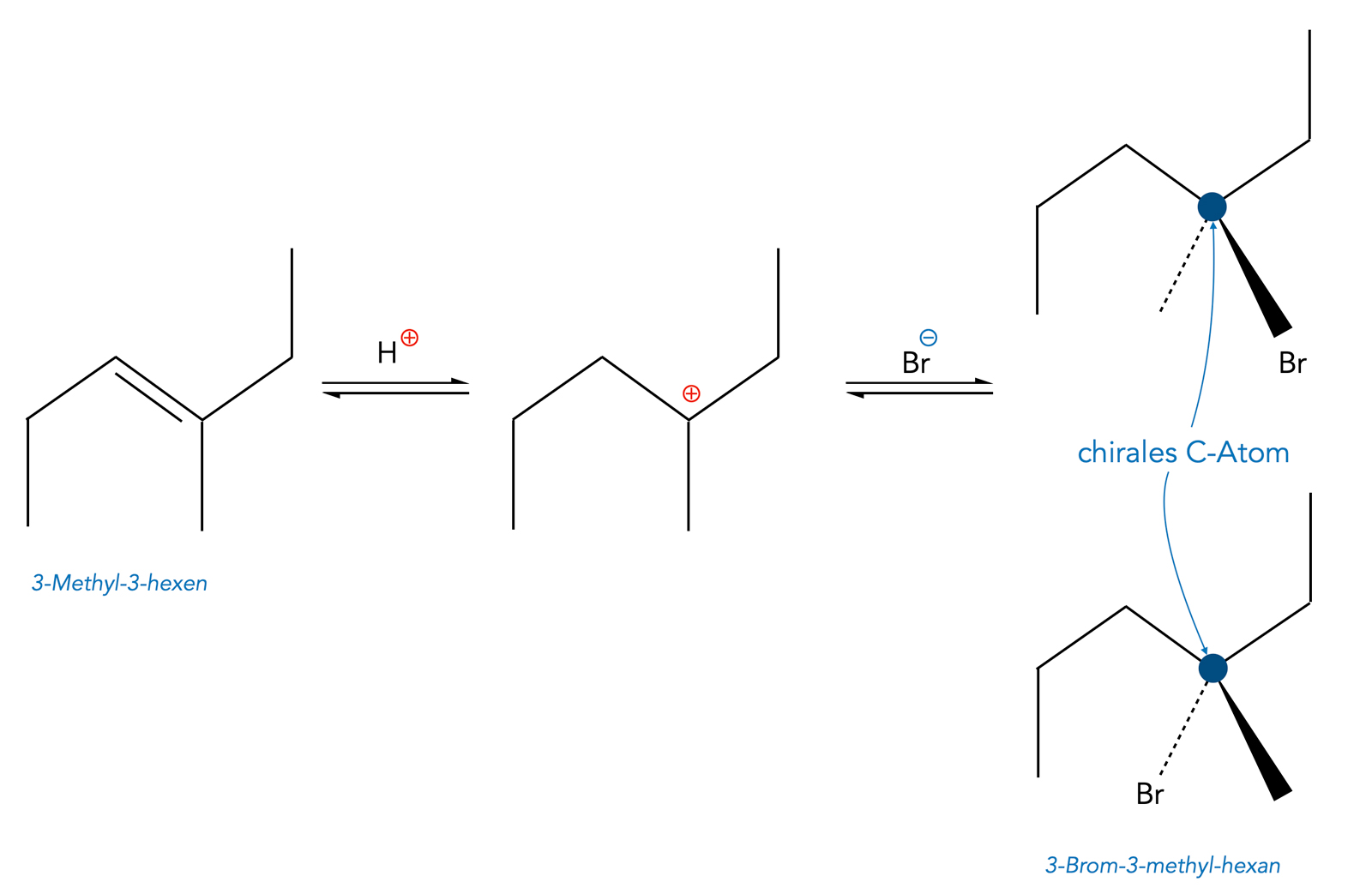
Markownikow-Addition von HBr an 3-Methyl-3-hexen
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Bei der Hydrobromierung, der Hydratisierung etc. muss man bekanntlich zwischen Markownikow-Addition und Anti-Markownikow-Addition unterscheiden. Das im Bild oben dargestellte Beispiel ist eine Markownikow-Addition. Hier entsteht ein tertiäres Carbenium-Ion als Zwischenprodukt. Das Bromid-Anion kann das planare Carbenium-Ion nun von beiden Seiten angreifen (syn-Addition und anti-Addition), es bildet sich 3-Brom-3-methyl-hexan als Endprodukt.
So weit, so gut. Nun wird es aber wirklich interessant. Das gekennzeichnete C-Atom ist nämlich ein chirales Zentrum, da es vier verschiedene Substituenten hat: Propyl-Rest, Ethyl-Rest, Methyl-Rest und Brom-Atom. Also gibt es zwei Enantiomere dieses Produkts (Spiegelbild-Isomere), die sich nicht ineinander überführen lassen.
Wenn Sie sich näher über Enantiomerie (Spiegelbild-Isomerie) informieren wollen, gehen Sie bitte auf diese Seite in meinem Chemie-Lexikon.
Bei der Anti-Markownikow-Addition mit den gleichen Ausgangsstoffen bilden sich ebenfalls zwei Enantiomere, denn auch das andere C-Atom der Doppelbindung wird zu einem chiralen Zentrum mit vier verschiedenen Substituenten:
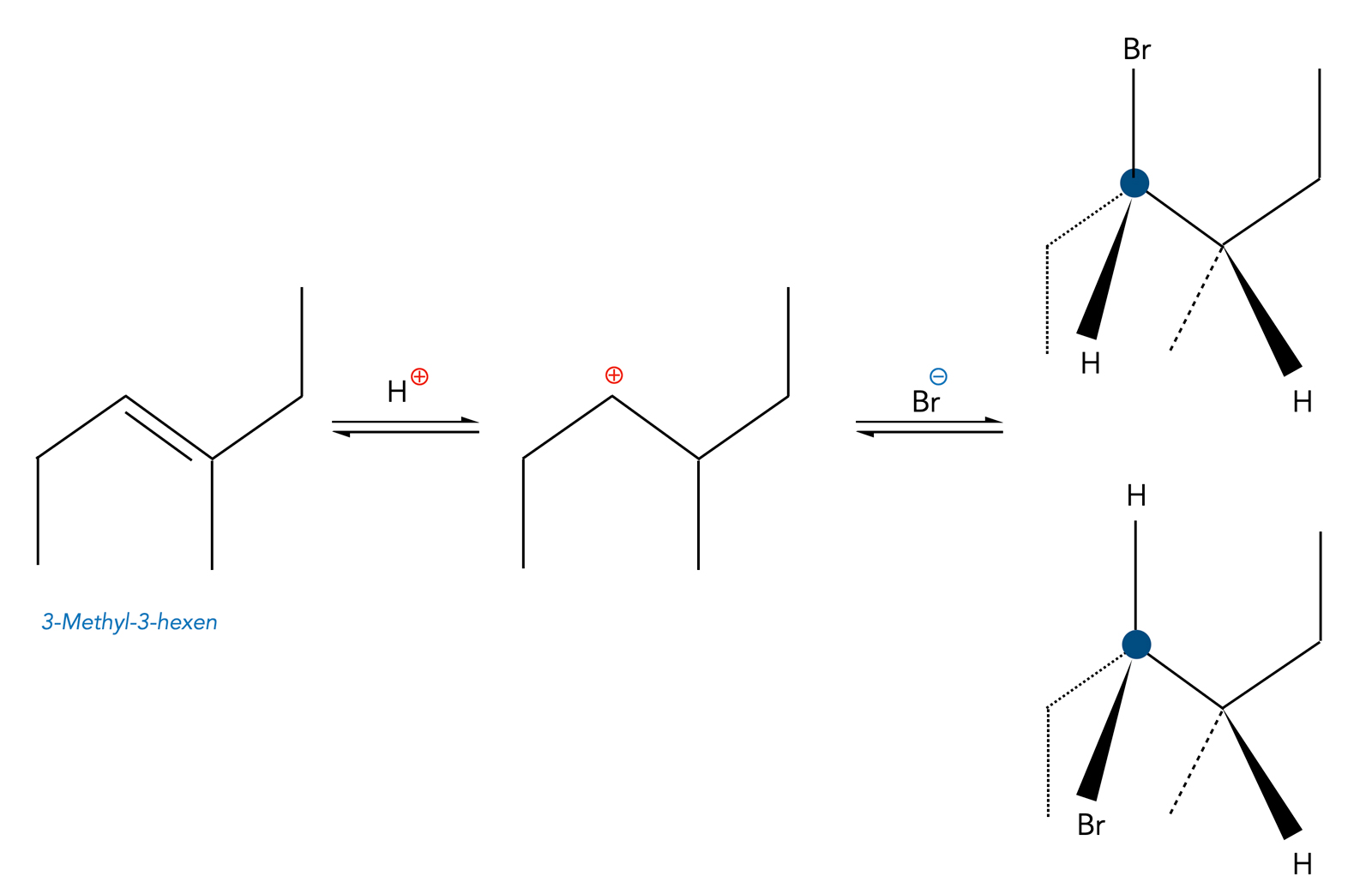
Anti-Markownikow-Addition von HBr an 3-Methyl-3-hexen
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Noch besser kann man sich die Stereochemie der Addition klarmachen, wenn man die Moleküle perspektivisch zeichnet:
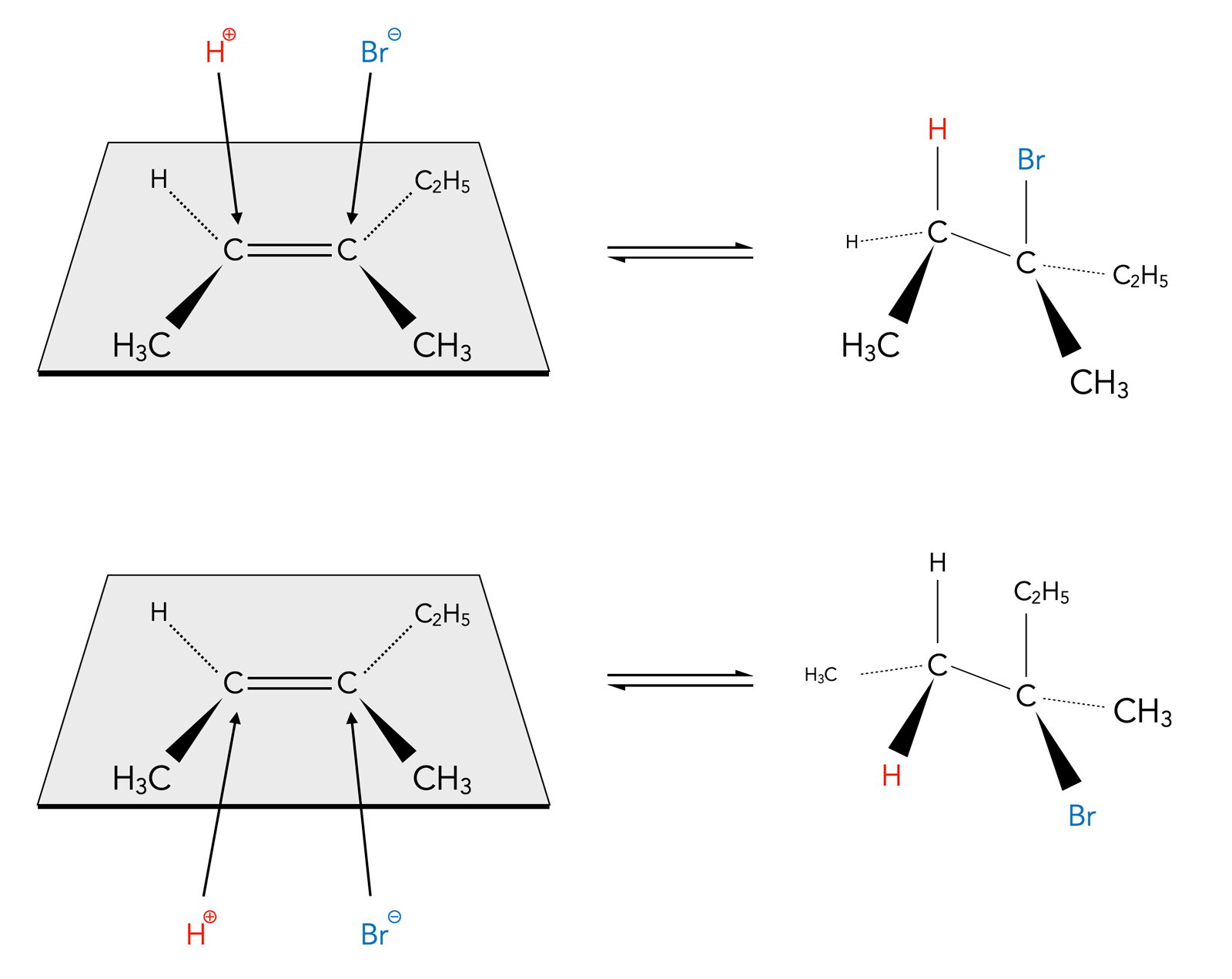
Zwei Produkte einer syn-Addition
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Dieses Beispiel kommt aus [10] und wurde nur etwas schöner gezeichnet. Man sieht hier, dass auch bei einer syn-Addition zwei verschiedene Produkte entstehen können, je nachdem, ob die beiden Edukte die Doppelbindung von "oben" oder von "unten" angreifen. Durch einfaches Drehen um die C-C-Einfachbindung können die beiden Reaktionsprodukte nicht ineinander überführt werden. Um Enantiomere handelt es sich nicht (keine Spiegelbilder!), sondern um Diastereomere (Stereoisomere, die sich nicht wie Bild und Spiegelbild verhalten).
Ein interessantes Beispiel
In der Video-Vorlesung "Organische Chemie 1" von Prof. Dyker von der Ruhr-Universität Bochum wird in der Folge 1.31 bei Zeitindex 37:00 ein interessantes Beispiel vorgestellt, nämlich die Addition von Wasserstoff an die zyklische Verbindung Caren.
Caren ist ein bicyclisches Monoterpen. Es besteht aus einem Cyclohexen-Ring, an den ein Cyclopropan-Ring angekoppelt ist, daher "bicyclisch". Die genaue Strukturformel ist aus der folgenden Abbildung ersichtlich, die ich in Anlehnung an das Tafelbild von Prof. Dyker selbst erstellt habe:
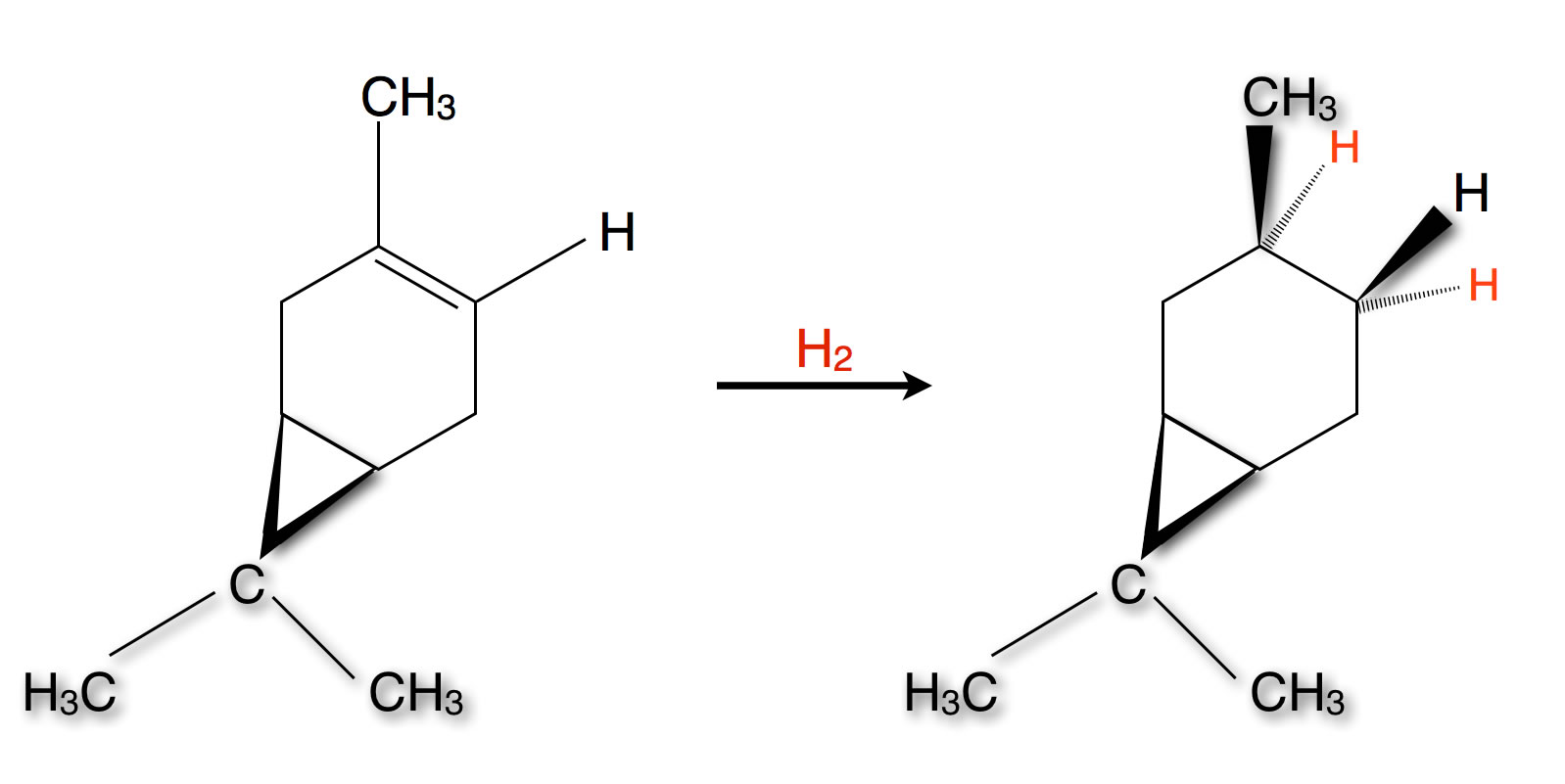
Die syn-Addition von Wasserstoff an die Doppelbindung von Caren
Der Cyclopropan-Ring des Carens (links) ragt nach vorne aus der Zeichenebene heraus. In der Vorlesung wurde nicht gesagt, ob es sich bei der Reaktion um eine katalytische Hydrierung handelt. Wenn das der Fall ist, greift der Wasserstoff die Doppelbindung in einer syn-Addition an.
Schauen Sie sich das Molekül mal näher an. Der Cyclopropan-Ring mit den beiden Methylgruppen ragt aus der Ringebene nach "vorne" heraus. Wenn sich das Molekül nun mit der Katalysator-Oberfläche verbindet, kann es sich nur so auf den Feststoff legen, dass der Cyclopropanring "nach oben" ragt:
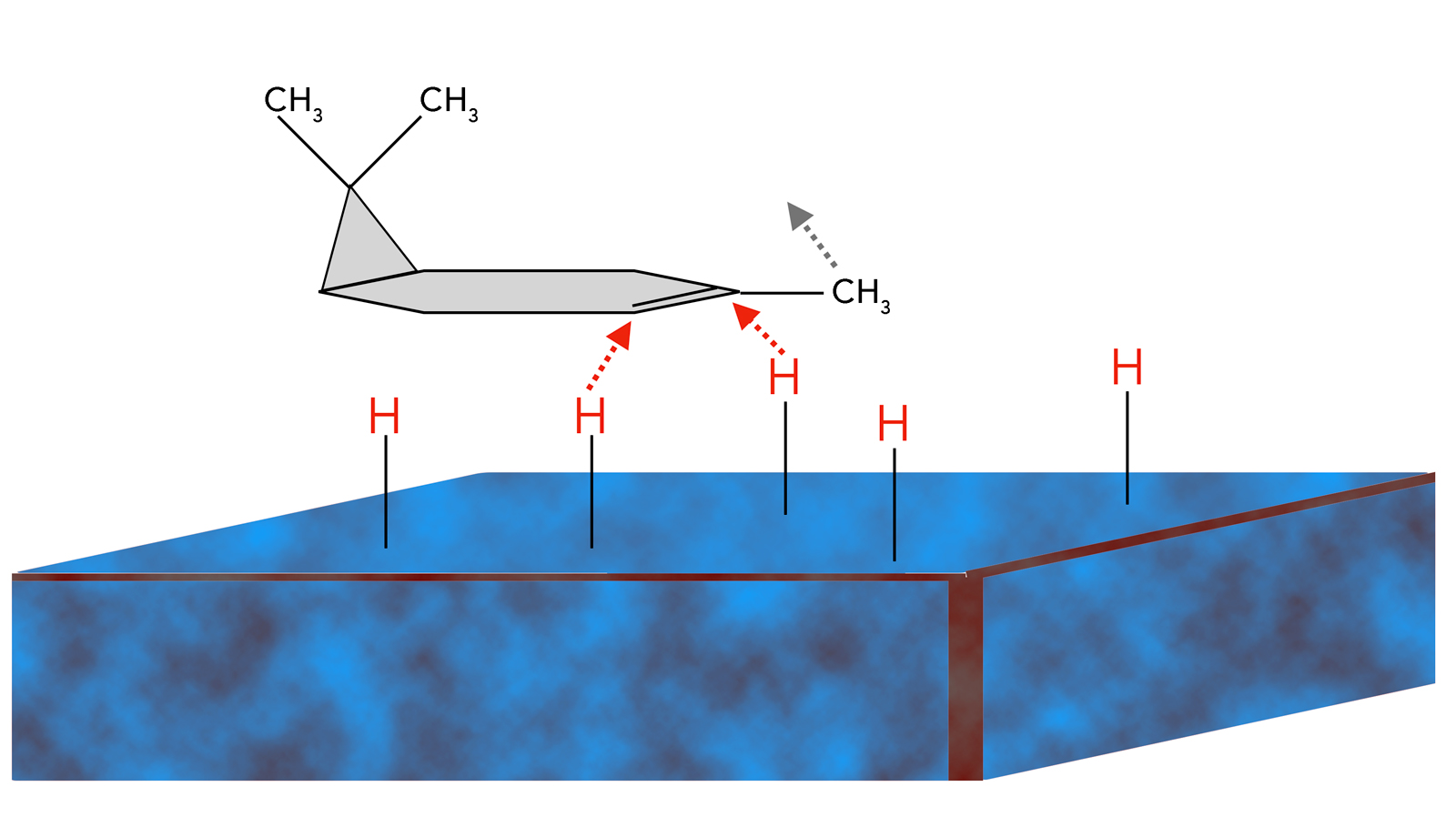
Ein Caren-Molekül nähert sich der Katalysator-Oberfläche
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Die H-Atome greifen die Doppelbindung von unten an. Die Methylgruppe direkt am Cyclohexen-Ring klappt durch die H-Addition nach "oben", wegen der Umhybridisierung des Ring-C-Atoms von sp2 nach sp3.
Das ist allerdings energetisch ungünstig, günstiger wäre es, wenn diese CH3-Gruppe nach "unten" klappen würde, weil dann der Abstand zum Cyclopropan-Ring mit den beiden Methylgruppen größer wäre. Dazu wäre aber ein Anti-Angriff der beiden H-Atome notwendig, was aber bei einer katalytischen Hydrierung nicht möglich ist.
Die eben besprochene Reaktion ist ein schönes Beispiel für eine heterogene Katalyse. Dieses Thema wird auf der Lexikonseite "Katalysatoren" vertieft.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- Dyker-Vorlesung "Organische Chemie 1", Folge 32 (auf Tib AV - Portal verfügbar).
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Klein, Wiley-Schnellkurs Organische Chemie 2: Reaktionen, 2. Auflage, Wiley-VCH Weinheim 2021.