SN2 vs. E2
Es geht wieder um die Reaktion von 1-Brom-propan mit dem Methanolat-Anion. Vergleichen wir einmal die beiden Übergangszustände der SN2-Reaktion und der E2-Reaktion:
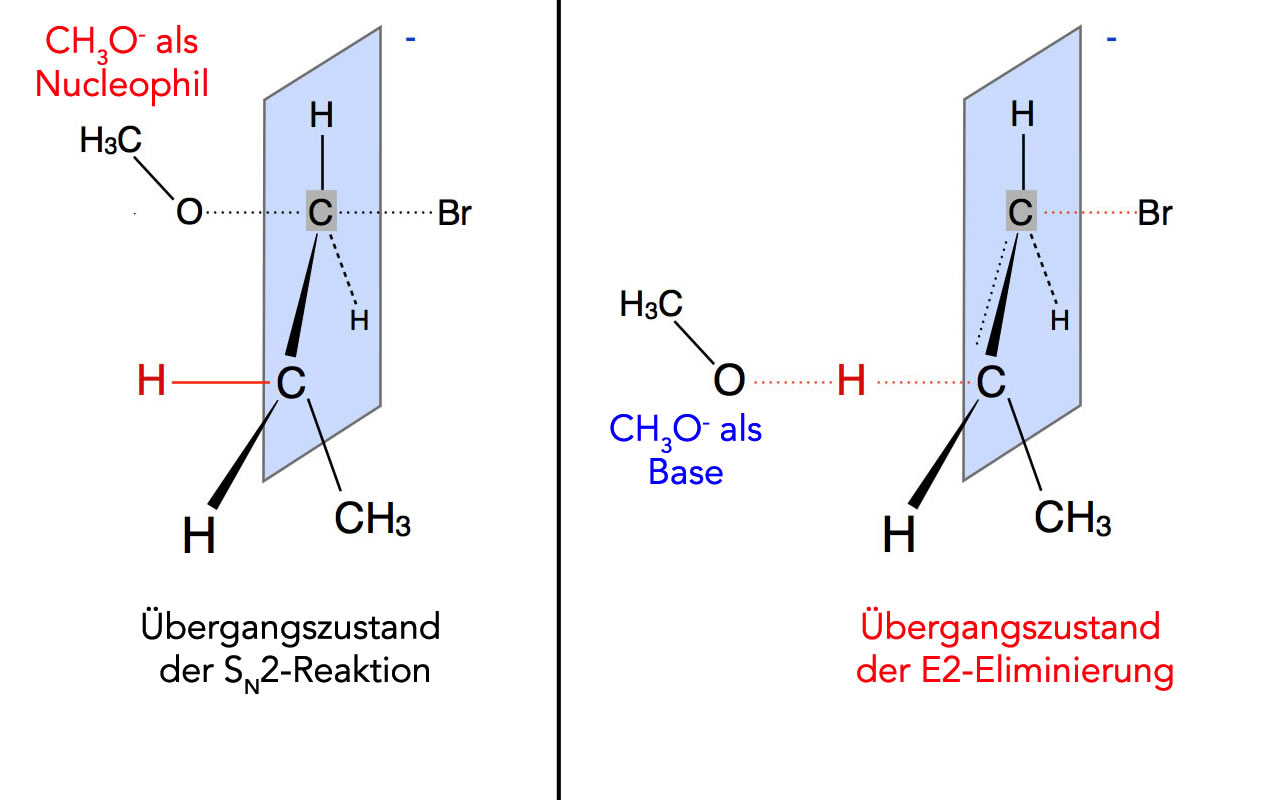
Übergangszustände der SN2-Reaktion und der E2-Reaktion
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der Substitution fungiert das Methanolat-Anion als Nucleophil und "schiebt" quasi das Brom-Atom als Bromid-Ion aus dem Substrat heraus (Rückseiten-Angriff, konzertierte Reaktion).
Bei der Eliminierung fungiert das Methanolat-Anion dagegen als Base und "zieht" das H-Atom als Proton aus dem Substrat heraus. Gleichzeitig (konzertiert) wird das Brom-Atom als Bromid-Ion abgegeben, damit sich kein Carbanion bildet. Die Doppelbindung zwischen den beiden C-Atomen ist im Übergangszustand schon andeutungsweise zu sehen.
E2 erfolgt meistens als trans-Eliminierung
Schauen wir uns mal folgende Situation an:
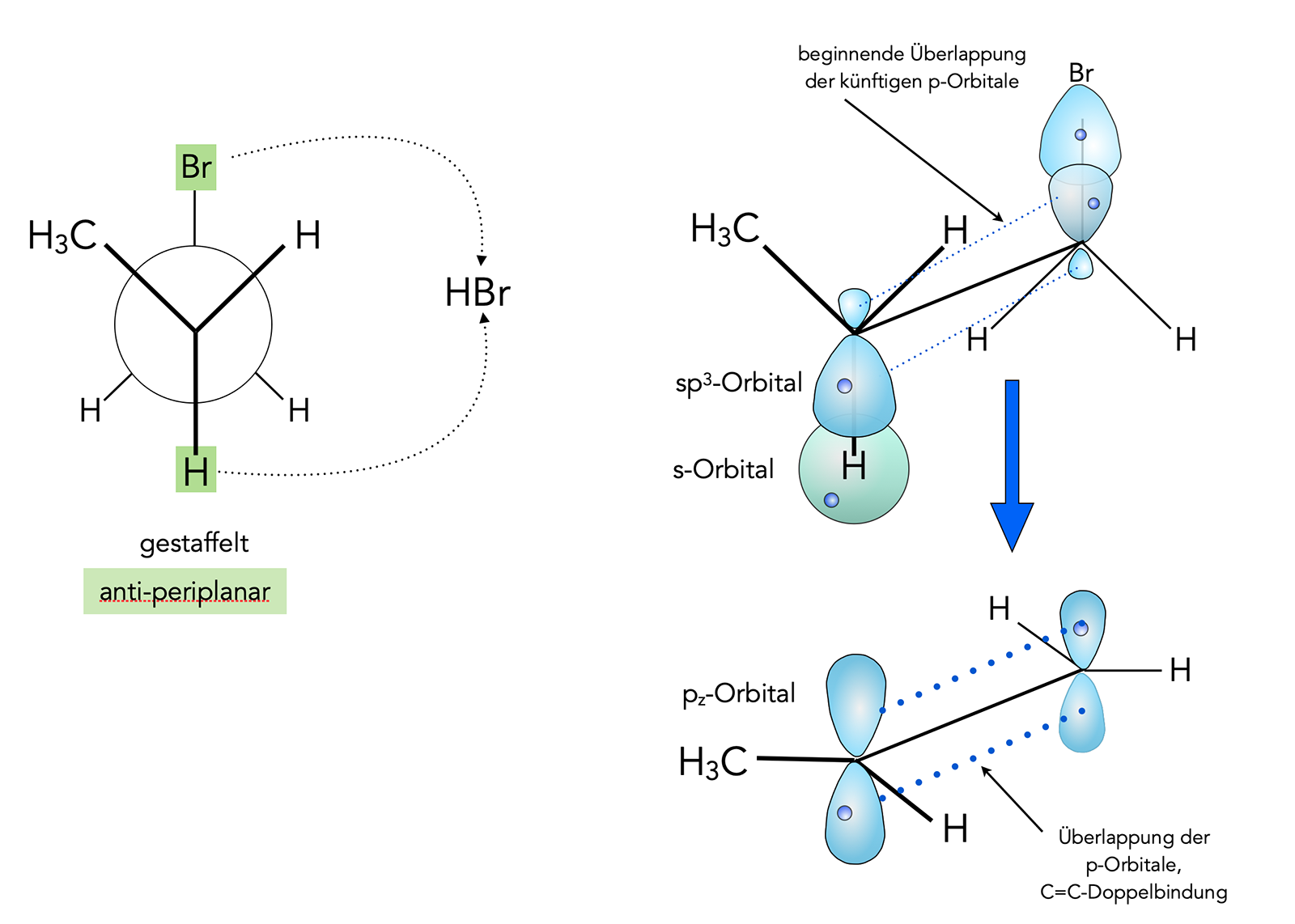
trans-Eliminierung
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wir sehen wieder das 1-Brompropan, diesmal aber in der Newmann-Darstellung (links) und in der Sägebock-Darstellung (rechts). Bei der trans-Eliminierung stehen das Brom-Atom am C1-Atom und ein H-Atom am C2-Atom in trans-Stellung. Man spricht hier auch von einer anti-periplanaren Anordnung von H-Atom und Brom-Atom.
Die Eliminierung von HBr erfolgt hier sehr leicht. Warum das so ist, sieht man in der Darstellung rechts. Wir sehen hier hinten das C1-Atom mit dem Brom und vorne das C2-Atom mit einem H-Atom.
Die Orbitale, die an den beiden kovalenten C-H- und C-Br-Bindungen beteiligt sind, sind ebenfalls eingezeichnet. Bei der Eliminierung werden die beiden sp3-hybridisierten C-Atome zu sp2-hybridisierten. Es erfolgt eine Umhybridisierung. Die sp3-Orbitale der beiden C-Atome werden dabei zu pz-Orbitalen. Damit sich aber eine C=C-Doppelbindung bilden kann, müssen die beiden künftigen pz-Orbitale parallel zueinander ausgerichtet sein, sonst kommt es zu keiner Überlappung der pz-Orbitale.
Bei der anti-periplanaren Ausrichtung der beiden zu eliminierenden Atome (H und Br) befinden sich die sp3-Orbitale bereits in der korrekten Orientierung, die Bildung der C=C-Doppelbindung ist also überhaupt kein Problem.
Ist auch eine syn-Eliminierung möglich?
Schauen wir uns dazu das folgende Bild an:
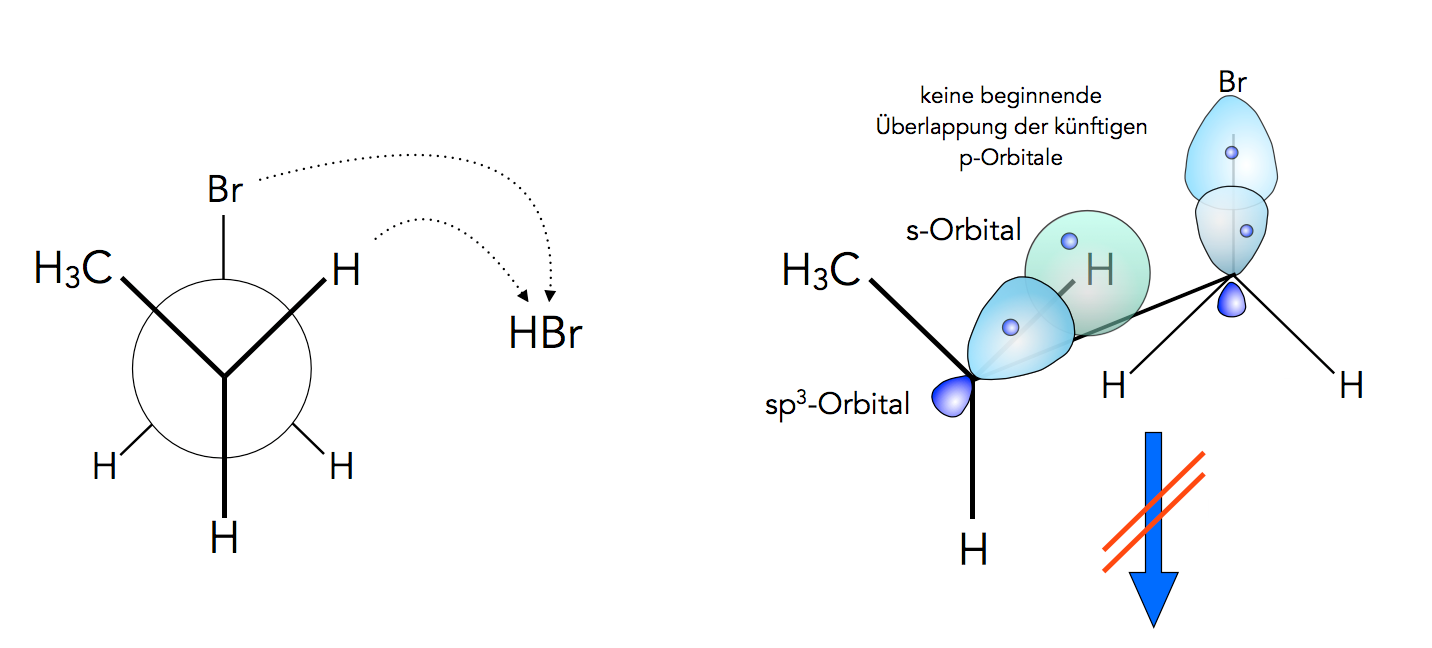
syn-Eliminierung
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei einer syn-Eliminierung wären die beiden relevanten sp3-Orbitale ungünstig angeordnet, die Überlappung der künftigen pz-Orbitale wäre nicht möglich, weil die künftigen pz-Orbitale sich nicht überlappen können.
Aus diesem Grund sind die meisten Eliminierungen, die nach dem E2-Mechanismus ablaufen, trans-Eliminierungen.
Selektivität der E2-Eliminierung
Bei der SN2-Substitution ist es ja so, dass Substrate mit Abgangsgruppen an primären C-Atomen besonders leicht reagieren können, Substrate mit Abgangsgruppen an tertiären C-Atomen dagegen so gut wie gar nicht. Hier wird dann der SN1-Mechanismus bevorzugt. Substrate mit Abgangsgruppen an sekundären C-Atomen können beide Arten der Substitution eingehen, hier spielen weitere Faktoren eine wichtige Rolle. Die SN2-Reaktion ist also in hohem Maße selektiv.
Bei der E2-Eliminierung ist das überraschenderweise überhaupt nicht der Fall. E2-Eliminierungen finden auch bei Verbindungen statt, bei denen sich die größere Abgangsgruppe an einem tertiären C-Atom befindet. Das liegt daran, dass das angreifende Nucleophil bei einer Eliminierung eben nicht in seiner Eigenschaft als Nucleophil angreift, sondern in seiner Eigenschaft als Brönsted-Base, also als Protonen-Akzeptor.
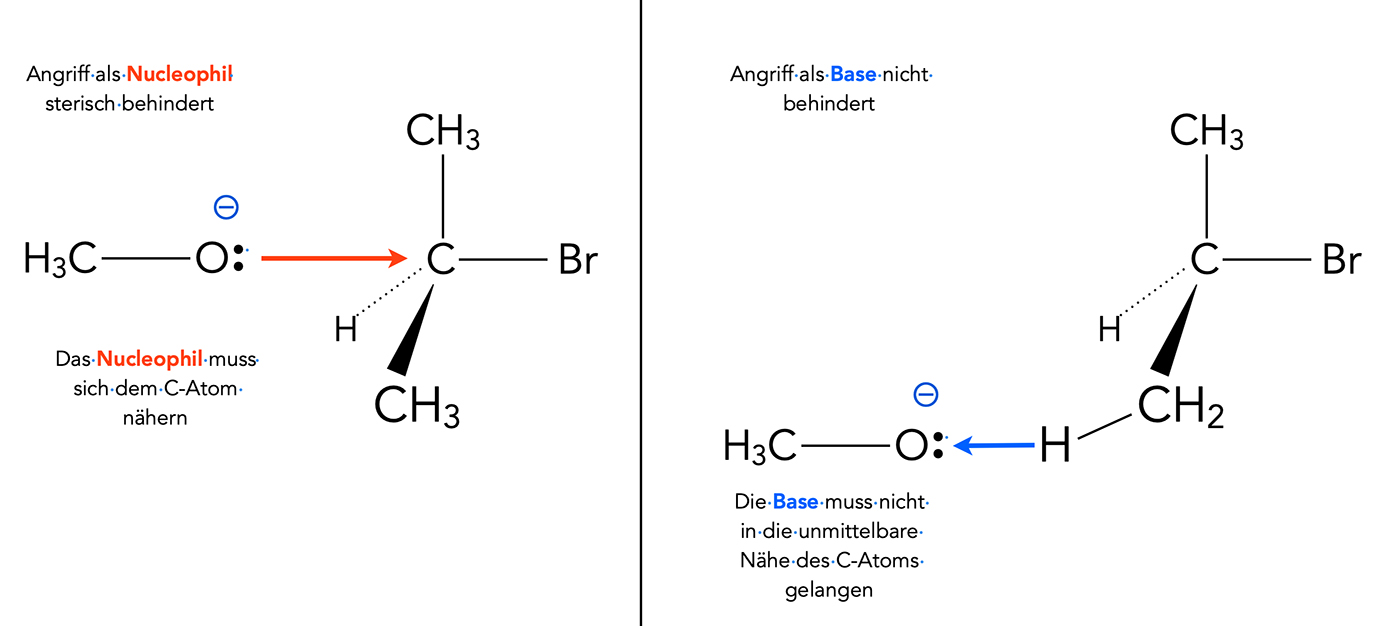
Vergleich SN2 und E2
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der SN2-Reaktion muss sich das angreifende Teilchen als Nucleophil in das Substrat-Molekül "hineindrängen", um das Nucleofug "hinauszuschieben". Hier spielt die sterische Hinderung oft eine große Rolle, da sich das Nucleophil dem positiv polarisierten C-Atom annähern muss.
Bei der E2-Reaktion fungiert das angreifende Teilchen nicht als Nucleophil, sondern als Base. Die Base muss lediglich ein kleines Proton aus dem Substrat "herausziehen". Und dabei sind auch größere Alkylgruppen in dem Substrat kein besonderes Hindernis. Das H-Atom ist sterisch leicht zugänglich, wie man sagt.
Hier haben wir ein typisches Beispiel für die sogenannte Regioselektivität. Das Methanolat-Anion greift als Nucleophil eine andere Region des Substrats an, als wenn es das Substrat als Base angreift.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Carey, Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995