Indol und Derivate
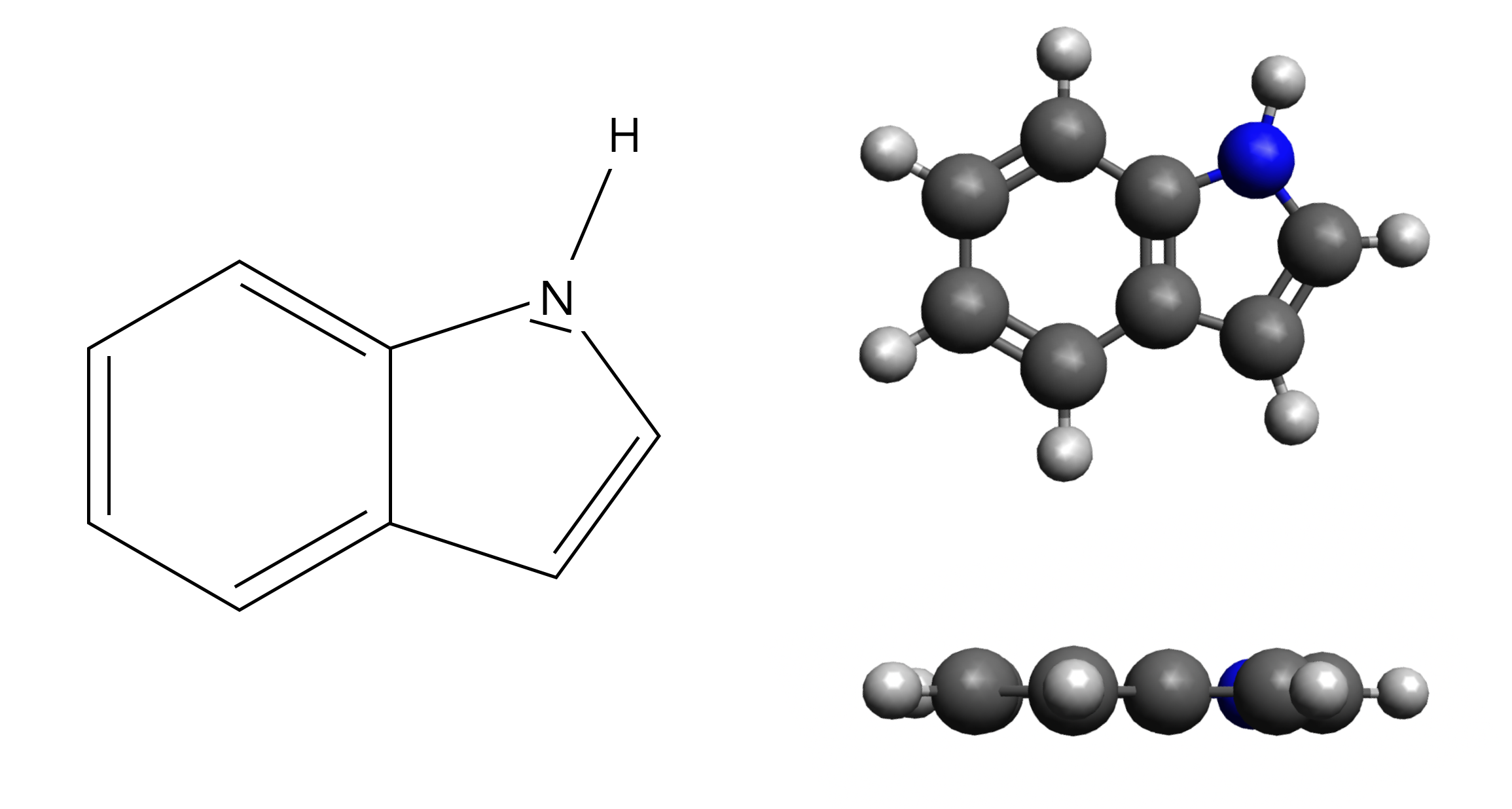
Indol als Strukturformel und Molekülmodell
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Wie man auf dieser Abbildung gut sehen kann, besteht das Indol-Molekül aus einem Benzol-Ring, der mit einem Pyrrol-Ring verknüpft ist, oder "anelliert", wie man in der Chemie sagt. Indol ist also ein mit Benzol anelliertes Pyrrol.
Aromatischer Charakter
Die Seitenansicht des Molekülmodells zeigt, dass das gesamte Doppelring-System planar ist. Außerdem ist die (4n+2)-Regel von Hückel erfüllt, da sich zehn π-Elektronen in den beiden Ringen befinden. Das freie Elektronenpaar des N-Atoms gehört mit zu diesen π-Elektronen - genau wie beim Pyrrol.
Bedeutung
Für Mediziner
Indometacin, ein Wirkstoff gegen Arthritis, enthält eine Indol-Gruppe, genau wie Lysergsäurediethylamid, eher als LSD bekannt:

Indometacin, Lysergsäurediethylamid (LSD) und Tryptophan
Quelle: Wikipedia, verschiedene Autoren, Lizenz: Public domain
Auch die Aminosäure Tryptophan enthält einen Indolring. Viele andere Naturstoffe und synthetisch hergestellte Verbindungen (zum Beispiel Strychnin) enthalten den Indolring.
Auch viele natürlich vorkommende oder synthetisch hergestellte Farbstoffe, die sogenannten Indigofarbstoffe:
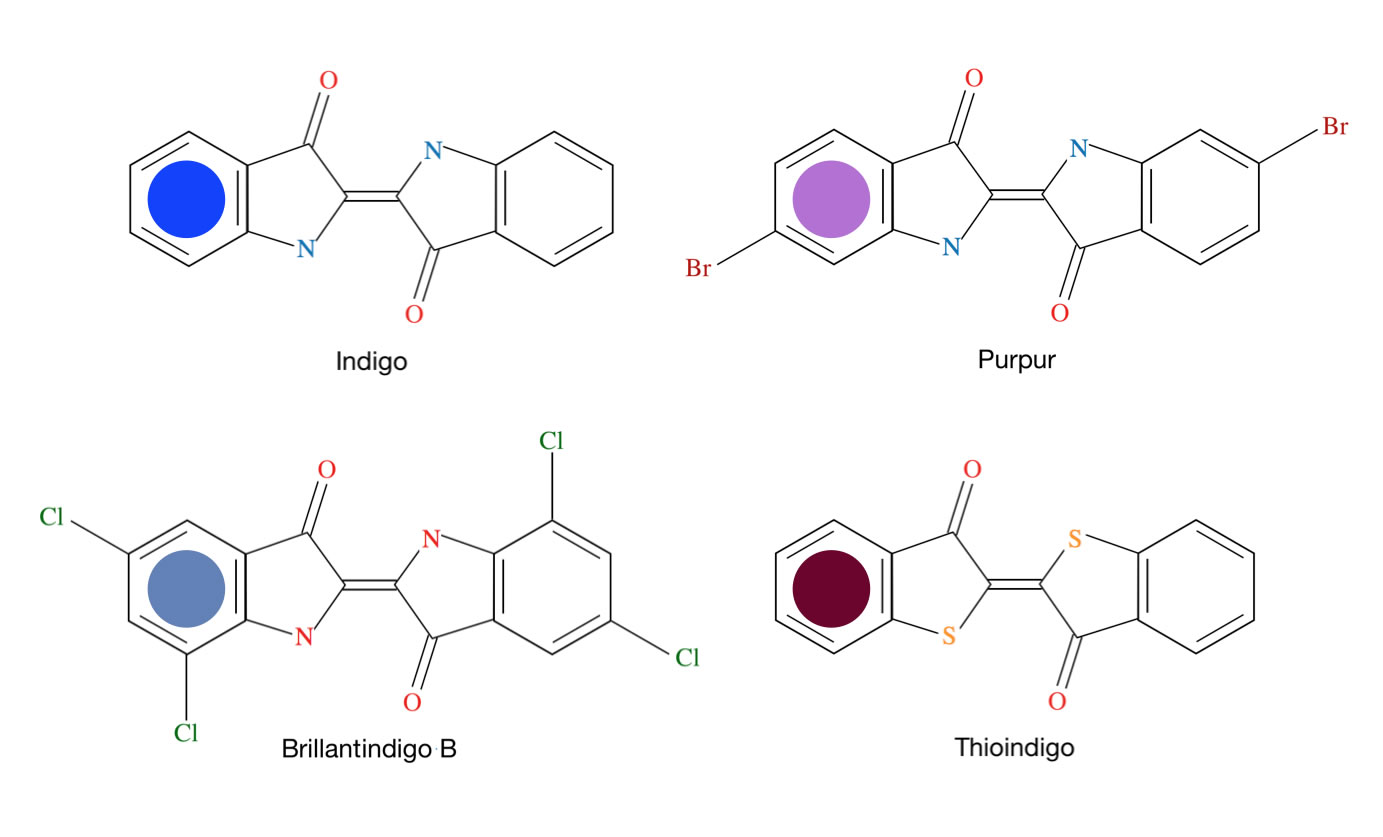
Vier Indigofarbstoffe
Reaktionen
Im Grund reagiert Indol wie ein Pyrrol, elektrophile Substitutionen finden nämlich nicht am Benzolring statt, sondern am reaktiveren Pyrrolring des Indols. Einen wichtigen Unterschied zum Pyrrol gibt es hier allerdings: Während die SE beim Pyrrol hauptsächlich an der Position 2 stattfindet, ist beim Indol wie Wahrscheinlichkeit einer SE an Position 3 größer.
Die Erklärung im Clayden ist nicht optimal
Die Erklärung für diese Orientierung wird im Clayden damit erklärt, dass die Aromatizität des Benzolrings aufgehoben wird, wenn sich ein Elektrophil an die Position 2 des Pyrrolrings setzt, während sie bei einer Substitution an Position 3 erhalten bleibt:

sigma-Komplex des Indols nach Clayden
Autor: Ulrich Helmich 01/2023, Lizenz: Public domain
Betrachtet man nur diese Zeichnung, ist nicht sofort ersichtlich, wieso die Aromatizität des Benzolrings aufgehoben sein soll, wenn eine Substitution in der Position 2 stattfindet (rechts). Alle sechs C-Atome des Benzolrings sind weiterhin sp2-hybridisiert, und die pi-Elektronen können sich frei im 6er Ring bewegen. Damit sind doch eigentlich alle Voraussetzungen für Aromatizität im Benzolring erfüllt.
Die Nicht-Aromatizität des Benzolrings hätte besser erklärt werden können, wenn man die andere Grenzformel des Benzols verwendet hätte:

sigma-Komplex des Indols nach Clayden
Autor: Ulrich Helmich 01/2023, Lizenz: Public domain
Der sigma-Komplex der SE in Position 3 ist links dargestellt, der Benzolring ist hier aromatisch. Findet die SE dagegen in Position 2 statt (rechts), kann man keine vernünftige Grenzstruktur des sigma-Komplexes zeichnen. Die rot gezeichneten C=C- bzw. C=N-Doppelbindungen sind nicht möglich, die C-Atome wären dann fünfbindig. Und das C-Atom mit dem Elektrophil ist bereits vierbindig, kann also auch keine Doppelbindung ausbilden.
Mit anderen Worten, der sigma-Komplex an Position 3 wird durch zwei Grenzstrukturen stabilisiert, der sigma-Komplex an Position 2 aber nur durch eine. Das ist der Grund, warum die Substitution mit höherer Wahrscheinlichkeit an Position 3 stattfindet.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
Seitenanfang -
Weiter mit Purin und Pyrimidin...