10.1 Purin und seine Derivate
Das Purin-Molekül setzt sich aus einem sechsgliedrigem Pyrimidinring und einem anellierten fünfgliedrigem Imidazolring zusammen:
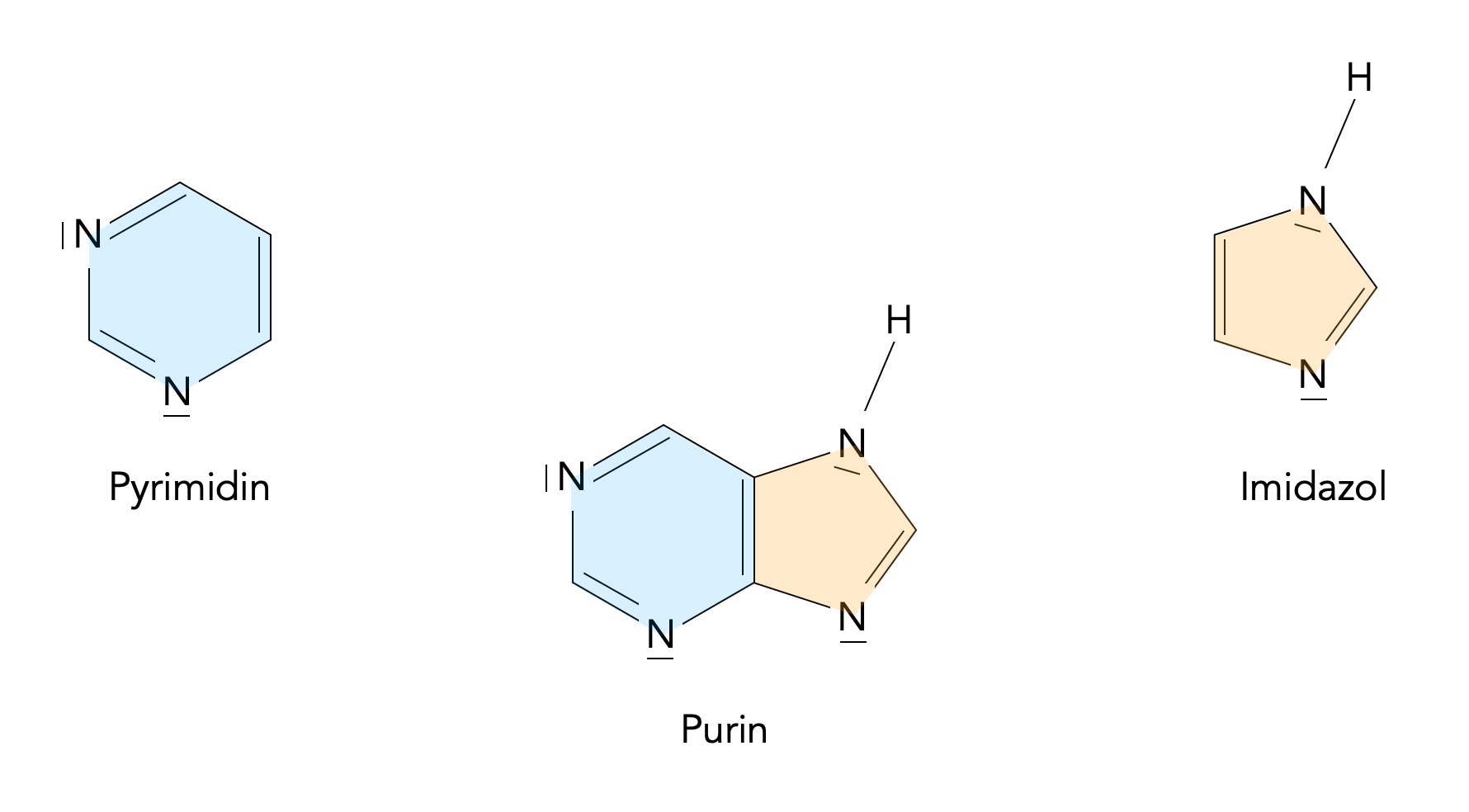
Purin setzt sich formal aus Pyrimidin und Imidazol zusammen
Autor: Ulrich Helmich 01/2024, Lizenz: CC BY-NC-SA 4.0
Purin ist - wie Sie sicherlich aus dem Biologieunterricht wissen - die Ausgangsverbindung der beiden DNA- und RNA-Basen Adenin und Guanin:
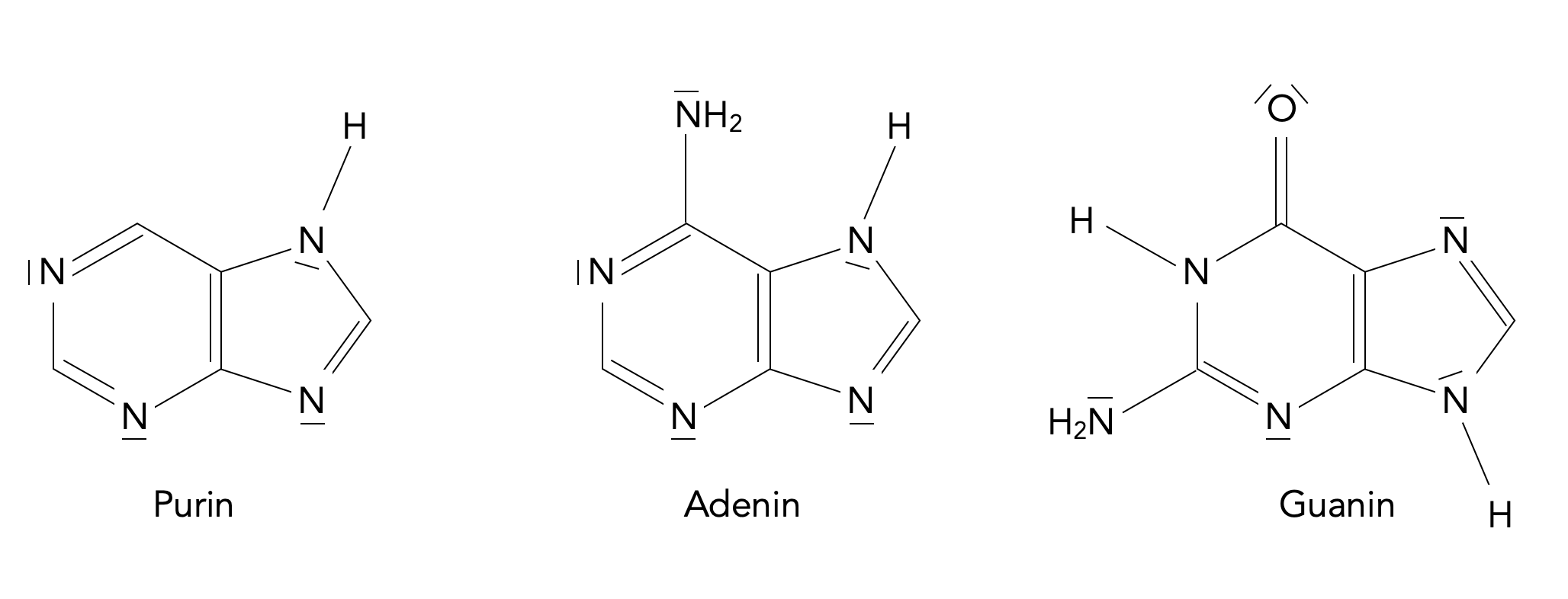
Purin und die beiden Purin-Basen der DNA bzw. RNA
Autor: Ulrich Helmich 05/2023, Lizenz: CC BY-NC-SA 4.0
Damit ist Purin "undoubtedly among the most ubiquitous of all the heterocyclic compounds." [5]. Adenin und Guanin sind ja nicht nur Basen der DNA und mRNA, sondern kommen in allen RNA-Formen vor (rRNA, tRNA etc.), außerdem in Energieträgern wie ATP und GTP (sowie ADP etc.) sowie in Coenzymen wie NADH etc.
Eigenschaften
Interessant ist, dass chemisch reines Purin in der Natur gar nicht vorkommt, es muss immer künstlich hergestellt werden. Die erste Synthese gelang dem deutschen Chemiker Emil Fischer schon 1884, indem er Harnsäure erhitzte.
Purin ist ein farbloser kristalliner Feststoff mit einer Dichte von 1,22 g/cm3, einem Schmelzpunkt von 217 ºC. Weder die Wikipedia noch der Römpp geben einen Schmelzpunkt an, daher ist anzunehmen, dass sich Purin beim starken Erhitzen zersetzt.
Zu den chemischen Eigenschaften von Purin selbst findet sich nicht viel in den grundlegenden Hochschul-Lehrbüchern, dabei sind die chemischen Reaktionen von Adenin und Guanin biologisch / medizinisch äußerst wichtig, denn sie können zu gravierenden Mutationen der DNA-Basen führen.
Aromatizität
Wir wollen einmal kurz untersuchen, ob Purin eine aromatische Verbindung ist.
Alle Atome des 6er Ringes sind sp2-hybridisiert, der Ring ist planar, so dass die pz-Orbitale gut überlappen können, und die Zahl der Elektronen im 6er Ring ist 6, entspricht also der (4n+2)-Regel. Der Pyrimidin-Ring ist also auf jeden Fall aromatisch.
Der 5er-Ring hat ebenfalls 6 pi-Elektronen. Zwar sehen wir nur zwei Doppelbindungen, aber das freie Elektronenpaar des einen Stickstoff-Atoms (das mit dem H-Atom) nimmt ebenfalls an dem pi-Elektronensystem teil, somit hätten wir sechs pi-Elektronen. Der Ring ist außerdem planar, somit sind die Kriterien für Aromatizität erfüllt.
Das gesamte Purin-Molekül hat 10 pi-Elektronen, ist planar und erfüllt ebenfalls die Hückel-Regel. Somit sind nicht nur die beiden Einzelringe für sich aromatisch, sondern auch das gesamte Purin-Molekül.
Tautomerie
Zur Tautomerie des Purin-Moleküls findet man dagegen etwas mehr in den Fachbüchern. Es gibt zwei Formen des Purins, das 9H-Purin und das 7H-Purin. Die beiden Formen stehen in einem chemischen Gleichgewicht:
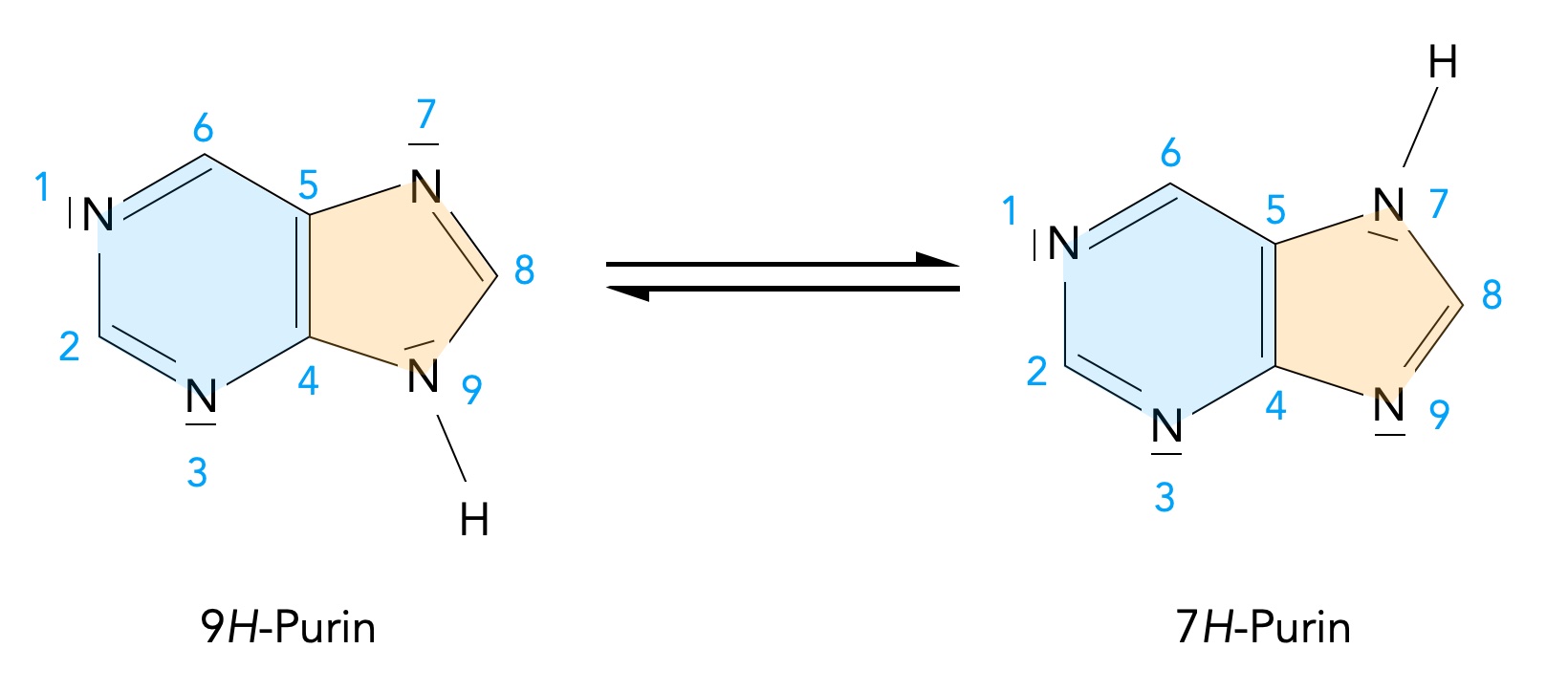
Tautomerie des Purins
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
10.2 Reaktionen von Purin(derivaten)
Protonierung
Wenn man in der Fachliteratur / im Internet nach chemischen Reaktionen von Purin sucht, stößt man nach kurzer Zeit auf die Protonierung von Purin, die zu einem Gemisch von vier tautomeren Kationen führt [6]:
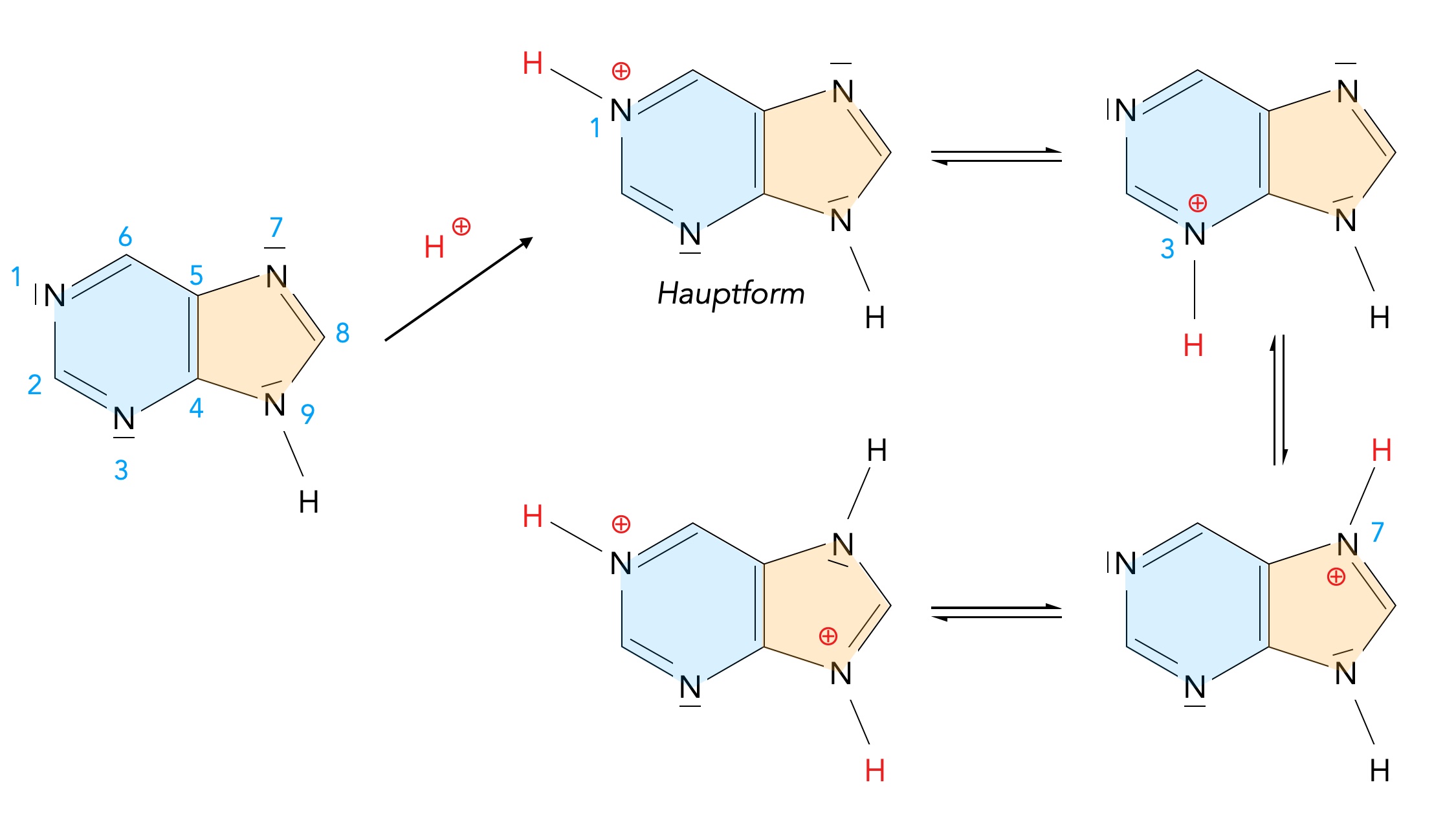
Protonierung von Purin
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Ob es sich bei den beiden letzten Formen um Tautomerie oder Mesomerie handelt, ging aus dem Video nicht klar hervor. Das zugrunde liegende Buch (Titel leider nicht angegeben) zeigt einen Mesomerie-Pfeil, der Autor des Videos spricht aber von Tautomerie.
Methylierung, Oxidation
In [6] werden zwei weitere Reaktionen des Purins gezeigt:
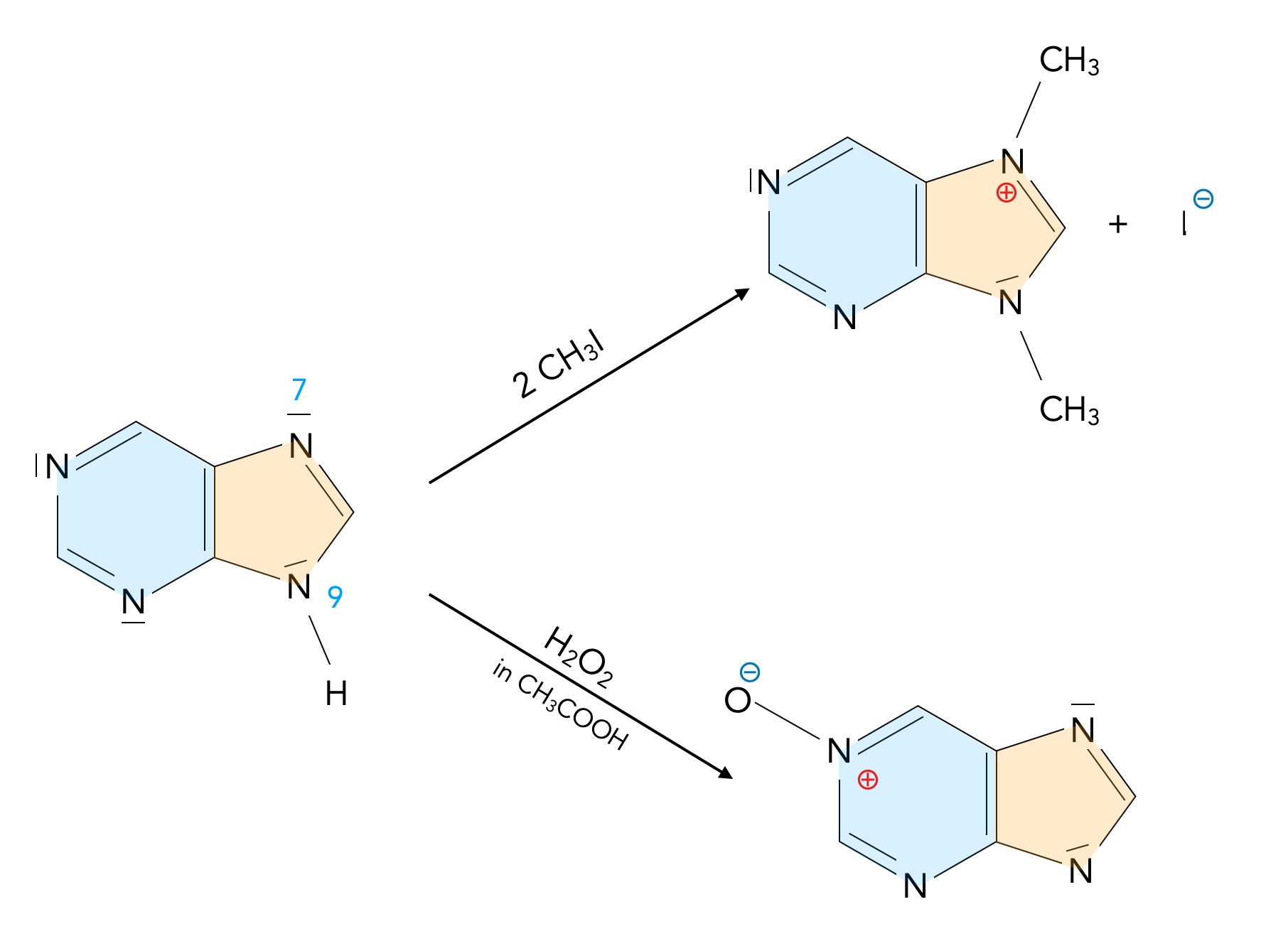
Reaktion von Purin mit Iodmethan und Wasserstoffperoxid
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Hier sehen wir die Reaktion von Purin mit Iodmethan CH3I und Wasserstoffperoxid H2O2. Nach Abspaltung des Iod-Atoms als Iodid-Ion reagieren die positiv geladenen Methyl-Kationen mit den N-Atomen in Position 7 und 9. Über den Verbleib des zweiten Iod-Atoms macht die Quelle [6] leider keine Angaben.
Unten sehen wir die Oxidation des Purins mit H2O2. Hier wird das N-Atom an Position 1 angegriffen. Auch hier keine weiteren Angaben in der Quelle.
Typische elektrophile Substitutionen sind die Nitrierung, die Sulfonierung und die Bromierung (bzw. Chlorierung):
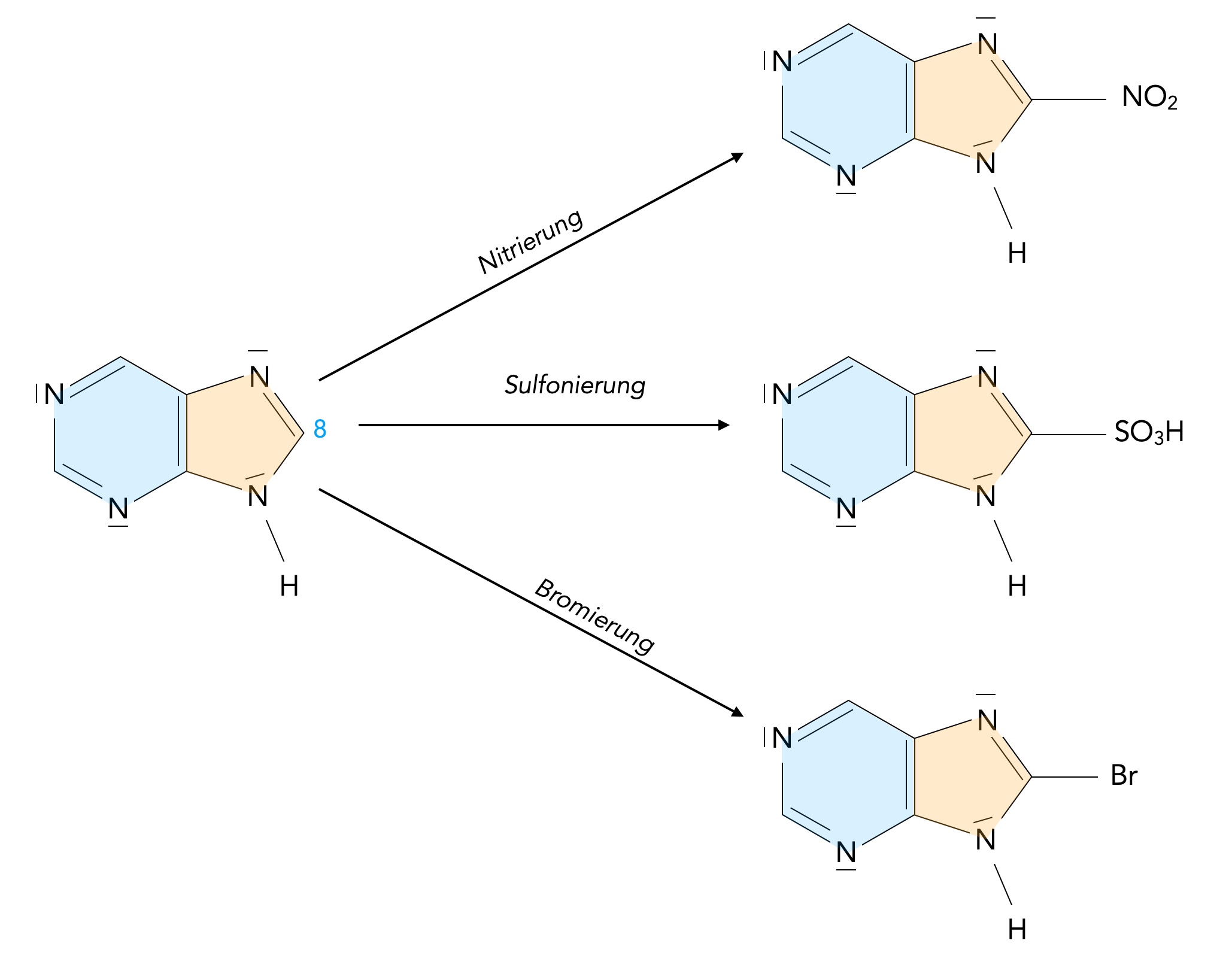
Nitrierung, Sulfonierung und Bromierung von Purin
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Weitere Angaben zu den benötigten Reagenzien und den Reaktionsbedingungen werden in [6] leider nicht gemacht.
Am Ende werden in dem Video noch zwei weitere Reaktionen aufgeführt:
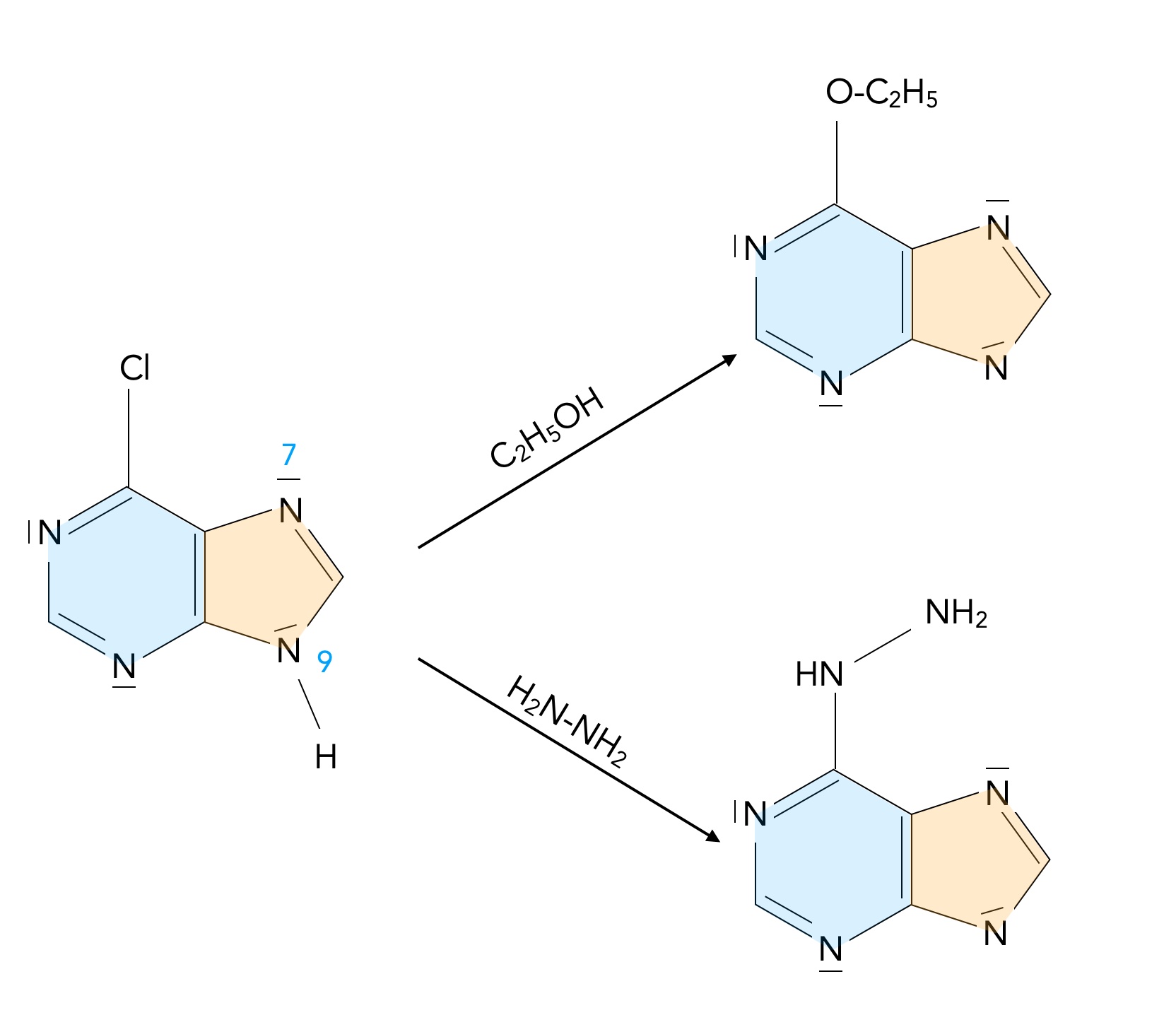
Nucleophile Substitution an 6-Chlorpurin
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Ein Halogen-Atom an Position 6 des Purin-Moleküls kann leicht durch Nucleophile wie Ethanol bzw. Ethanolat oder Hydrazin substituiert werden (nucleophile aromatische Substitution).
10.3 Pyrimidin
Pyrimidin ist die "Urmutter" der DNA- und RNA-Basen Cytosin, Thymin und Uracil und hat daher eine wichtige biologische Bedeutung. Da es leicht zu Mutationen dieser Basen kommen kann, die teils gravierende Folgen für die Betroffenen haben können, haben Pyrimidin bzw. seine DNA- und RNA-Derivate auch eine wichtige medizinische Bedeutung.

Pyrimidin und die drei Pyrimidin-Basen der DNA bzw. RNA
Autor: Ulrich Helmich 12/2023, Lizenz: CC BY-NC-SA 4.0
Die sechs pi-Elektronen des Pyrimidin-Ringes stammen von den vier C-Atomen und den beiden N-Atomen. Die freien Elektronenpaare des Pyrimidins sind "nach außen" gerichtet und können von Lewis-Säuren angegriffen werden.
Eigenschaften
Pyrimidin ist ein farbloser kristalliner Feststoff mit einer Dichte von 1,016 g/cm3, einem Schmelzpunkt von 20 bis 22 ºC und einem Siedepunkt von 123 bis 124 ºC (Daten aus der Wikipedia).
Elektrophile Substitutionen sind durch die geringere Elektronendichte im Ring nicht so einfach wie beim Benzol oder vergleichbaren Aromaten. Nucleophile Substitutionen werden durch die beiden elektronenziehenden N-Atome dagegen wahrscheinlicher.

Nucleophile Substitution am 2-Aminopyridin
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Hier sieht man den nucleophilen Austausch einer Aminogruppe durch ein Chlor-Atom [7].
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- G. Shaw, in Comprehensive Heterocyclic Chemistry, 1984
- Youtube-Video von Srikanth Kumar: "Purine - Synthesis, Reactions an Medicinal uses".
- Kogon et al.: "2-Chloropyrimidine", Org. Synth. 1955, 35, 34
Seitenanfang -
Das war das letzte Kapitel im Abschnitt "Heterocyclen"