Das Ziel der quantitativen Analyse ist es, zu ermitteln, in welchem Massenverhältnis die Elemente in der Verbindung enthalten sind. Aus dem ermittelten Massenverhältnis kann man dann mit Hilfe der bekannten Atommassen das Atomzahlverhältnis ermitteln, also die Verhältnisformel der Verbindung.
Ein Beispiel
Versuch 4
Nachweis von Kohlenstoff
Durchführung:
In einem Reaktionsrohr befinden sich Kupferoxid im Überschuss und genau 1 g Toluol. Beide Stoffe werden mit dem Bunsenbrenner kräftig erhitzt, gleichzeitig wird Luft durch die Apparatur gesaugt (Wasserstrahlpumpe).
Die heißen Toluoldämpfe strömen über das rotglühende Kupferoxid und werden dabei zu Kohlendioxid und Wasser oxidiert.
Die gasförmigen Verbrennungsprodukte werden dann durch ein U-Rohr mit festem Calciumchlorid und anschließend durch eine Gaswaschflasche mit 30%iger Kalilauge geleitet.
Sowohl das U-Rohr wie auch die Gaswaschflasche werden vor der Verbrennung exakt gewogen. Nach abgeschlossener Verbrennung werden die beiden Gefäße erneut gewogen.
Beobachtungen;
Bei der Verbrennung von 1,00 g Toluol entstehen 3,34 g Kohlendioxid und 0,78 g Wasser.
Erläuterung der Zahlen
Bei einer quantitativen Analyse will man das Atomzahlverhältnis der Verbindung bestimmen, im Falle von Toluol möchte man also wissen, in welchem Verhältnis C : H steht. Nun kennen wir das Atomzahlverhältnis von Toluol bereits, da Toluol die Summenformel C7H8 hat. Daraus kann man leicht die molare Masse M(Toluol) = 92 g/mol berechnen (gerundet).
Schauen wir uns nun die Reaktionsgleichung der Verbrennung von Toluol mit Sauerstoff an:
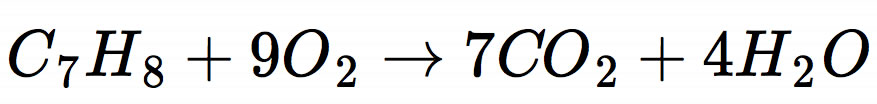
Aus 1 mol Toluol entstehen 7 mol Kohlendioxid und 4 mol Wasser. Das heißt, wenn wir 92 g Toluol verbrennen (1 mol), erhalten wir 308 g CO2 (7 mol) und 72 g Wasser (4 mol).
Mit einem einfachen Dreisatz rechnen wir dann aus, dass bei der Verbrennung von 1 g Toluol 3,34 g Kohlendioxid und 0,78 g Wasser entstehen müssen.
Bestimmung der Verhältnisformel von Toluol
Bei einer "richtigen" quantitativen Analyse kennt man die Summenformel oder Verhältnisformel der zu untersuchenden organischen Verbindung natürlich noch nicht. Man kann daher nicht so vorgehen, wie eben bei der "Erläuterung der Zahlen" beschrieben.
Durch die qualitative Analyse, die der quantitativen immer vorhergeht, haben wir ja herausgefunden, dass Toluol nur C- und H-Atome enthält, aber keine O-Atome. Also können wir nun ausrechnen, wie viel Kohlenstoff sich in den 3,34 g Kohlendioxid befindet. Dieser Kohlenstoff muss aus dem Toluol stammen.
Bestimmung von m(C) in 1 g Toluol
Kohlendioxid hat die molare Masse 44 g/mol, reiner Kohlenstoff hat das Atomgewicht 12 g/mol. Bei 44 g CO2 hätten wir also 12 g Kohlenstoff vorliegen. Bei 3,34 g CO2 sind das entsprechend 0,91 g Kohlenstoff (3,34 * 12/44).
Bestimmung von m(H) in 1 g Toluol
Wasser hat die molare Masse 18 g/mol, reiner Wasserstoff hat das Atomgewicht 1 g/mol. Bei 18 g H2O hätten wir also 2 g Wasserstoff vorliegen. Bei 0,78 g H2O sind das entsprechend 0,087 g Wasserstoff (0,78 * 2/18).
In 1 g Toluol befinden sich also ziemlich 0.91 g Kohlenstoff und 0.087 g Wasserstoff. Das ist doch schon mal ein brauchbares Zwischenergebnis.
Bestimmung des Atomzahlverhältnisses C : H
Nun ist ein C-Atom aber rund 12 mal so schwer wie ein H-Atom. Wenn wir wissen wollen, wie viele C-Atome auf ein H-Atom kommen, müssen wir die 0.91 g Kohlenstoff durch 12 dividieren. Wir erhalten dann den Wert 0,076.
Das Atomzahlverhältnis C : H im Toluol ist also 0.076 : 0.087 oder, mit 1000 multipliziert, 76 : 87. Nun wissen wir aber mit Sicherheit, dass Toluol nicht die Summenformel C76H87 hat. Ein solcher Stoff hätte ganz andere physikalische Eigenschaften als Toluol, er wäre mit hoher Wahrscheinlichkeit fest oder zumindest zähflüssig.
Betrachten Sie nun folgende Tabelle:
| Atomzahlverhältnis | Quotient |
| 76 : 87 | 0,874 |
| 6 : 7 | 0,857 |
| 7 : 8 | 0,875 |
| 8 : 9 | 0,889 |
Das Verhältnis 7 : 8 kommt dem experimentell ermittelten Ergebnis 76 : 87 recht nahe, daher kann man davon ausgehen, dass Toloul die Verhältnisformel C : H = 7 : 8 hat. Mögliche Summenformeln für Toluol wären dann C7H8 oder C14H16. Die leichte Flüchtigkeit, die geringe Dichte und so weiter sprechen eher für die "kleinere" Summenformel, aber ganz sicher kann man sich da nicht sein. Sicherheit bietet erst der nächste Schritt der Strukturbestimmung, die Ermittlung der molaren Masse der Verbindung.
Die Verhältnisformel von Benzol
Der deutsche Forscher E. MITSCHERLICH stellte 1834 fest:
"100 Theile Benzol bestehen … aus: 92,62 Kohlenstoff + 7,76 Wasserstoff, … Sauerstoff ist im Benzol nicht enthalten."Wir wollen aus diesen historischen Ergebnissen nun das Atomzahlverhältnis C : H für das Benzol berechnen.

Benzol hat demnach das Atomzahlverhältnis C : H = 1 : 1. Damit kommen als mögliche Summenformeln C2H2, C3H3, C4H4 und so weiter in Frage. Wie man die exakte Summenformel ermittelt, wird auf der nächsten Seite dargelegt.