Es gibt sehr viele verschiedene Sauerstoffverbindungen des Chlors; die Wikipedia zählt genau 11 auf, vom Chlordioxid ClO2 über das Dichloroxid Cl2O bis zum Dichlorheptaoxid Cl2O7.
Wichtig für den Chemie-Unterricht sind aber eigentlich nur zwei dieser Chloroxide, nämlich das technisch wichtige Chlordioxid ClO2 sowie das für das Ozonloch mitverantwortliche Chlormonoxid ClO.
Chlordioxid
Chlordioxid ist bei Zimmertemperatur ein bernsteinfarbenes, stechend riechendes Gas mit chlorähnlichem Geruch. Gemische aus Luft und Chlordioxid können sehr leicht explodieren und dabei zu Chlor und Sauerstoff zerfallen. Die wässrige Lösung dagegen ist nicht explosiv. Der Siedepunkt von Chlordioxid liegt bei 11 ºC, es wird also bereits im Kühlschrank flüssig.
Struktur
In den meisten Quellen wird das ClO2-Molekül mit zwei Cl=O-Doppelbindungen dargestellt
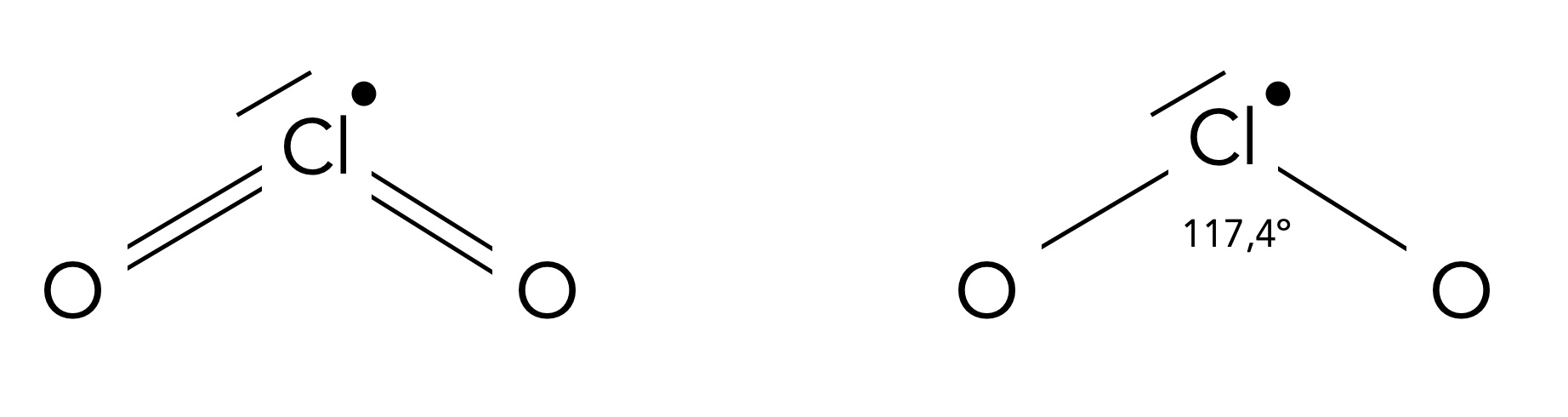
Mögliche Strukturen von Chlordioxid
Autor: Ulrich Helmich 08/2024, Lizenz: Public domain
Links sehen wir eine Struktur des Moleküls ClO2, wie sie in der Wikipedia und vielen anderen Internetquellen zu sehen ist. Rechts wird die Abbildung aus dem Holleman-Wiberg gezeigt, einem wichtigen Hochschul-Lehrbuch der Anorganischen Chemie.
Beiden Abbildung gemein ist, dass sich am Chlor-Atom ein einfach besetztes Orbital befindet, formal gesehen handelt es sich bei ClO2 also um ein Radikal.
Eigenschaften, Verwendung etc.
Die chemischen und physikalischen Eigenschaften, die Verwendung als Bleichmittel u.a., die Entdeckungsgeschichte und viel mehr wird in dem sehr ausführlichen Wikipedia-Artikel beschrieben.
Chlormonoxid
Auch das Chlormonoxid ClO ist ein Radikal; allerdings sitzt hier das "einsame" Elektron nicht am Chlor-Atom, sondern am Sauerstoff-Atom. ClO bildet sich u.a. durch thermischen Zerfalls von Chlordioxid, durch Photolyse von Sauerstoff-Chlor-Gemischen oder durch Reaktion von Chlor-Radikalen mit Chlordioxid oder Ozon.
In der Erdatmosphäre bildet sich Chlormonoxid durch die folgende Reaktion:
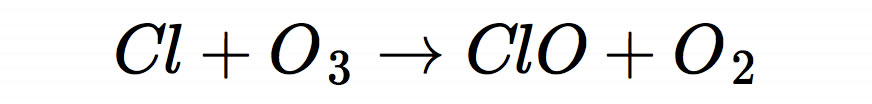
Die Chlor-Radikale werden durch die Reaktion von freigesetzten FCKWs (Fluorchlor-Kohlenwasserstoffen) mit Sauerstoff freigesetzt. Durch die obige Reaktion wird die Ozonschicht der Erde angegriffen (--> Ozonloch), was sehr nachteilig ist, da uns diese Ozonschicht vor der unerwünschten UV-Strahlung schützt