Ethan C2H6 ist nach dem Methan CH4 das zweiteinfachste Alkan, gefolgt vom Propan C3H8 und Butan C4H10.
Strukturdaten
Alle Bindungswinkel im Ethan-Molekül betragen 109,5º (Tetraederwinkel). Die sechs C-H-Bindungen sind unpolar, da der EN-Unterschied zwischen Kohlenstoff (2,55) und Wasserstoff (2,20) recht klein ist.
Die C-H-Bindungen sind s-sp3-σ-Bindungen, die C-C-Bindung ist eine sp3-sp3-σ-Bindung. Die Bindungslängen betragen 109 pm (C-H) bzw. 154 pm (C-C):
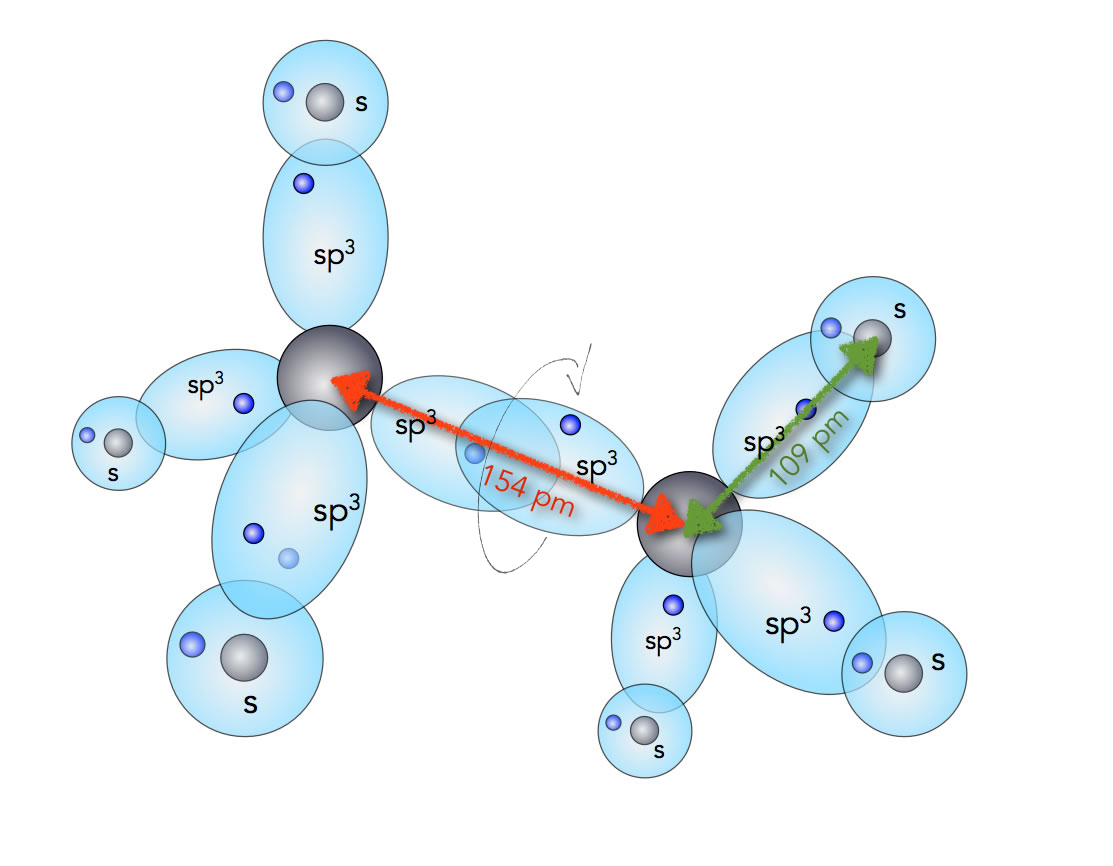
Die Bindungen im Ethan-Molekül
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Ethan-Konformationen
Typisch für eine sp3-sp3-Bindung ist die freie Drehbarkeit um die Längsachse der Bindung. Dies hat zur Folge, dass sich die beiden CH3-Gruppen des Ethan-Moleküls gegeneinander verdrehen können. Auf diese Weise entstehen zahlreiche verschiedene Konformationen des Moleküls. Auffällig sind vor allem zwei Konformationen, die als gestaffelt und verdeckt bezeichnet werden:
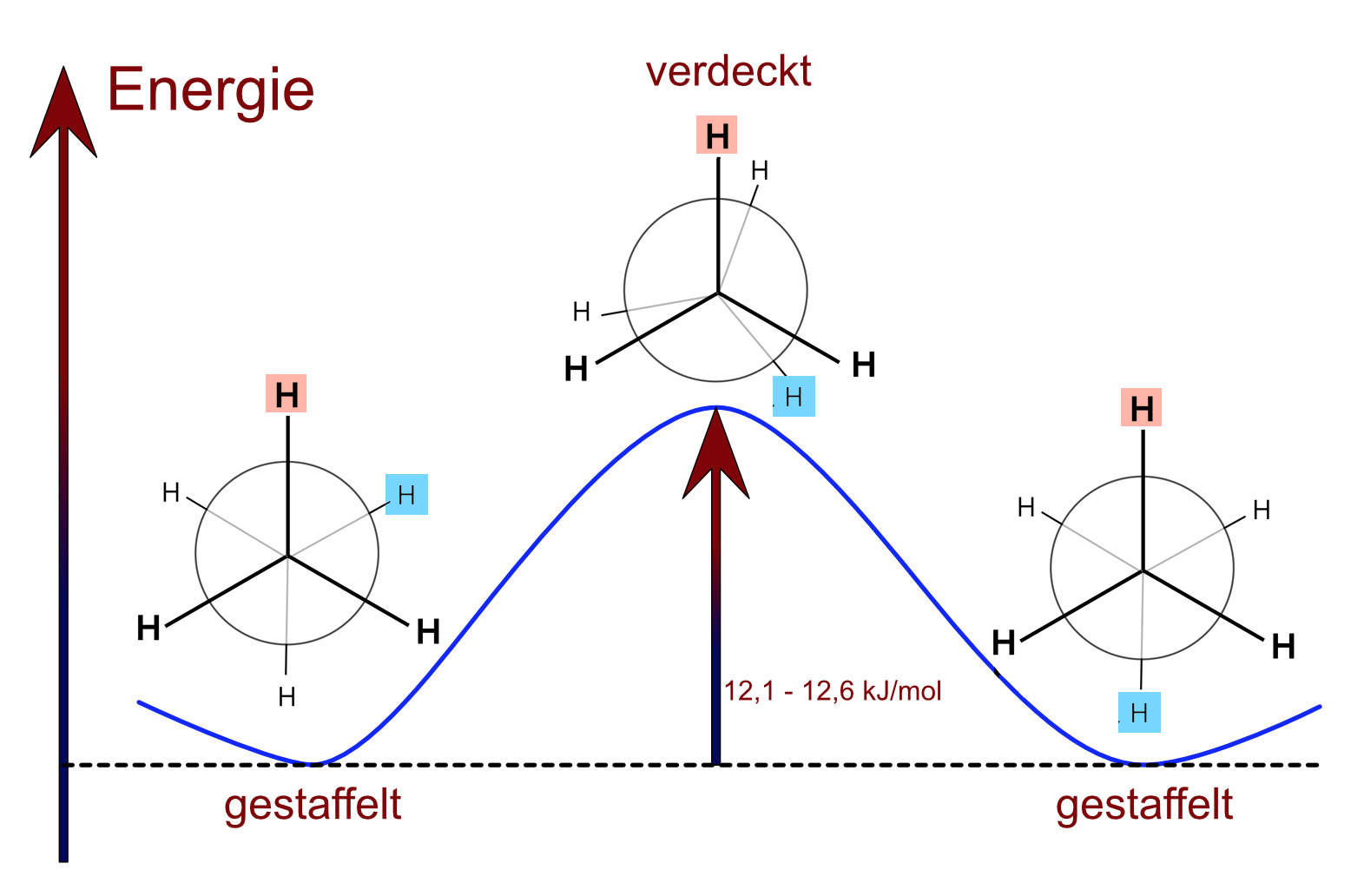
Die Ethan-Konformationen
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Bei der gestaffelten Konformationen sind die sechs H-Atome des Ethan-Moleküls möglichst weit voneinander entfernt, der Energiegehalt dieser Konformation ist daher minimal.
Bei der verdeckten Konformation kommen sich die Bindungselektronen der C-H-Bindungen recht nahe, daher ist diese Konformation ca. 12,1 bis 12,6 kJ/mol energiereicher als die gestaffelte.
Diesen kleinen Energiebetrag bezeichnet man als Torsionsenergie (auf Deutsch: Drehungsenergie).
Die Folge dieser kleinen Torsionsenergie ist, dass sich die beiden Methylgruppen des Moleküls bei Zimmertemperatur ständig um die C-C-Achse gegeneinander verdrehen. Wegen der geringeren Energie der gestaffelten Konformation befinden sich allerdings ca. 99% der Ethan-Moleküle in diesem Zustand.
Gewinnung und Synthese
Ethan kommt im Erdgas und in Raffineriegasen vor, kann aber auch gezielt aus anderen Verbindungen hergestellt werden. Das meiste für die Industrie benötigte Ethan wird aus diesen beiden Quellen gewonnen. Für die Darstellung von Ethan im Labormaßstab findet man in der Fachliteratur folgende Methoden zur Synthese von Ethan und teils auch höheren Alkanen.
Falls der Browser die folgenden Gleichungen nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
1. Hydrolyse von Diethylzink nach Frankland:
$Zn(C_2H_5)_2 + 2 \ H_2O \to 2 \ C_2H_6$
Hierbei wird Zn(OH)2 als Katalysator verwendet.
2. Elektrolyse nach Kolbe:
$2 \ CH_3COO^{-} \to 2 \ H_3C\bullet + 2 \ e^{-} + 2 \ CO_2$
Die beiden entstandenen Methyl-Radikale vereinigen sich im zweiten Schritt zu einem Ethan-Molekül:
$2 \ H_3C\bullet \to C_2H_6$
Die Kolbe-Synthese kann auch zur Herstellung höherer Alkane verwendet werden. Die Kolbe-Synthese ist in erster Linie eine Labormethode.
In dem Wikipedia-Artikel finden Sie eine ausführliche Darstellung dieser Reaktion
3. Synthese nach Wurtz:
$CH_3I + 2 Na \to CH_3\mbox{-}Na + NaI$
$CH_3\mbox{-}Na + CH_3I \to C_2H_6 + NaI$
In dem Wikipedia-Artikel finden Sie eine ausführliche Darstellung dieser Reaktion
Weitere Methoden
Die folgenden Methoden gelten eigentlich für alle höheren Alkane, nicht nur für die Synthese von Ethen:
4. Hydrierung von Ethen
$C_2H_4 + H_2 \to C_2H_6$
Diese Methode der Ethan-Synthese wird auf dieser Seite der Abteilung "Studienvorbereitung Organische Chemie" sehr ausführlich besprochen.
5. Grignard-Reaktion von Halogenethan C2H5-X mit Magnesium
$C_2H_5 \mbox{-}X + Mg \to C_2H_5 \mbox{-} Mg \mbox{-} X$
$C_2H_5 \mbox{-}Mg \mbox{-} X + H_2O \to C_2H_5 \mbox{-} H + X\mbox{-}Mg\mbox{-}OH$
Weitere Einzelheiten zu diesem wichtigen Reaktionstyp der Halogenalkane finden Sie auf dieser Seite im Abschnitt "Halogenalkane" der Abteilung "Studienvorbereitung Organische Chemie".
6. Reduktion vonHalogenethan C2H5-X mit Zink und Säuren
$C_2H_5 \mbox{-} X + Zn + H^{+} \to C_2H_5 \mbox{-} H + Zn^{2+} + X^{-}$
Eigenschaften
Physikalische Eigenschaften
Ethan ist farb- und geruchlos und bei Zimmertemperatur gasförmig. Der Schmelzpunkt liegt bei -183 ºC, der Siedepunkt bei -88 ºC [1]. Die Wasserlöslichkeit ist wie bei allen Alkanen schlecht, aber immerhin lösen sich in einem Liter Wasser 61 mg Ethan [2].
Für Mathe-Profis:
Wasserlöslicheit
Die molare Masse von Ethan beträgt 30 g/mol, und ein Mol eines (idealen) Gases hat ein Volumen von 22,4 l. 30 mg Ethan hätten also ein Volumen von ca. 22,4 ml, und die 61 mg Ethan, die sich in einem Liter Wasser lösen, würden ein Volumen von gut 45 ml einnehmen (im gasförmigen Zustand).
Reaktionen
Oxidation, Verbrennungswärme
Wie alle Alkane ist auch Ethan leicht oxidierbar, wenn genügend Sauerstoff vorhanden ist, verbrennt Ethan zu Wasser und Kohlendioxid:
$C_2H_6 + 3\frac{1}{2} \ O_{2} \to 2 \ CO_{2} + 3 \ H_{2}O \ \ \ \Delta H = -1427 kJ/mol$
Die Verbrennungswärme ist deutlich höher als beim Methan, aber Ethan hat ja auch fast die doppelte molare Masse.
Für Mathe-Profis:
Verbrennungswärme pro Gramm
Die Reaktionsenthalpie der Oxidation von Methan beträgt ca. -802 kJ/mol, beim Ethan liegt der Wert bei ca. -1427 kJ/mol. Wie viel Energie wird bei der Verbrennung von 1 g Methan bzw. Ethan freigesetzt?
1 mol Methan hat eine Masse von 16 g. 1 g Methan ist also 1/16 mol und sollte -802/16 = 50,1 kJ Verbrennungswärme liefern.
1 mol Ethan hat eine Masse von 30 g. 1 g Ethan ist also 1/30 mol und sollte -1427/30 = 47,6 kJ Verbrennungswärme liefern.
Dehydrierung
Durch Entzug von Wasserstoff kann Ethan zu dem einfachsten Alken reagieren, nämlich Ethen. Allerdings ist dafür eine sehr hohe Temperatur von mehr als 700 ºC nötig.
Chlorierung
Die Chlorierung von Ethan ist eine industriell wichtige Reaktion und liefert wertvolle Ausgangsstoffe für weitere Synthesen.
Chlorethan wird durch thermische Chlorierung von Ethan mit Chlorgas bei Temperaturen von 400 - 450 ºC und Drücken von 5-10 bar industriell hergestellt [6]. Um die Bildung von mehrfach substituierten Chlorethanen zu vermeiden, wird mit einem Ethan-Überschuss gearbeitet. Wegen der hohen Temperatur kann auf einen Katalysator verzichtet werden.
1,1- und 1,2-Dichlorethan werden dagegen meistens durch Oxcchlorierung von Ethen mit HCl und O2 hergestellt, also nicht aus Ethan.
Bromierung
Eine Bromierung von Ethan ist zwar möglich, wird aber so gut wie nie eingesetzt. Im Labor gewinnt man Bromethan eher durch Umsetzung von Ethanol mit Phosportribromid, im Schulexperiment auch durch Umsetzung von Ethanol mit Kaliumbromid (Nucleophile Substitution).
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "Ethan"
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Wikipedia-Artikel "Chlorethan"