Kationen
Die Radien von Kationen sind grundsätzlich kleiner als die der entsprechenden Atome. Hauptgruppen-Elemente geben stets sämtliche Außenelektronen ab, so dass beim Kation die Außenschale komplett verschwunden ist.
Beispiel Natrium: Atomradius = 186 pm, Ionenradius = 116 pm.
Anionen
Obwohl bei der Aufnahme eines Elektrons keine neue Schale dazukommt, nehmen die Radien bei der Bildung eines Anions stark zu.
Beispiel Sauerstoff: Atomradius = 74 pm, Ionenradius = 126 pm.
Der Grund hierfür ist die Zunahme der interelektronischen Abstoßung, jedes weitere Elektron vermindert die effektive Kernladung und vergrößert die gegenseitige Abstoßung der Elektronen.
Abhängigkeit des Ionenradius von der Kernladungszahl
Je höher die Kernladungszahl, desto kleiner der Ionenradius. Das kann man gut am Beispiel der folgenden isoelektronischen Kationen erkennen: Na+ = 116 pm, Mg2+ = 86 pm, Al3+ = 68 pm. "Isoelektronisch" heißt hier, dass die drei Kationen die gleiche Elektronenkonfiguration haben: K2 L8 M0.
Messung der Radien über die Elektronendichteverteilung
Eine direkte Messung von Ionenradien ist nicht möglich bzw. stark fehlerbehaftet. Eine Methode der indirekten Messung ermittelt die Elektronendichteverteilung in dem Salzkristall.
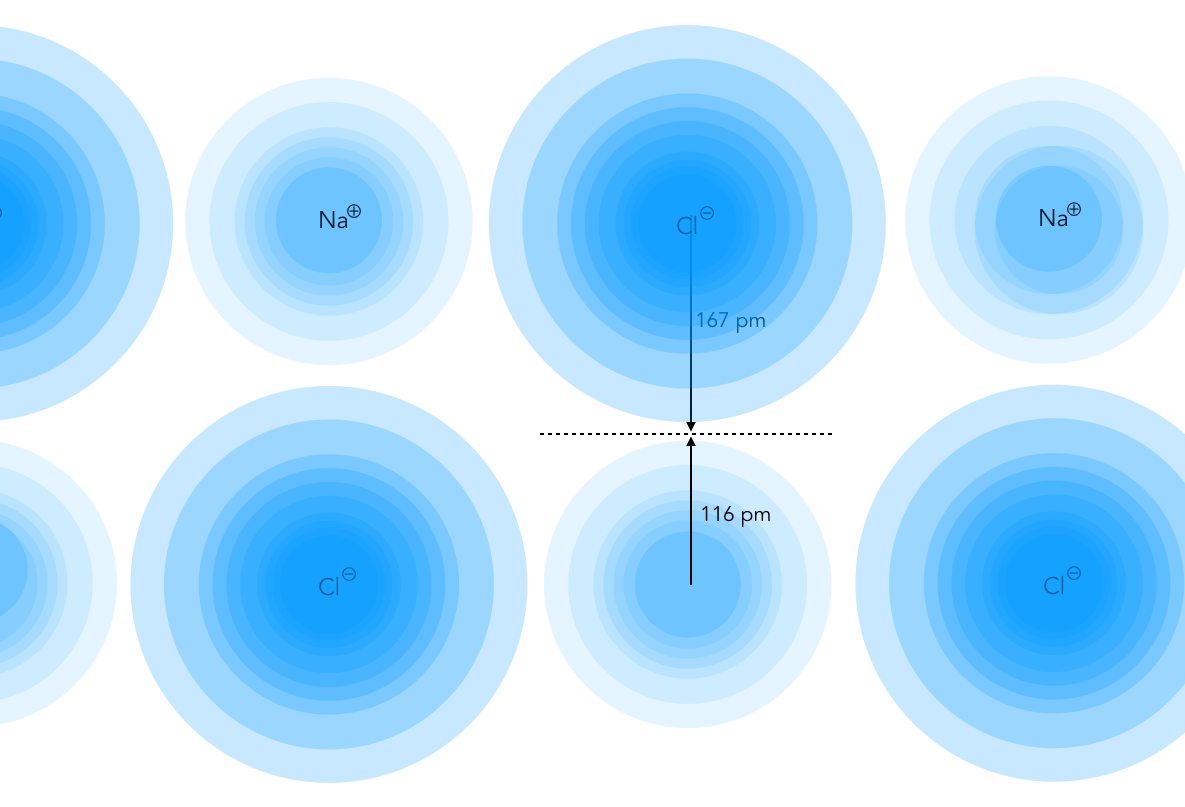
Verteilung der Elektronendichte im NaCl-Kristall
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Die Verteilung der Elektronendichte in einem Salzkristall kann mit Hilfe von Röntgenstrahlen quantitativ ermittelt werden.
Zur Festlegung des Ionenradius orientiert man sich an den Minima in der Verteilung der Elektronendichte, in der Zeichnung durch eine gestrichelte Linie angedeutet.
Quellen:
- Binnewies et al., Allgemeine und anorganische Chemie, 3. Auflage, Springer-Verlag 2016.