Unter einer Tautomerie versteht man in der Chemie das Hin- und Herpendeln eines Moleküls zwischen zwei verschiedenen Konstitutionen, es werden also tatsächlich Atome umgelagert.
Die Tautomerie darf nicht mit der Mesomerie verwechselt werden. Bei der Mesomerie überlagern sich zwei oder mehrere Grenzstrukturen, die aber quasi gleichzeitig existieren. Mit dem Kugelwolkenmodell kann man das nicht erklären, mit dem Orbitalmodell dagegen sehr gut. Bei der Tautomerie existieren aber tatsächlich zwei verschiedene Strukturen, die ineinander übergehen können und miteinander in einem chemischen Gleichgewicht stehen.
Das bekannteste Beispiel für eine solche Tautomerie ist die Keto-Enol-Tautomerie. Betrachten wir dazu das folgende Bild:
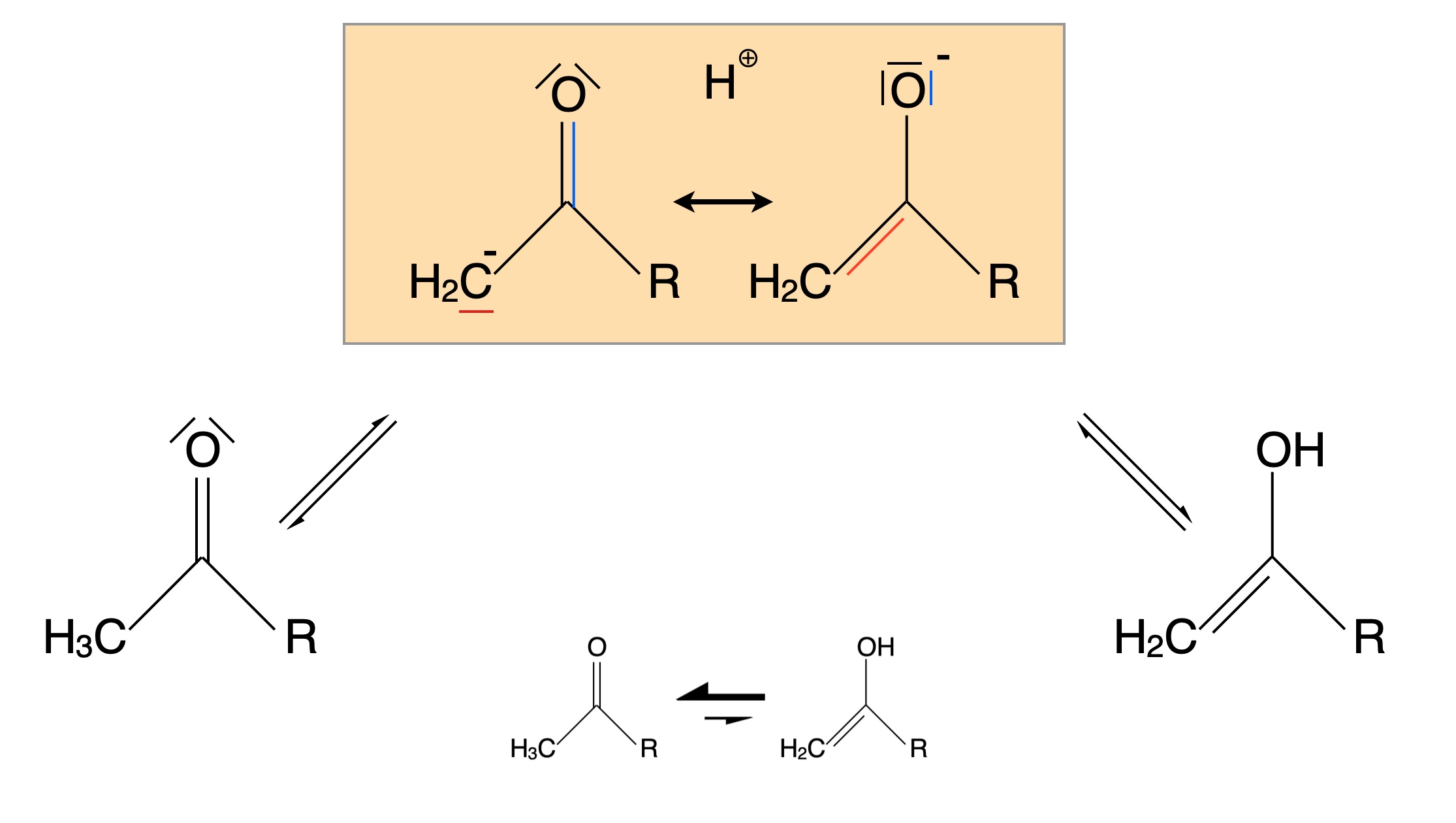
Keto-Enol-Tautomerie
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain.
Durch Abgabe eines Protons (Deprotonierung) entsteht aus dem hier gezeigten Keton ein Carbanion, das durch Mesomerie stabilisiert wird. Eigentlich ist es sogar diese Mesomerie-Stabilisierung des Carbanions, die das Keton zur Abgabe des Protons veranlasst.
Die Säurekonstanten (KS-Werte) von Aldehyden und Ketonen sind gar nicht mal so klein, wie man vielleicht annimmt. Mit starken Basen kann man ein Keton oder Aldehyd dazu bringen, ein Kohlenstoff-H-Atom als Proton abzuspalten. Ein gutes Beispiel hierfür ist die Synthese von Dibenzalpropanon, hier wird dem Keton Aceton im ersten Schritt durch OH--Ionen ein Proton entzogen. Die Ursache für die relativ "hohe" Säurestärke von Aldehyden und Ketonen liegt in dem Carbonyl-O-Atom, das einen starken -I-Effekt nicht nur auf das zentrale C-Atom ausübt, sondern auch auf die beiden benachbarten C-Atome (bei Ketonen) bzw. auf das benachbarte α-C-Atom (bei Aldehyden). Durch werden die C-H-Bindungen dieser C-Atome geschwächt, und das Abspalten eines Protons ist energetisch um 1020 (oder mehr) mal leichter als bei einem Alkan.
Durch Wiederaufnahme eines Protons kann sich nun entweder das ursprüngliche Keton zurückbilden (linker Reaktionsweg), oder aber es entsteht ein Enol (rechter Reaktionsweg) mit einer C=C-Doppelbindung und einer OH-Gruppe.
Übrigens werden die beiden Formen, die Keto-Form und die Enol-Form, als Tautomere bezeichnet.
Unten im Bild sieht man noch, dass das Tautomerie-Gleichgewicht meistens auf der Seite der Keto-Form liegt - auch bei Aldehyden. Beim Aceton liegt das Gleichgewicht beispielsweise zu knapp 99% auf der Seite des Ketons. Es gibt natürlich auch Ausnahmen, wenn beispielsweise die OH-Gruppe der Enol-Form durch H-Brücken oder andere Effekte stabilisiert wird.
Beispiel Acetessigsäure-ethylester
Ein interessantes Beispiel für Keto-Enol-Tautomerie ist der Acetessigsäure-ethylester, manchmal auch kurz als Acetessigester bezeichnet.
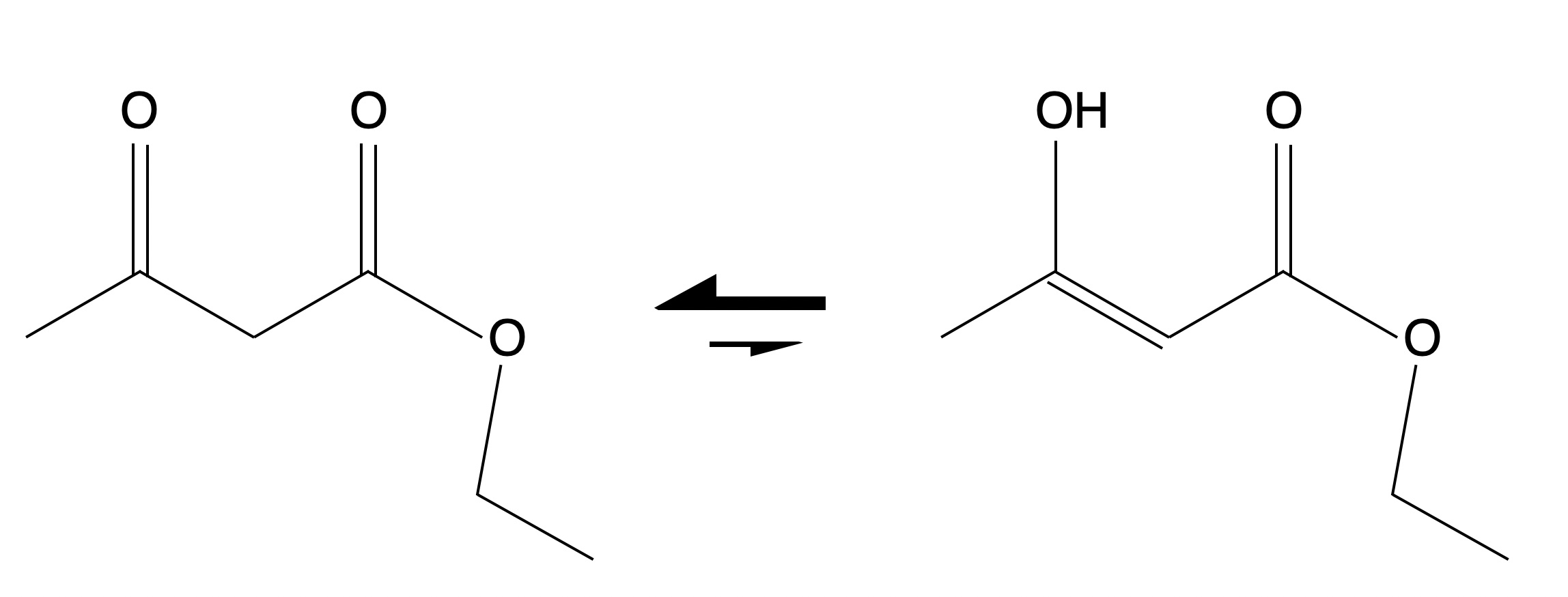
Keto-Enol-Tautomerie des Acetessigsesters
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain
Diese Verbindung verhält sich sehr eigenartig. Löst man Acetessigester in Ether und kühlt diese Lösung auf unter -75 ºC ab, dann fällt die Keto-Form als Feststoff aus, während die Enol-Form noch im Ether gelöst ist. Die Keto-Form hat einen Schmelzpunkt von -39 ºC.
Wenn man flüssigen Acetessigester destilliert, dann kondensiert die Enol-Form zuerst, während die Keto-Form noch gasförmig ist.
Interessant ist auch die Abhängigkeit der Gleichgewichts-Lage von dem gewählten Lösemittel:
- Wasser: 99,6% Ketoform - 0,4% Enolform
- Ethanol: 88% Ketoform - 12% Enolform
- n-Hexan: 54% Ketoform - 46% Enolform
Warum liegt das Gleichgewicht im unpolaren n-Hexan so stark auf der Enol-Seite? Eine Erklärung hierfür ist die intramolekulare Stabilisierung der OH-Gruppe des Enols durch das andere O-Atom:
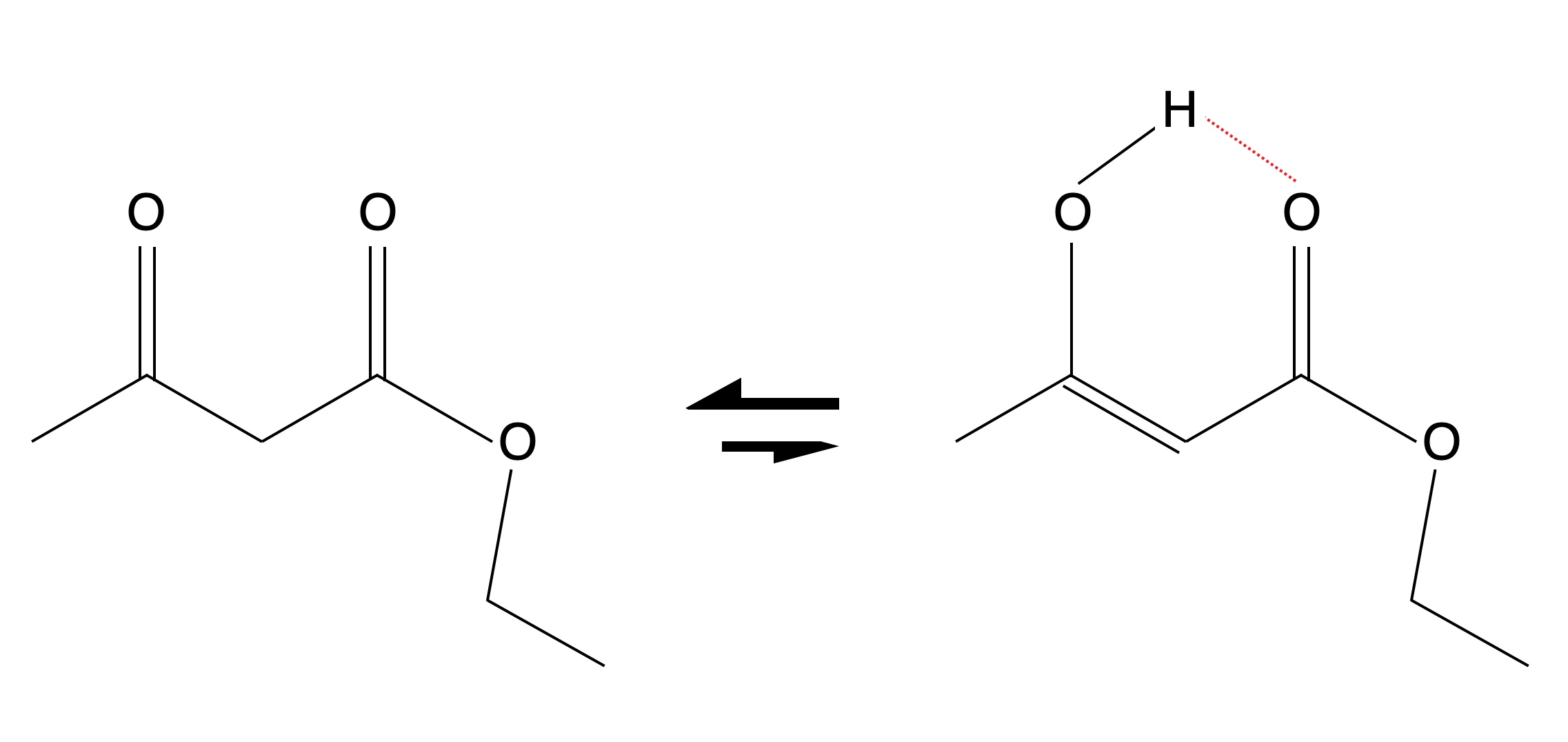
Stabilisierung der Enol-Form durch eine intramolekulare H-Brücke
Autor: Ulrich Helmich 04/2024, Lizenz: Public domain
Im Wasser oder im Ethanol bilden die O-Atome beider Tautomere H-Brücken mit Wasser-Molekülen aus. Bei der Enol-Form konkurrieren diese H-Brücken mit den intramolekularen H-Brücken. Im Hexan dagegen können keine H-Brücken mit dem Lösemittel gebildet werden, daher sind wahrscheinlich alle Moleküle der Enol-Form durch intramolekulare H-Brücken stabilisiert.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Wikipedia, Abschnitt "Keto-Enol-Tautomerie" im Artikel Tautomerie