Mesomerie ist die "Bezeichnung dafür, dass eine real existierende Struktur durch Kombination von $\psi$-Funktionen nicht existierender Grenzstrukturen beschrieben wird" [1].
Die Struktur des Moleküls kann nicht durch eine einzige Strukturformel wiedergegeben werden. Sie kann durch mehrere alternative Strukturformeln beschrieben werden, die als Grenzstrukturen bezeichnet werden. Die "wirkliche" Struktur muss man sich dann als Überlagerung dieser Grenzstrukturen vorstellen. So wird es auch im Lexikon der Chemie des Spektrum-Verlags beschrieben:
"Der Grundzustand dieser Moleküle wird durch Überlagerung der angebbaren Valenzstrichformeln (mesomere Grenzstrukturen, Valenzstrukturen) beschrieben. Die Grenzstrukturen stellen keine real existierenden Zustände des Moleküls dar, sondern dienen lediglich als Hilfsmittel, um die wirkliche Elektronenstruktur zu veranschaulichen" [2].
Beispiel Benzol-Molekül
Das wohl bekannteste Beispiel für Mesomerie ist das Benzol-Molekül.
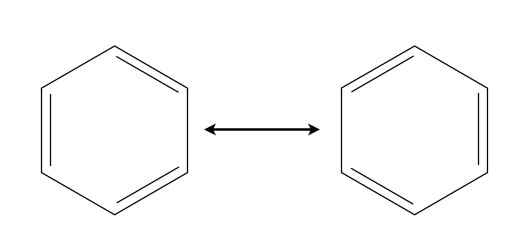
Die beiden Grenzstrukturen des Benzols
Autor: Ulrich Helmich 12/2019, Lizenz: Public domain.
Die Position der sechs C- und H-Atome ist in beiden Grenzstrukturen exakt die gleiche, nur die Lage der Doppelbindungen unterscheidet sich.
Früher glaubte man tatsächlich, dass die drei Doppelbindungen im Benzol-Moleküle mehrere 1000 mal pro Sekunde "umklappen" (Oszillations-Hypothese von Kekulé, 1872 [3]). Heute weiß man, dass beide Strukturen gleichzeitig existieren, die "wahre" Benzol-Struktur ist eine Überlagerung dieser beiden Grenzstrukturen. Auf der Seite über den aromatischen Charakter des Benzols habe ich dieses Thema weiter ausgeführt. Zum Verständnis der Mesomerie sollte man unbedingt das Orbital-Modell kennen, zu dem Sie auch ausführliche Seiten auf meiner Homepage finden.
Für Experten eine ganz kurze Erklärung:
Alle sechs C-Atome des Benzolrings sind sp2-hybridisiert, und die pz-Orbitale des Ringes überlappen sich, so dass sich die pi-Elektronen frei in diesem System aus sechs pz-Orbitalen bewegen können, sie sind delokalisiert. C-C-Einfachbindungen und C=C-Doppelbindungen gibt es im Benzolring nicht, alle sechs Bindungen sind gleichwertig, was man auch an den sechs identischen C-C-Bindungslängen erkennt. Die beiden Grenzstrukturen stellen quasi zwei "Extrempositionen" dar, in denen sich die Elektronen aufhalten können.
Beispiel Carboxylat-Ion
Das Carboxylat-Ion wie es zum Beispiel beim Natriumsalz der Essigsäure auftritt kommt ebenfalls in zwei Grenzstrukturen vor. Die C=O-Doppelbindung klappt nicht 1000 mal pro Sekunde um, sondern beide Grenzstrukturen existieren gleichzeitig, die "wahre" Struktur liegt irgendwo dazwischen.
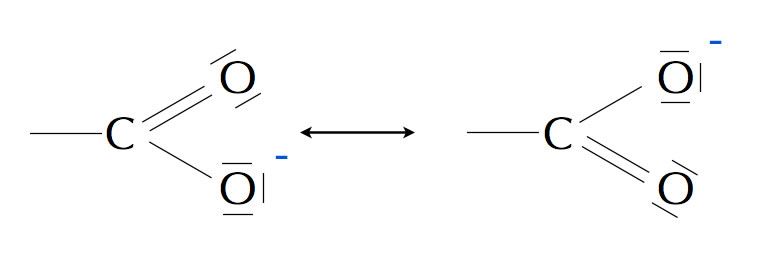
Die beiden Grenzstrukturen des Carboxylat-Ions
Autor: Ulrich Helmich 12/2019, Lizenz: Public domain.
Die negative Ladung ist nicht lokalisiert, sondern mehr oder weniger gleichmäßig auf die drei Atome O - C - O aufgeteilt, mit Schwerpunkt allerdings bei den beiden O-Atomen, weil diese eine höhere Elektronegativität besitzen als das C-Atom. Der Doppelpfeil in den beiden Abbildungen ist übrigens der Mesomeriepfeil. Er darf nicht verwechselt werden mit einem zweifachen Pfeil, der eine Gleichgewichtsreaktion kennzeichnet.
Beispiel Phenol-Molekül
Man darf jetzt nach diesen beiden Beispiel nicht denken, dass es immer genau zwei Grenzstrukturen eines Moleküls gibt. Viele Moleküle sind sehr einfach aufgebaut und existieren tatsächlich nur in einer Struktur. Andere Moleküle wie das Phenol-Molekül sind komplexer aufgebaut und existieren in mehr als zwei Grenzstrukturen:
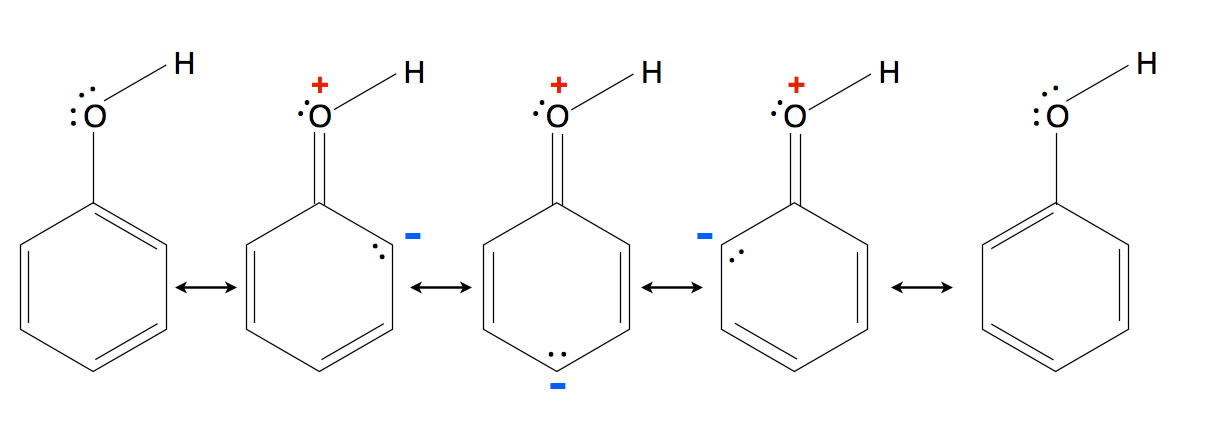
Die fünf Grenzstrukturen des Phenol-Moleküls
Autor: Ulrich Helmich 12/2019, Lizenz: Public domain.
Das Phenol zeichnet sich durch fünf Grenzstrukturen aus, die sich überlagern. Zwei Grenzstrukturen (ganz links und ganz rechts) ergeben sich ähnlich wie beim Benzol-Molekül durch Überlappen der sechs pz-Orbitale. Die drei mittleren Grenzstrukturen ergeben sich ebenfalls durch Überlappen der sechs pz-Orbitale und durch eine zusätzliche Ladungstrennung.
Wenn man das Sauerstoff-Atom als sp2-hybridisiert betrachtet, kann es quasi eine Doppelbindung zum benachbarten C-Atom aufbauen. Dies ist aber keine echte lokalisierte C=O-Doppelbindung, sondern eine Folge der in diesen drei Grenzstrukturen überlappenden pz-Orbitale. Dadurch erhält das O-Atom eine positive Ladung, während sich im Benzolring eine negative Ladung bildet: Ladungstrennung.
Allerdings konzentriert sich die negative Ladung auf nur drei der sechs C-Atome des Benzolrings, nämlich auf die C-Atome in ortho- und para-Stellung. Es gibt keine Grenzstruktur, bei der sich die negative Ladung in meta-Stellung aufhält. Eine solche Grenzstruktur, wenn es sie denn gäbe, hätte ein fünfbindiges C-Atom und ein dreibindiges C-Atom:
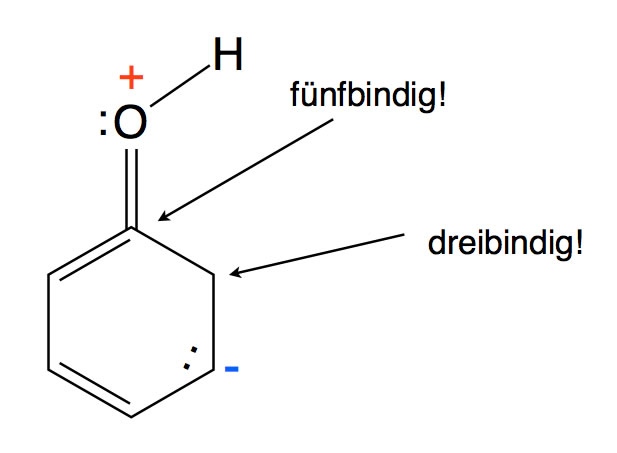
Eine nicht mögliche Grenzstruktur des Phenols
Autor: Ulrich Helmich 12/2019, Lizenz: Public domain.
Wichtige Regel
Je mehr Grenzstrukturen es von einem Molekül gibt, desto stabiler ist dieses Molekül.
Durch die Existenz von Grenzstrukturen wird ein Molekül in einen energetisch günstigeren Zustand versetzt, was man durch den Begriff der Mesomerieenergie ausdrücken kann. Auf dieser Seite in meinem Chemie-Lexikon erkläre ich Ihnen diesen wichtigen Begriff.
Quellen: