Die Nitro- oder NO2-Gruppe besteht aus einem sp2-hybridisierten Stickstoff-Atom und zwei ebenfalls sp2-hybridisierten Sauerstoff-Atomen:
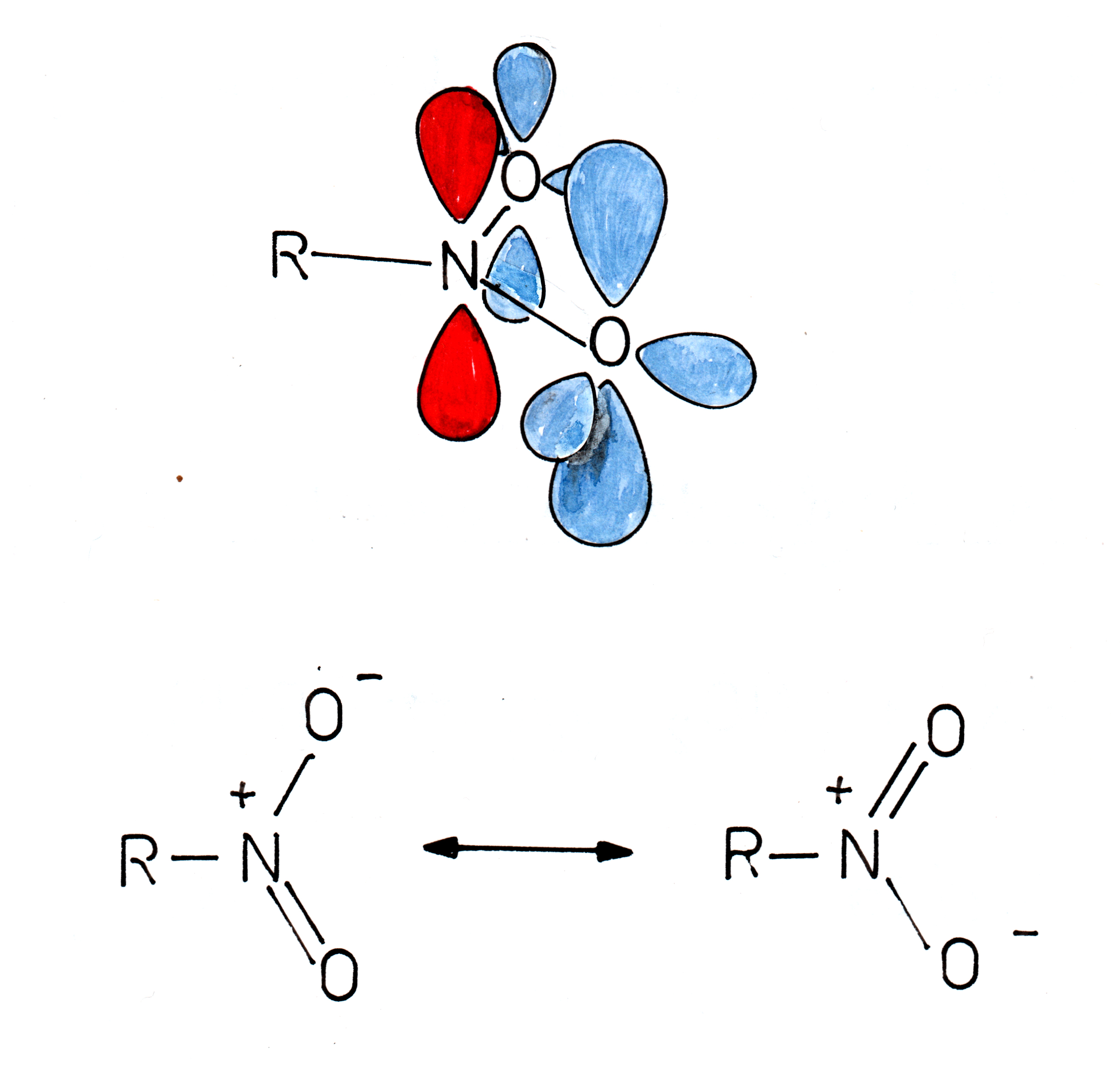
Oben: Die Nitrogruppe im Orbitalmodell, unten: Grenzstrukturen der Nitrogruppe
Autor: Ulrich Helmich, Handzeichnung von 1982, Lizenz: Public domain
Die insgesamt vier pi-Elektronen sind über die drei Atome delokalisiert. Zwei dieser Elektronen sind an der N=O-Doppelbindung beteiligt, die beiden anderen pi-Elektronen werden von dem anderen O-Atom bereitgestellt [1].
Die Nitrogruppe -NO2 ist - ähnlich wie das Carboxylat-Anion -COO- - mesomeriestabilisiert, wie man auf Abb. 1 sieht, gibt es zwei Grenzstrukturen.
Ähnlich wie die Carbonyl-Gruppe kann auch die Nitro-Gruppe von elektrophilen und nucleophilen Reagenzien angegriffen werden.
Angriffspunkt für nucleophile Reagenzien ist das positive Stickstoff-Atom, das dem Carbonyl-C-Atom entspricht. Elektrophile Reagenzien greifen an den negativen Sauerstoff-Atomen an.
Quelle:
- Schirmeister/Schmuck/Wich, Beyer/Walter Organische Chemie, 25. Auflage, Hirzel-Verlag 2015.