Relevanz für den Chemie-Unterricht
Für den Chemie-Unterricht ist Phenol sehr wichtig; fast in jedem Oberstufen-Lehrbuch gibt es eine eigene Seite oder sogar Doppelseite zum Phenol innerhalb des Kapitels über Aromatische Verbindungen bzw. Aromaten.
Warum ist das Phenol so wichtig für die Oberstufenchemie? An Beispiel des Phenols kann man sehr gut den Einfluss von Erstsubstituenten auf den Ablauf der elektrophilen Substitution erklären, vor allem, weil hier zwei gegensätzliche Effekte am Wert sind: Durch den negativen induktiven Effekt müsste die OH-Gruppe eigentlich die Reaktivität des Benzolrings verringern. Durch den +M-Effekt wird aber der -I-Effekt nicht nur aufgehoben, sondern ins Gegenteil verkehrt, die Reaktivität des Benzolrings steigt sogar.
Struktur und Strukturdaten
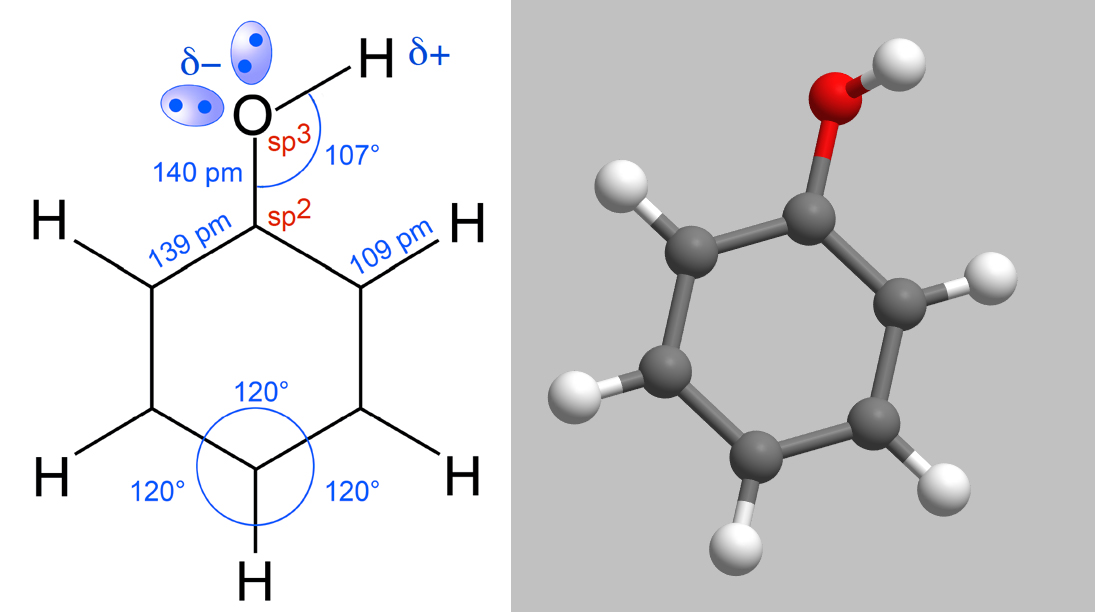
Strukturdaten des Phenol-Moleküls
Bindungslänge C-C im Benzolring = 139 pm; Bindungslänge C-H = 109 pm, Bindungslänge C-O = 140 pm. Bindungswinkel im Ring 120 Grad, Bindungswinkel O-H = 107 Grad.
Die sechs C-Atome des Benzolrings sind sp2-hybridisiert, wie man es vom Benzol-Molekül her kennt. Das nicht im Benzolring liegende O-Atom ist dagegen sp3-hybridisiert. Die Bindungslängen und -winkel sind aus der linken Abbildung erkenntlich, der räumliche Aufbau aus der rechten.
Physikalische Eigenschaften
Für den Chemieunterricht ist eigentlich nur die Wasserlöslichkeit des Phenols von Interesse. Phenol löst sich zwar in Wasser (wegen seiner OH-Gruppe), aber das Löslichkeitsverhalten ist ganz interessant.
Löst man ein paar Phenol-Kristalle in wenig Wasser, erhält man eine mehr oder weniger klare Lösung. Löst man die gleiche Menge Phenol in etwas mehr Wasser, so geht das nicht. Gibt man dann noch mehr Wasser dazu, löst sich das Phenol wieder und es entsteht eine klare Lösung.
Solch ein Phänomen nennt man in der physikalischen Chemie eine Mischungslücke. Hat man viel Phenol und wenig Wasser, so löst sich das Wasser quasi im Phenol. Hat man dagegen viel Wasser und wenig Phenol, so löst sich das Phenol im Wasser. Sind die Mengen an Wasser und Phenol ausgeglichen, so löst sich weder Wasser in Phenol noch Phenol in Wasser.
Betrachten wir dazu folgendes Diagramm:
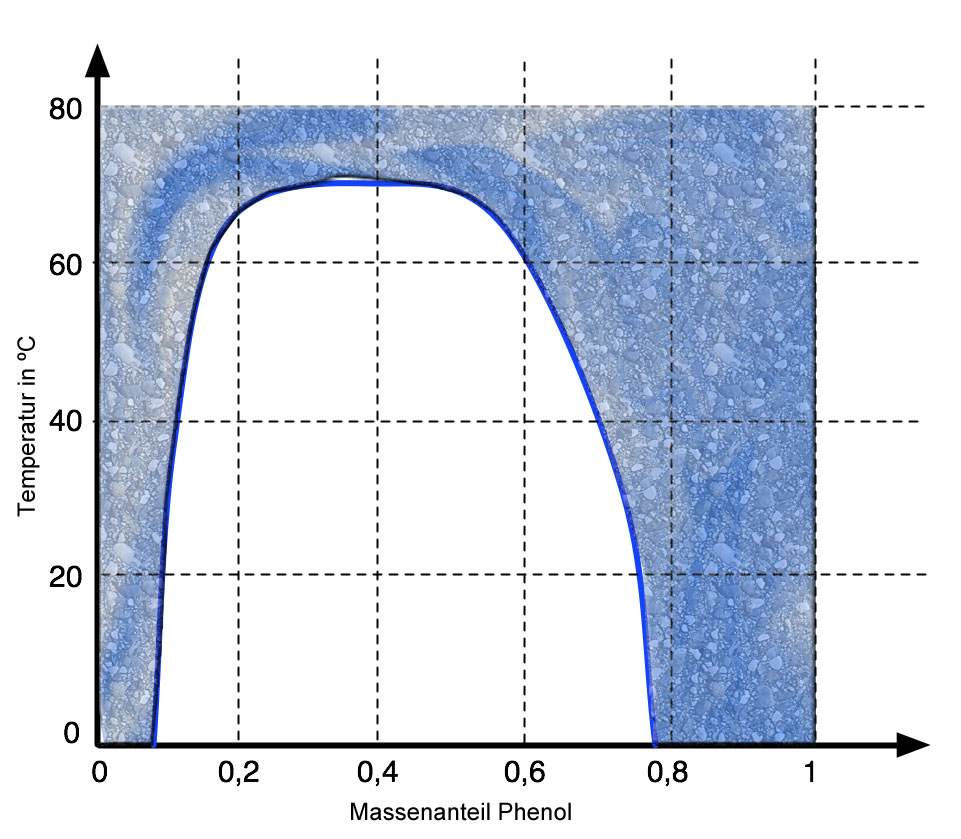
Die Mischungslücke des Phenol-Wasser-Systems
Diese Abbildung zeigt die Mischungslücke im Phenol-Wasser-System, die aber nur bei Temperaturen unterhalb von ca. 72 ºC besteht. Oberhalb dieser Temperatur verschwindet die Mischungslücke, und man kann dann Phenol und Wasser in beliebigen Massenanteilen mischen.
Chemische Eigenschaften
Als Aromat geht Phenol gern elektrophile Substitutionen ein. Die OH-Gruppe erhöht die Reaktivität des Benzolringes. Für den Chemieunterricht ist dies höchst interessant, denn eigentlich müsste die OH-Gruppe die Elektronendichte des Ringes vermindern, wegen des -I-Effekts, den die OH-Gruppe hat. Das Gegenteil ist aber der Fall. Durch den +M-Effekt wird die Elektronendichte im Ring sogar erhöht. Daher ist Phenol reaktiver als beispielsweise Toluol, das ja auch schon recht reaktiv ist, wegen des +I-Effekts der Methylgruppe. So kann Phenol beispielsweise bereits bei Zimmertemperatur mit Bromwasser zu einem dreifach substituierten Bromphenol reagieren. Auch Sulfonierungen, Friedel-Crafts-Alkylierungen und -Acylierungen und weitere Reaktionen sind kein Problem.
Weitere Einzelheiten dazu auf der Seite "+M-Effekt vs. -I-Effekt beim Phenol" im Bereich "Aromaten".
Abgesehen von diesen elektrophilen Substitution kann Phenol auch als Alkohol reagieren. So ist es möglich, Phenol beispielsweise mit Essigsäurechlorid zu verestern:

Veresterung von Phenol mit Essigsäurechlorid
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain