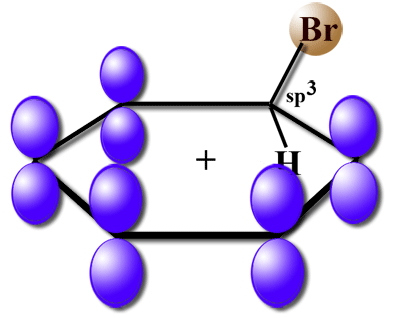
Der Sigma-Komplex ist ein Zwischenprodukt bei der elektrophilen Substitution an einem Aromaten. Im Chemie-Unterricht wird der Sigma-Komplex meistens bei der Bromierung von Benzol bzw. Toluol eingeführt und besprochen (siehe dort).
Der Sigma-Komplex bei der Benzol-Bromierung besteht aus den sechs C-Atomen des Benzolrings mit den assoziierten H-Atomen und einem Brom-Atom, das an eines der sechs C-Atome zusätzlich gebunden ist. Während alle anderen C-Atome sp2-hybridisiert sind, ist das C-Atom, welches das Brom-Atom trägt, sp3-hybridisiert. Der aromatische Zustand des Benzolrings existiert also nicht mehr, es sind nur fünf p-Orbitale vorhanden, die überlappen. In diesen fünf p-Orbitalen halten sich nur vier Elektronen auf, so dass der Benzolring positiv geladen ist.
Schaut man sich die drei Grenzstrukturen des Sigma-Komplexes an...
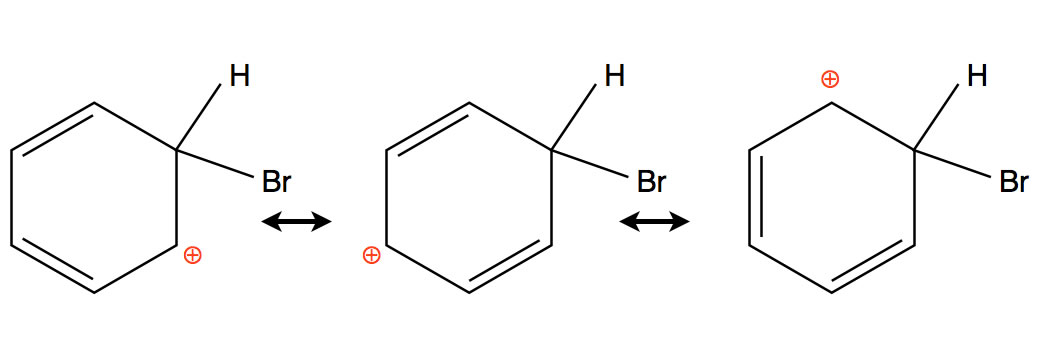
Die drei Grenzstrukturen des Sigma-Komplexes
so stellt man fest, dass die positive Ladung nicht vollständig delokalisiert ist, sondern sich an drei C-Atomen häuft.
Prof. Dyker geht in seiner Chemie-Vorlesung [1] sogar so weit, Zahlen an die C-Atome zu schreiben:
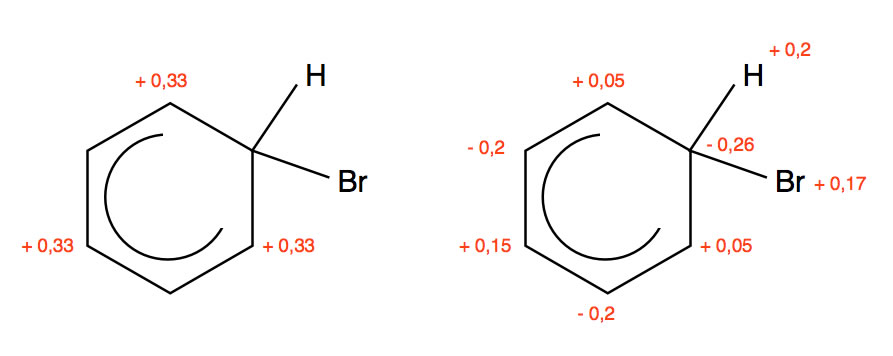
Ladungsverteilung im Sigma-Komplex nach Prof. Dyker
Links sehen wir die theoretisch erwartete Ladungsverteilung, rechts sind die tatsächlich experimentell ermittelten Werte. Für die nicht eingezeichneten H-Atome ist jeweils +0,2 zu rechnen. Kleine Überprüfung: 6 x 0,2 = 1,2 (positive Ladungen). -0,2 -0,2 -0,26 = -0,66 negative Ladungen. 0,15 + 0,05 + 0,05 + 0,17 = 0,42 positive Ladungen. Zusammen sind das 1,62 positive Ladungen minus 0,66 negative Ladungen = 0,96 positive Ladungen. Eigentlich müsste es eine ganze positive Ladung sein, aber Prof. Dyker meint, das sind Rundungsfehler, die immer vorkommen
Quellen:
- Vorlesung Organische Chemie 2.11 (auf YouTube)