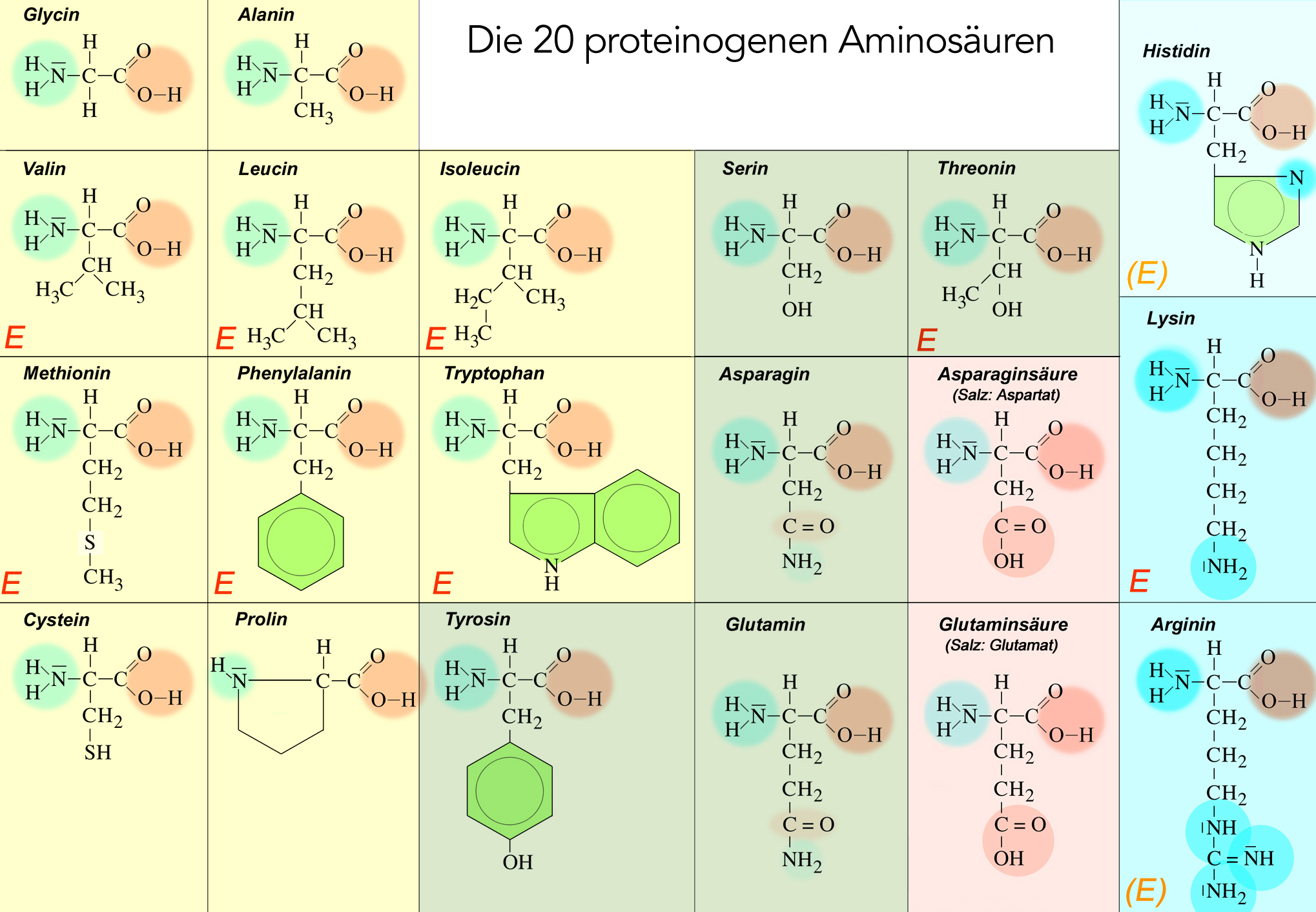
Die 20 proteinogenen Aminosäuren
In der Natur gibt es viele Aminosäuren, laut dem Spektrum-Lexikon der Biologie über 260[2], nach dem neuen Lehninger sogar über 300 [5]. Aber nur 20 davon kommen in den Peptiden und Proteinen der bekannten Lebewesen vor. Diese 20 Aminosäuren werden als proteinogene Aminosäuren bezeichnet. Wörtlich übersetzt: "Aminosäuren, aus denen Proteine entstehen". Die Aminosäuren sind in reinem Zustand farblose kristalline Stoffe, die in festem Zustand überwiegend als Zwitterionen vorliegen[1].
Wer sich zunächst einen Überblick über den Aufbau und die Eigenschaften der 20 proteinogenen Aminosäuren verschaffen möchte, geht bitte auf die Seite Aminosäuren in dem Chemie-Lexikon auf dieser Homepage. Hier werden dann grundlegende Begriffe wie Aminogruppe, Carboxygruppe, Säure/Base-Begriff etc. erklärt.
Wer sich für die Chemie der Aminosäuren interessiert, also beispielsweise für die verschiedenen pKS-Werte der sauren Gruppen oder für Stereoisomerie, geht auf diese Seite in dem Chemie-Lexikon.
Einteilung der 20 proteinogenen Aminosäuren
Nach Römpp [1], Alberts [4] und anderen Quellen werden die 20 Aminosäuren in vier Gruppen eingeteilt:
- Ungeladene unpolare Aminosäuren
- Ungeladene polare Aminosäuren
- Positiv geladene basische Aminosäuren
- Negativ geladene saure Aminosäuren
Im aktuellen Lehninger werden die Aminosäuren in fünf Gruppen aufgeteilt [5]:
- Ungeladene unpolare Aminosäuren
- Ungeladene polare Aminosäuren
- Aminosäuren mit aromatischen Seitengruppen
- Positiv geladene Aminosäuren
- Negativ geladene Aminosäuren
Ich habe auf dieser Seite die Aminosäuren in acht Gruppen eingeteilt, ob das sinnvoll ist, sei mal dahingestellt, aber die Einteilung in vier oder fünf Gruppen ist nicht in Stein gemeißelt.
- Aminosäuren mit Alkyl-Resten
- Aminosäuren mit einer OH-Gruppe im Rest
- Aminosäuren mit einem S-Atom im Rest
- Aminosäuren mit einem basischen Rest
- Aminosäuren mit einem sauren Rest
- Aminosäuren mit einer CONH2-Gruppe im Rest
- Aminosäuren mit einem aromatischen Rest
- Eine Aminosäure mit einem zyklischen Aufbau
Noch während seines Studiums hat Mathias Bader ein Projekt initiiert, bei dem man Software-unterstützt die 20 proteinogenen Aminosäuren lernen kann. Dieses Projekt ist über die Jahre weiter gewachsen. Sie sollten sich die Webseiten unbedingt einmal anschauen!
1. Aminosäuren mit Alkyl-Resten
Hier die fünf Vertreter dieser Gruppe:
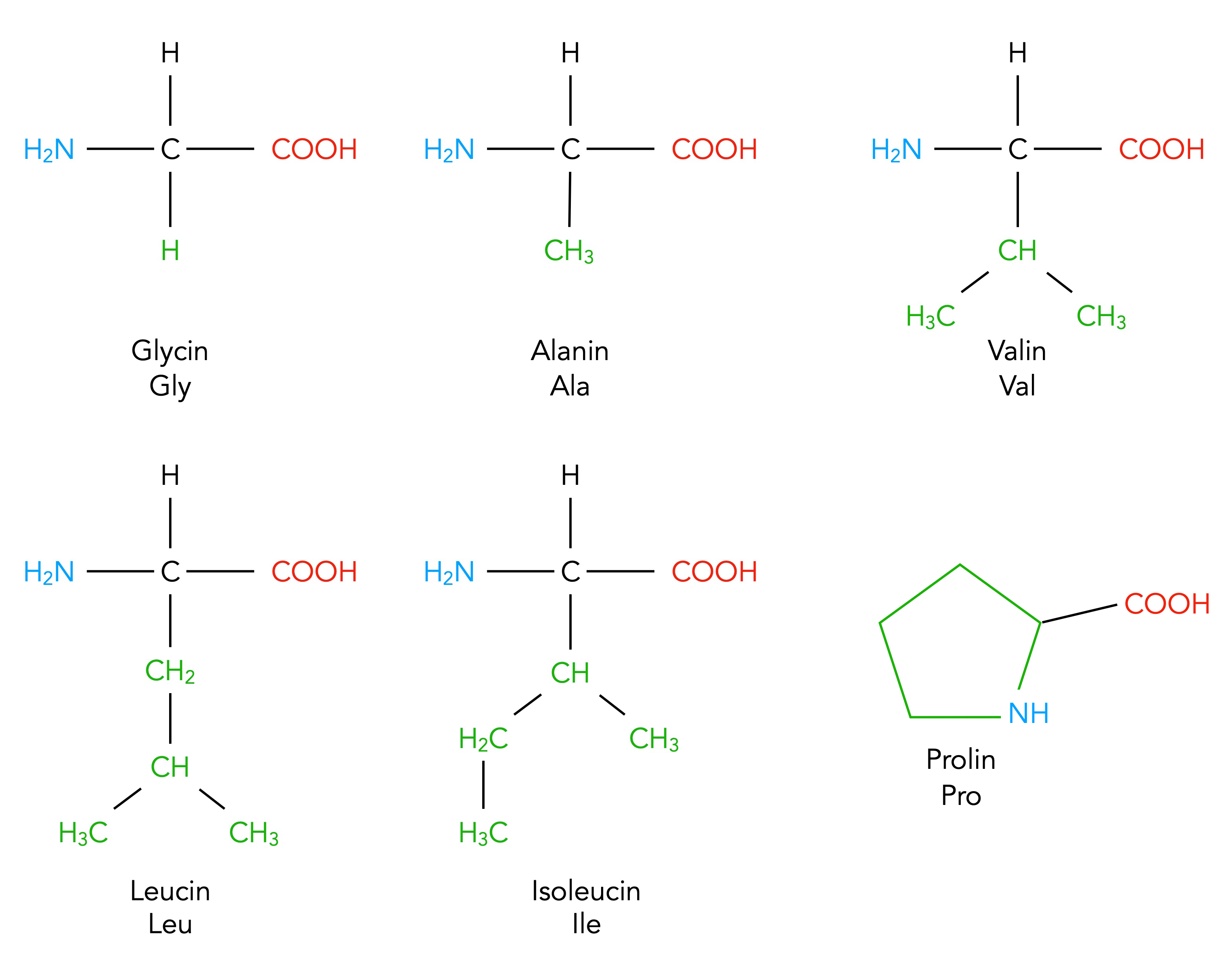
Die unpolaren und ungeladenen Aminosäuren Glycin, Alanin, Valin, Leucin und Isoleucin
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Chemisch gesehen gehören diese fünf zu den ungeladenen und unpolaren Aminosäuren, also zu der Gruppe 1 nach den meisten Lehrbüchern.
2. Aminosäuren mit einer OH-Gruppe im Rest
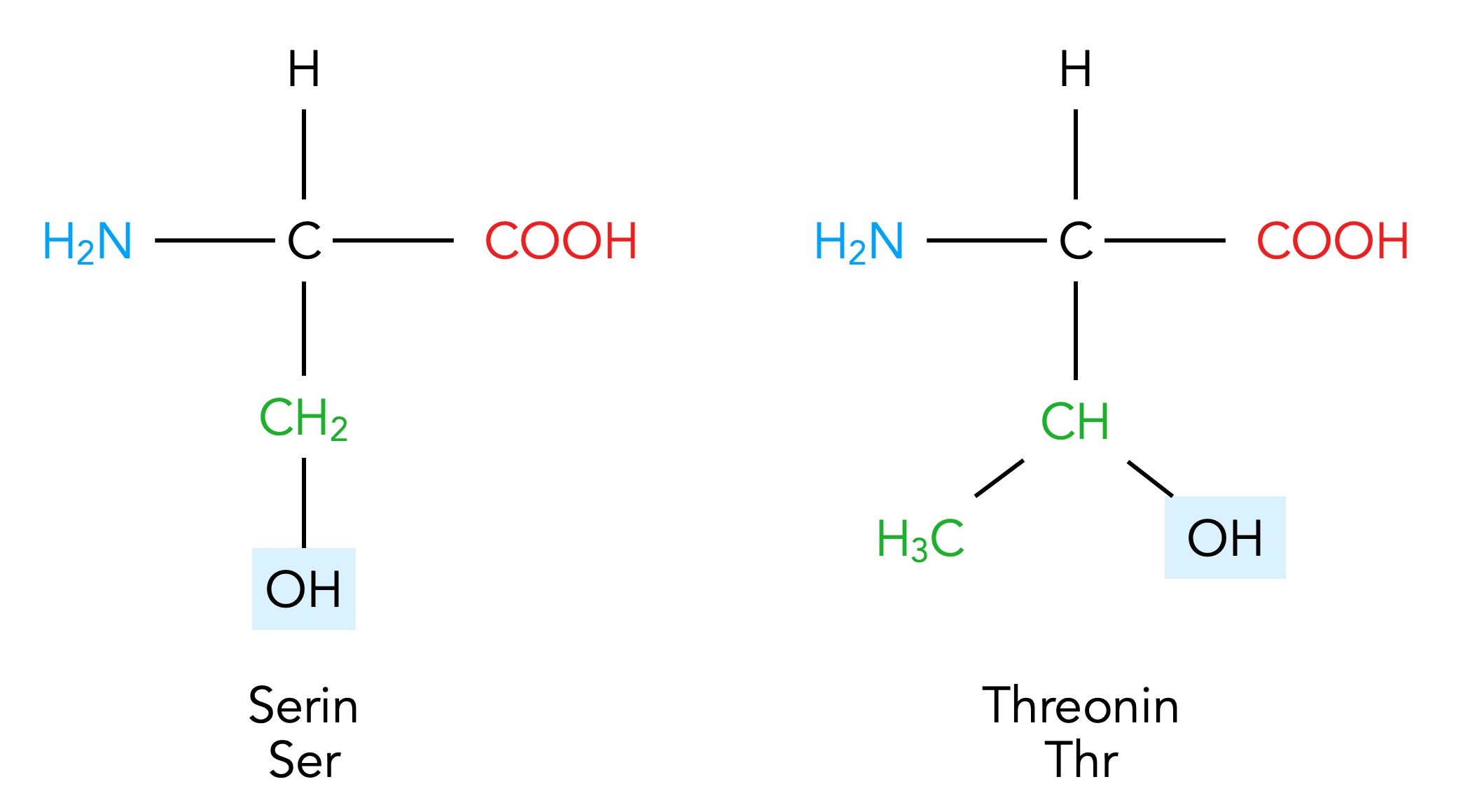
Die polaren und ungeladenen Aminosäuren Serin und Threonin
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Serin und Threonin haben beide eine OH-Gruppe in der Seitenkette. Hydroxygruppen (OH-Gruppen) haben ein stark elektronegatives O-Atom und sind daher recht polar - das kennt man auch von Alkoholen her und natürlich vom Wasser-Molekül, das ja ein starker Dipol ist. Wegen der stark polaren OH-Gruppe ist dann auch die Seitenkette und damit die gesamte Aminosäure polar. Man achte aber darauf, dass in den Seitenkette von Serin und Threonin keine elektrische Ladung vorkommen. Daher gehören diese beiden Aminosäuren zu den zwar polaren aber ungeladenen Aminosäuren. Das entspricht dann der zweiten Gruppe nach der Einteilung von Römpp, Alberts, Lehninger etc.
Threonin ist übrigens die Aminosäure, die von allen 20 Aminosäuren zuletzt entdeckt wurde, nämlich erst 1938 [5].
3. Aminosäuren mit einem S-Atom im Rest
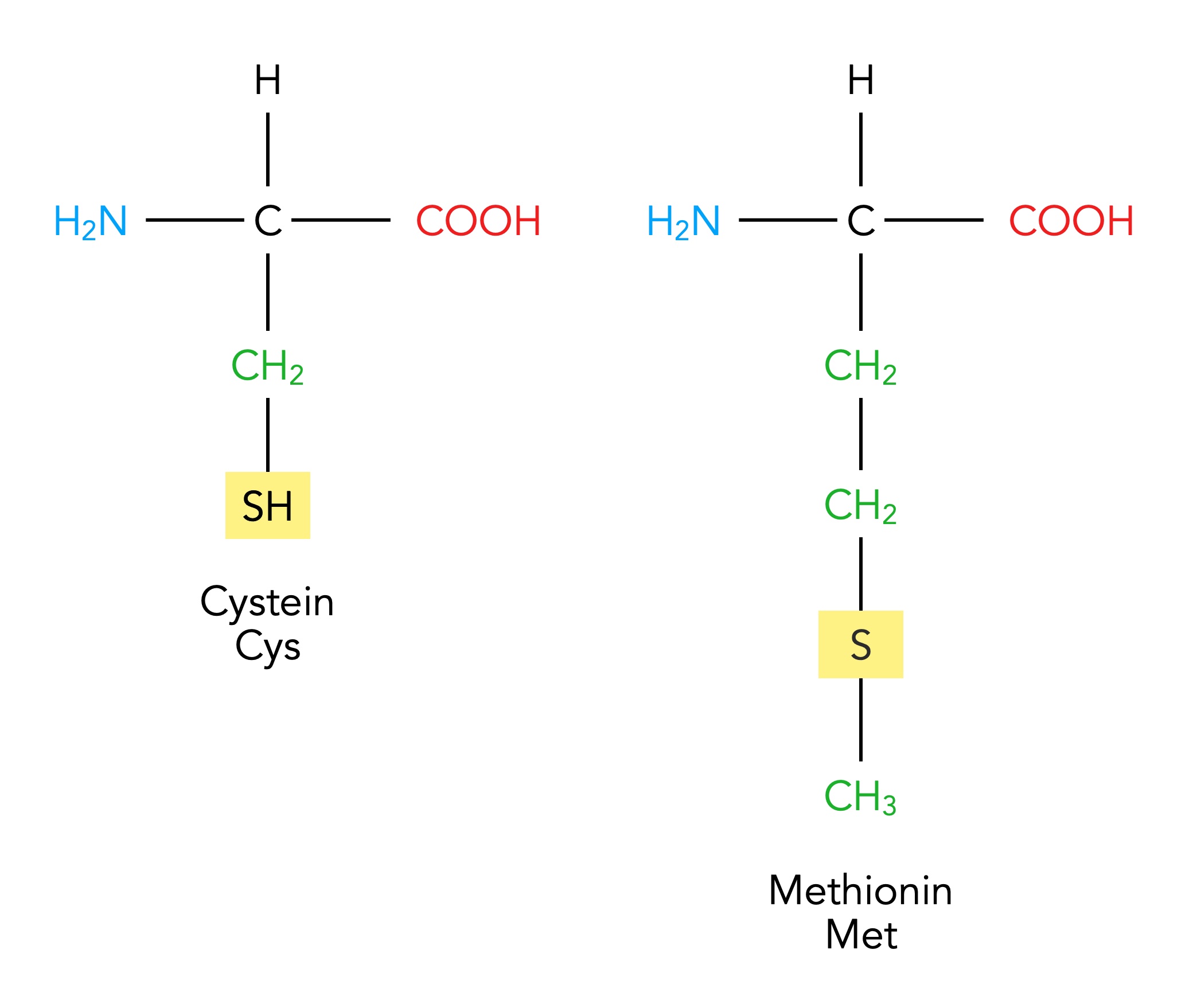
Die polaren Aminosäuren Cystein und Methionin
Autor: Ulrich Helmich, Lizenz: Public domain
Eng verwandt mit dem Serin ist das Cystein, eine äußerst wichtige Aminosäure, wie wir später noch sehen werden. Hier ist die OH-Gruppe in der Seitenkette durch eine SH-Gruppe ausgetauscht. Die Seitenkette von Cystein ist nicht ganz so stark polar wie die Seitenkette von Serin, weil das Schwefel-Atom eine geringere Elektronegativität hat als das Sauerstoff-Atom.
Eine zweite Aminosäure mit einem Schwefel-Atom in der Seitenkette ist das Methionin, hier ist der Rest ebenfalls leicht polar und ungeladen. Also würde man die Aminosäuren Cystein und Methionin auch bei der zweiten Gruppe nach Römpp, Alberts etc. einordnen. Wegen des Schwefel-Atoms habe ich für diese beiden Aminosäuren aber eine eigene Gruppe gebildet. Vor allem auch wegen der besonderen Bedeutung von Cystein, wie wir im folgenden Abschnitt sehen werden.
Cystein kann Disulfidbrücken bilden
Die Aminosäure Cystein kann sich mit einem zweiten Cystein-Molekül zusammentun und dann eine Doppel-Aminosäure namens Cystin bilden:
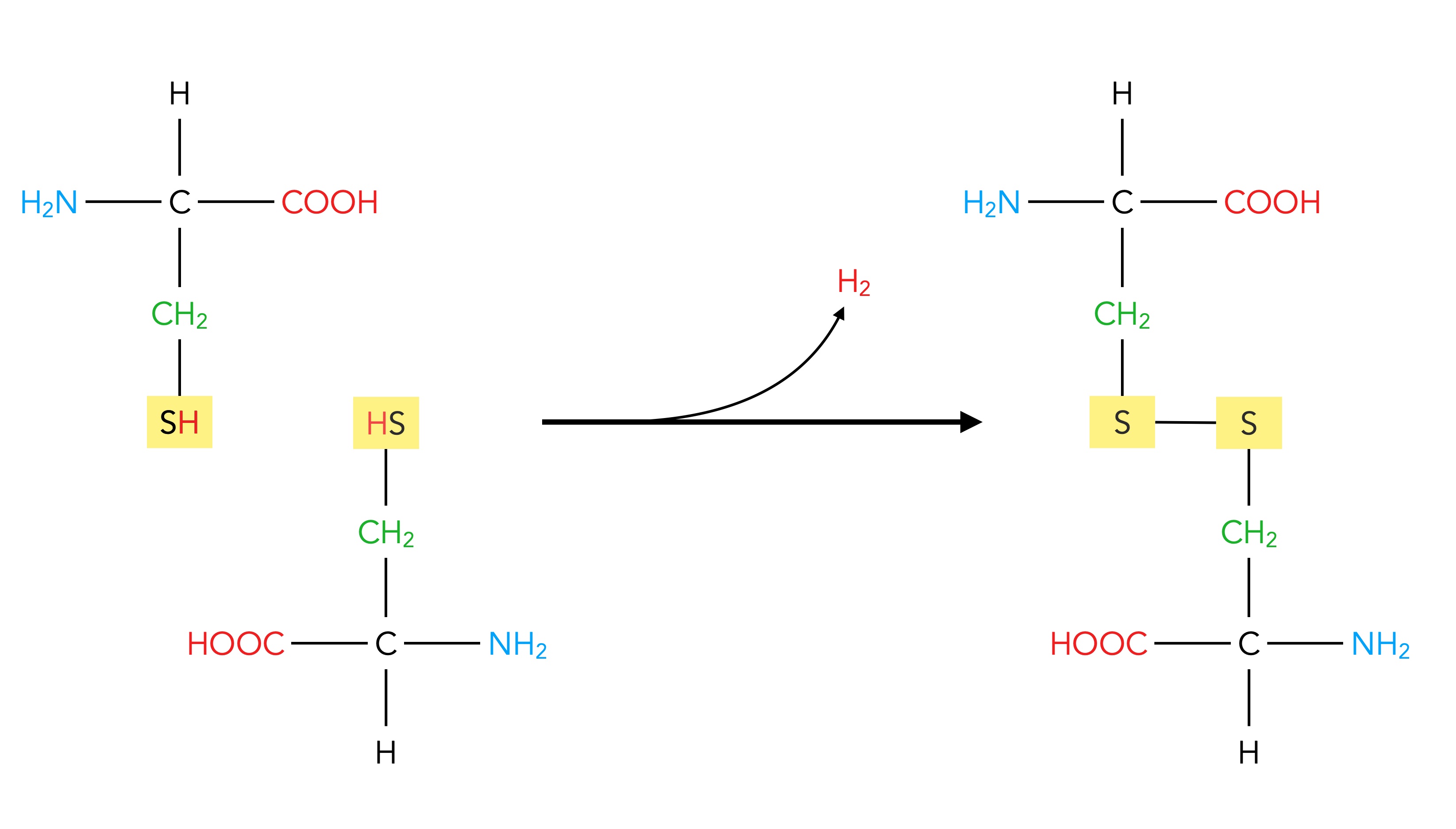
Das Cystin-Molekül entsteht aus zwei Cystein-Molekülen
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Bei dieser Reaktion treten die beiden H-Atome der beiden SH-Gruppen als Wasserstoff H2 aus - bei biochemischen Vorgängen wird natürlich kein gasförmiger Wasserstoff freigesetzt, sondern der Wasserstoff wird an Coenzyme gebunden.
Die Brücke aus zwei Schwefel-Atomen, welche die beiden Cystein-Moleküle verbindet, wird als Disulfidbrücke bezeichnet. Disulfidbrücken kommen in fast jedem Protein vor und stabilisieren die Tertiärstruktur des Proteins.
4. Aminosäuren mit einem basischen Rest
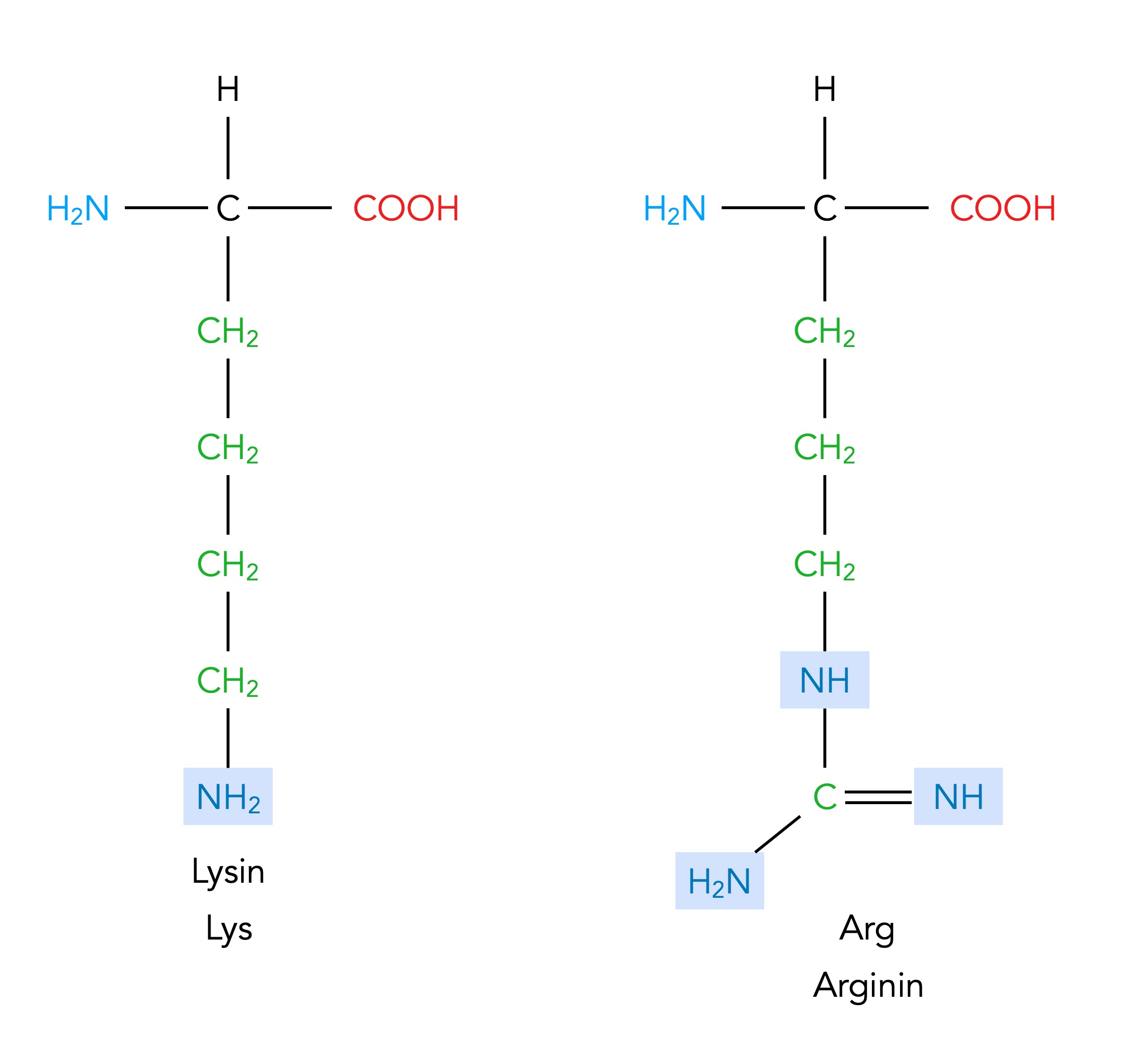
Zwei basische Aminosäuren: Lysin und Arginin
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Auf diesem Bild sieht man zwei Aminosäuren, deren Seitenketten Aminogruppen enthalten.
Lysin und Arginin können Ionenbindungen bilden
Eine NH2-Gruppe besitzt am elektronegativen N-Atom ein freies Elektronenpaar und kann daher leicht ein Proton aufnehmen. In der Chemie nennt man eine solche Gruppe Protonenakzeptor oder Brönsted-Base. Daher bezeichnet man die beiden Aminosäuren Lysin und Arginin als basische Aminosäuren.
Durch die Protonenaufnahme wird aus der NH2-Gruppe dann eine positiv geladenen NH3+-Gruppe:
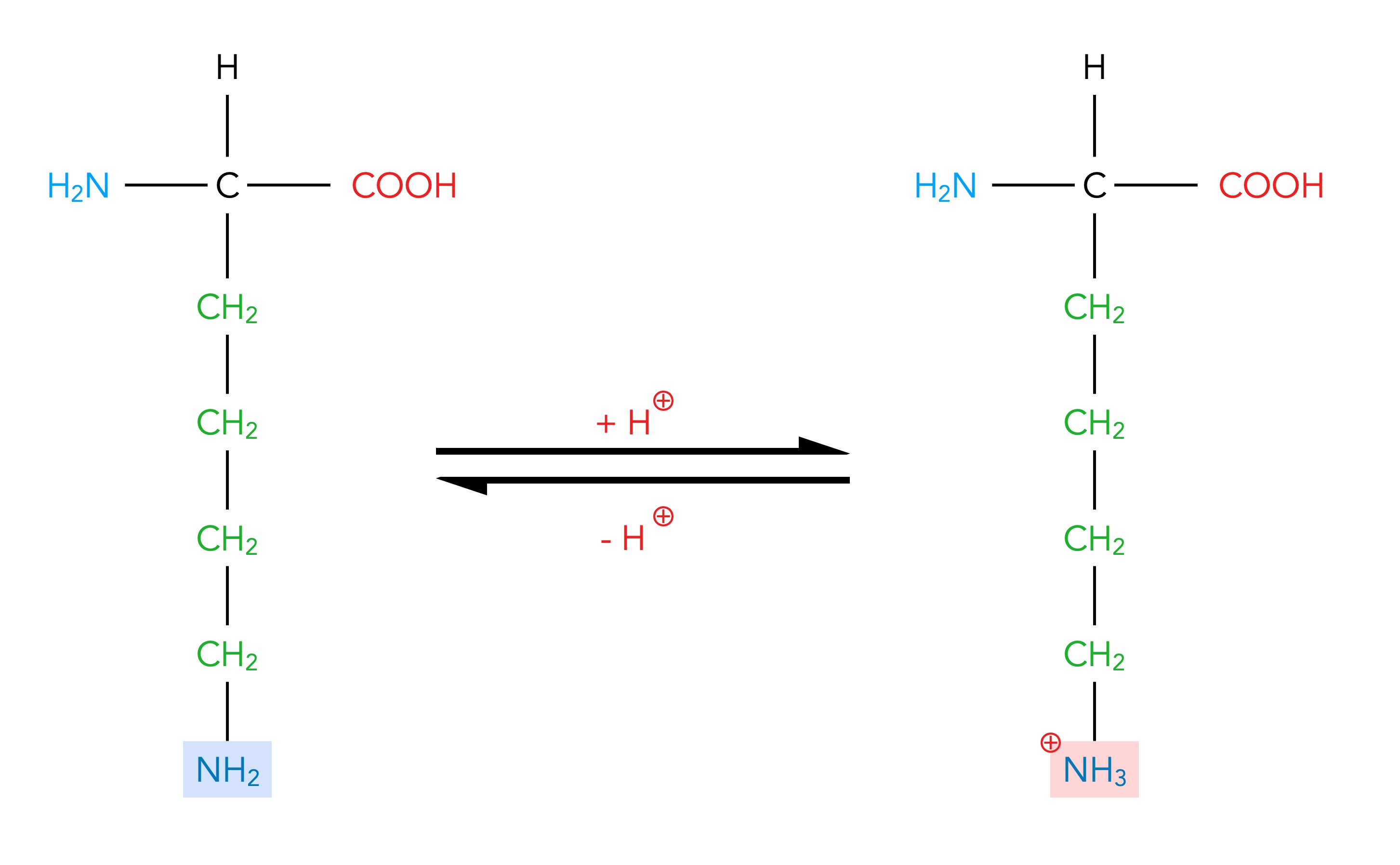
Protonenaufnahme einer basischen Aminosäure
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Wie man an dem Gleichgewichtspfeil in der Abbildung sieht, ist diese Protonenaufnahme der NH2-Gruppe reversibel, das heißt, die NH3+-Gruppe kann das Proton auch leicht wieder abgeben.
Für Profis:
Lysin und Arginin sind die beiden einzigen Aminosäuren, die tatsächlich ein basisches Verhalten zeigen. Dabei ist Arginin die stärkere Base von den beiden. Ist die NH2-Gruppe von Arginin durch die Aufnahme eines Protons positiv geladen, so kann diese positive Ladung über drei N-Atome verteilt werden:
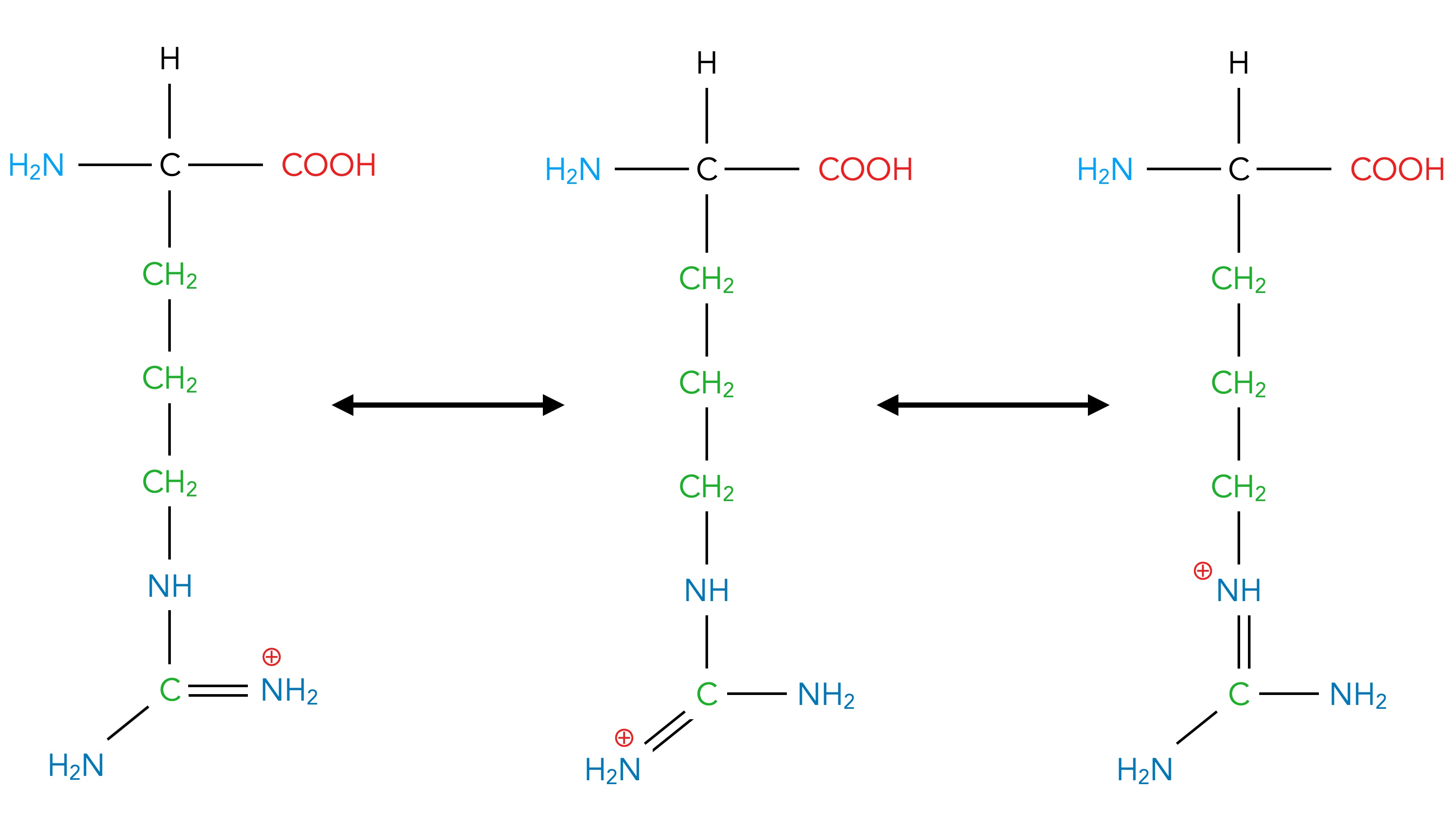
Die drei Grenzstrukturen der positiv geladenen Arginin-Seitenkette
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Diese Delokalisierung der positiven Ladung stabilisiert die Seitenkette [4]. Beim Lysin mit nur einem N-Atom in der Seitenkette gibt es keine alternativen Strukturen, daher ist das Lysin-Kation nicht so stabil wie das Arginin-Kation und kann dann auch nicht so leicht gebildet werden. Lysin ist daher eine schwächere Base als Arginin.
Für Chemieprofis:
Der pKS-Wert der Arginin-Seitenkette beträgt 12,1 während der pKS-Wert der Lysin-Seitenkette 10,28 ist. Die Lysin-Seitenkette ist also eine ca. 100 mal stärkere Säure bzw. eine 100 mal schwächere Base.
Histidin, eine Aminosäure, die bei Punkt 7 näher beschrieben wird, gehört nach Alberts [4] ebenfalls zu den basischen Aminosäuren. Allerdings ist Histidin nur sehr schwach basisch. Der pKS-Wert der Histidin-Seitenkette beträgt 6,0 - die Seitenkette ist also eine 10.000 mal schwächere Base als Lysin.
5. Aminosäuren mit einem sauren Rest
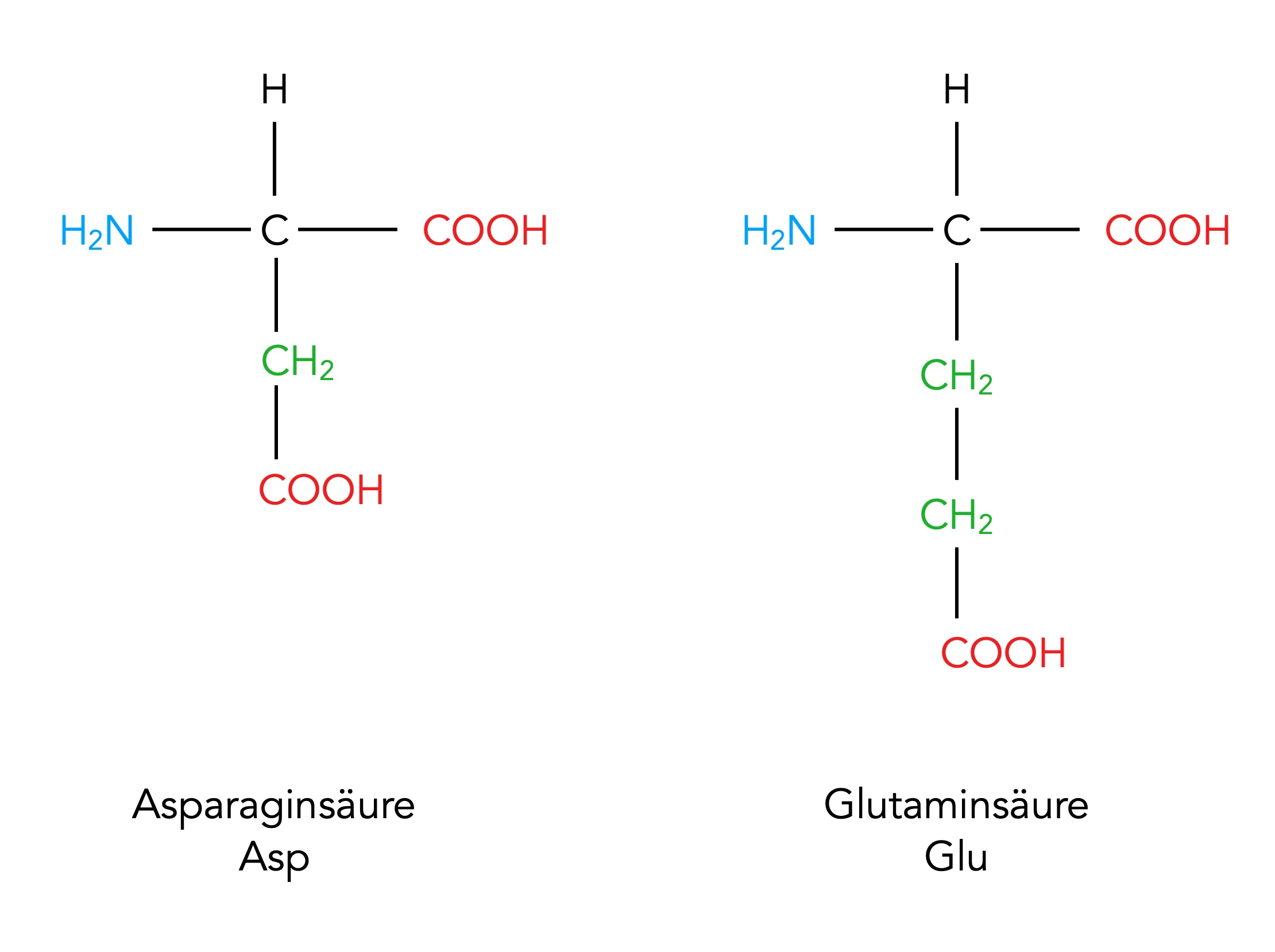
Zwei saure Aminosäuren: Asparaginsäure und Glutaminsäure
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Auf diesem Bild sieht man die Aminosäuren Asparaginsäure und Glutaminsäure, deren Seitenketten Carboxygruppen enthalten. Unter geeigneten Bedingungen (protonenarmes Lösemittel) können diese COOH-Gruppen ein Proton abgeben und werden dann zu negativ geladenen COO--Gruppen. Ist dies der Fall, trägt die Seitenkette der Aminosäure eine negative Ladung. Wegen der möglichen Protonen-Abgabe durch die Carboxygruppe werden diese Aminosäuren auch als saure Aminosäuren bezeichnet. Eine Säure ist ja definitionsgemäß ein Teilchen, das in der Lage ist, ein Proton abzugeben (ein Protonendonator).
Saure und basische Aminosäuren spielen eine wichtige Rolle bei der Stabilisierung der Tertiärstruktur eines Proteins:
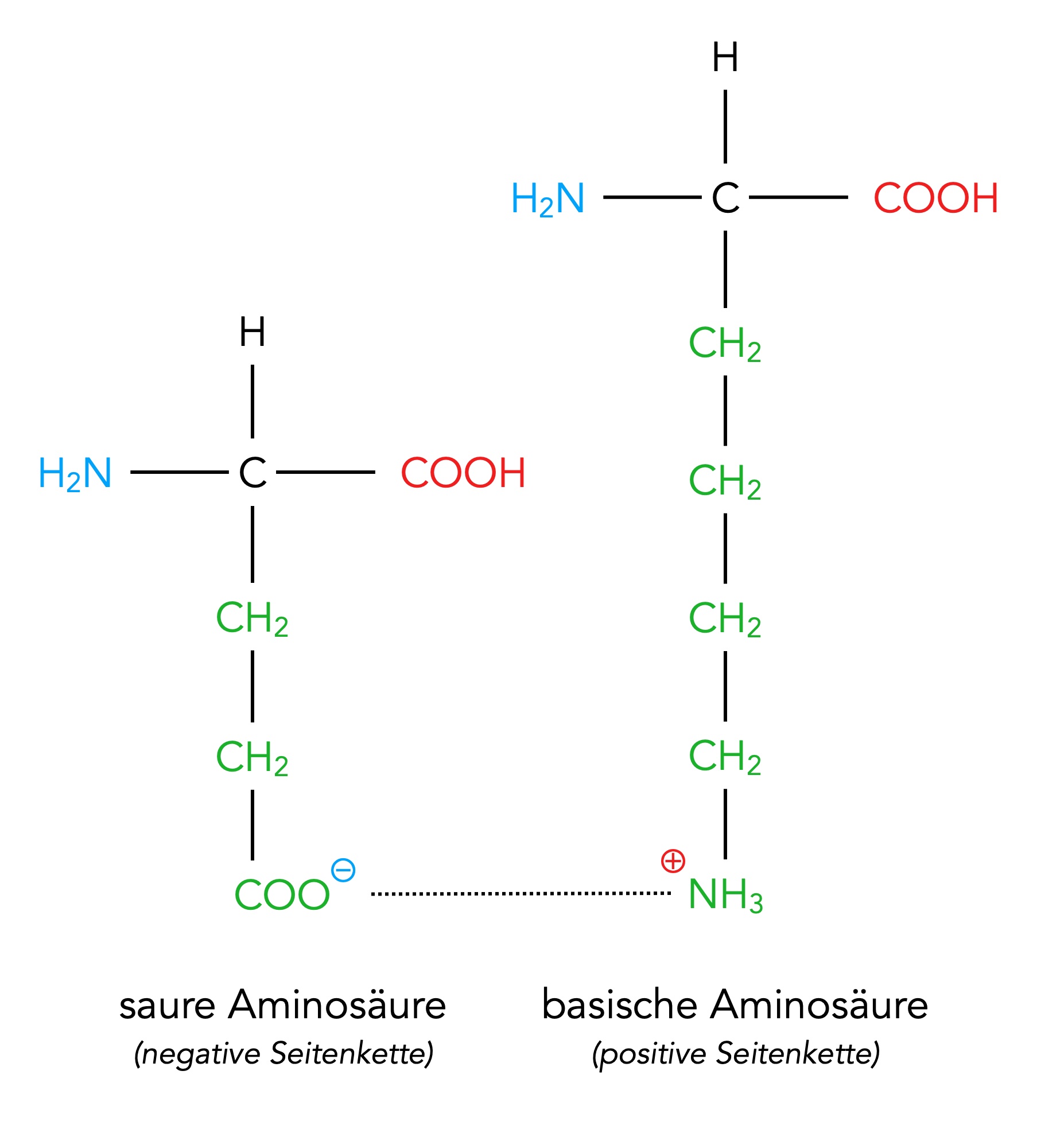
Ionenbindung zwischen einem sauren und einem basischen Aminosäure-Rest
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Saure und basische Aminosäuren, die sich an unterschiedlichen Positionen eines Proteins befinden, können sich gegenseitig anziehen, wenn sie elektrisch unterschiedlich geladene Reste besitzen. Genau wie die Disulfidbrücken stabilisieren solche Ionenbindungen zwischen Aminosäure-Resten die Tertiärstruktur bzw. Raumstruktur eines Proteins.
6. Aminosäuren mit einer CONH2-Gruppe im Rest
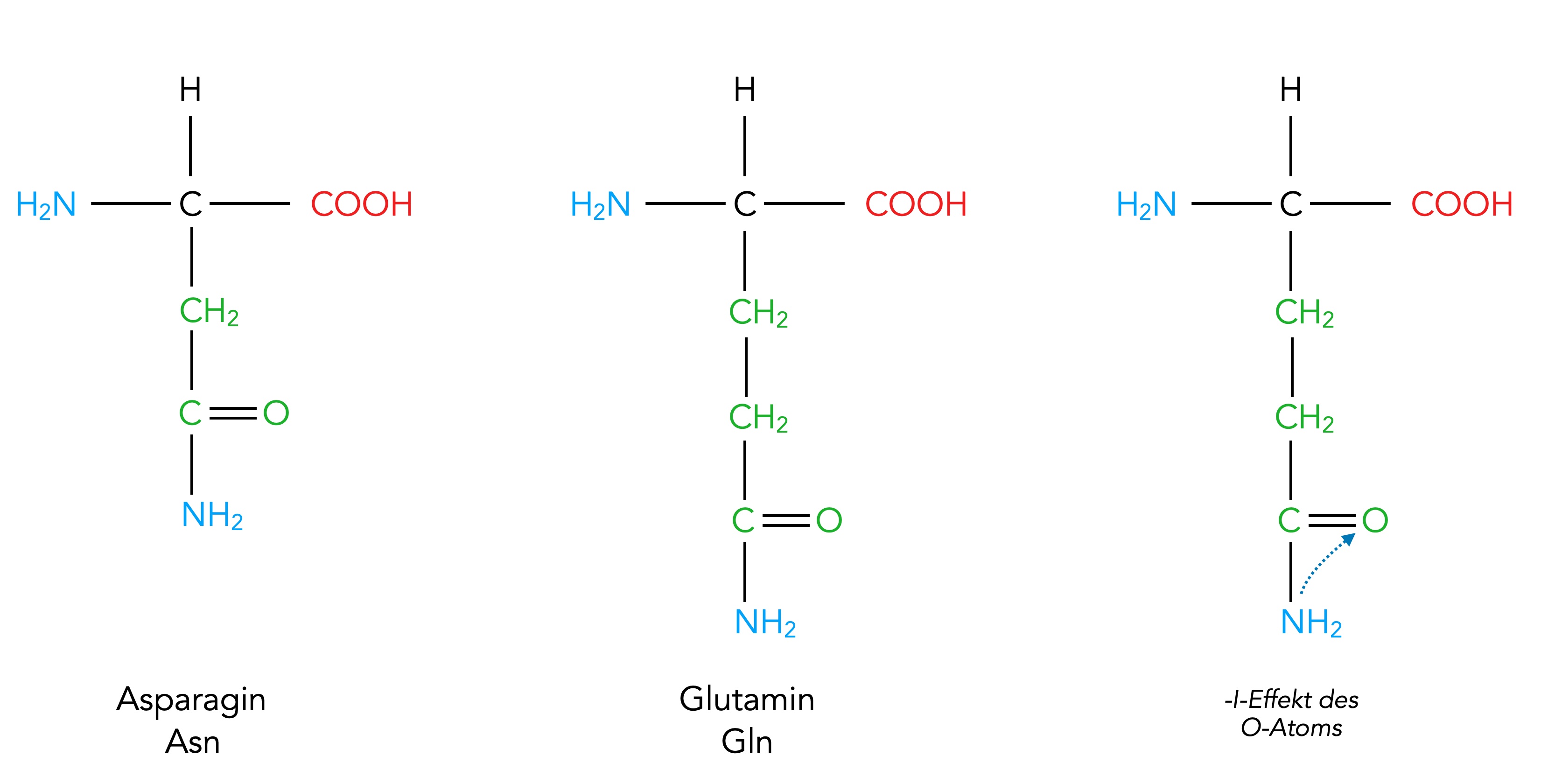
Zwei Aminosäuren mit polaren ungeladenen Resten: Asparagin und Glutamin
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Die beiden Aminosäuren Asparagin und Glutamin sind recht interessant. Auf den ersten Blick könnte man sie für zwei weitere basische Aminosäuren halten, da sie eine Aminogruppe im Rest tragen. Sie reagieren aber nicht basisch; die C=O-Gruppe direkt vor der NH2-Gruppe erschwert die Aufnahme eines Protons durch die Aminogruppe, d.h., die Basizität der Aminosäuren ist durch die Carbonylgruppe (C=O-Gruppe) stark herabgesetzt. Ursache hierfür ist der elektronenziehende -I-Effekt des elektronegativen Sauerstoff-Atoms in der Nachbarschaft der NH2-Gruppe. Alberts [4] ordnet die beiden Aminosäuren daher zu den ungeladenen polaren Aminosäuren ein (Gruppe 2 von 4).
Asparagin ist die erste Aminosäure, die überhaupt entdeckt wurde. 1806 fanden die französischen Forscher Vauquelin und Robiquet die Aminosäure beim Eindampfen von Spargelsaft. Von diesem Gemüse hat die Aminosäure auch ihren Namen (Spargel = Asparagus).
7. Aminosäuren mit einem aromatischen Rest
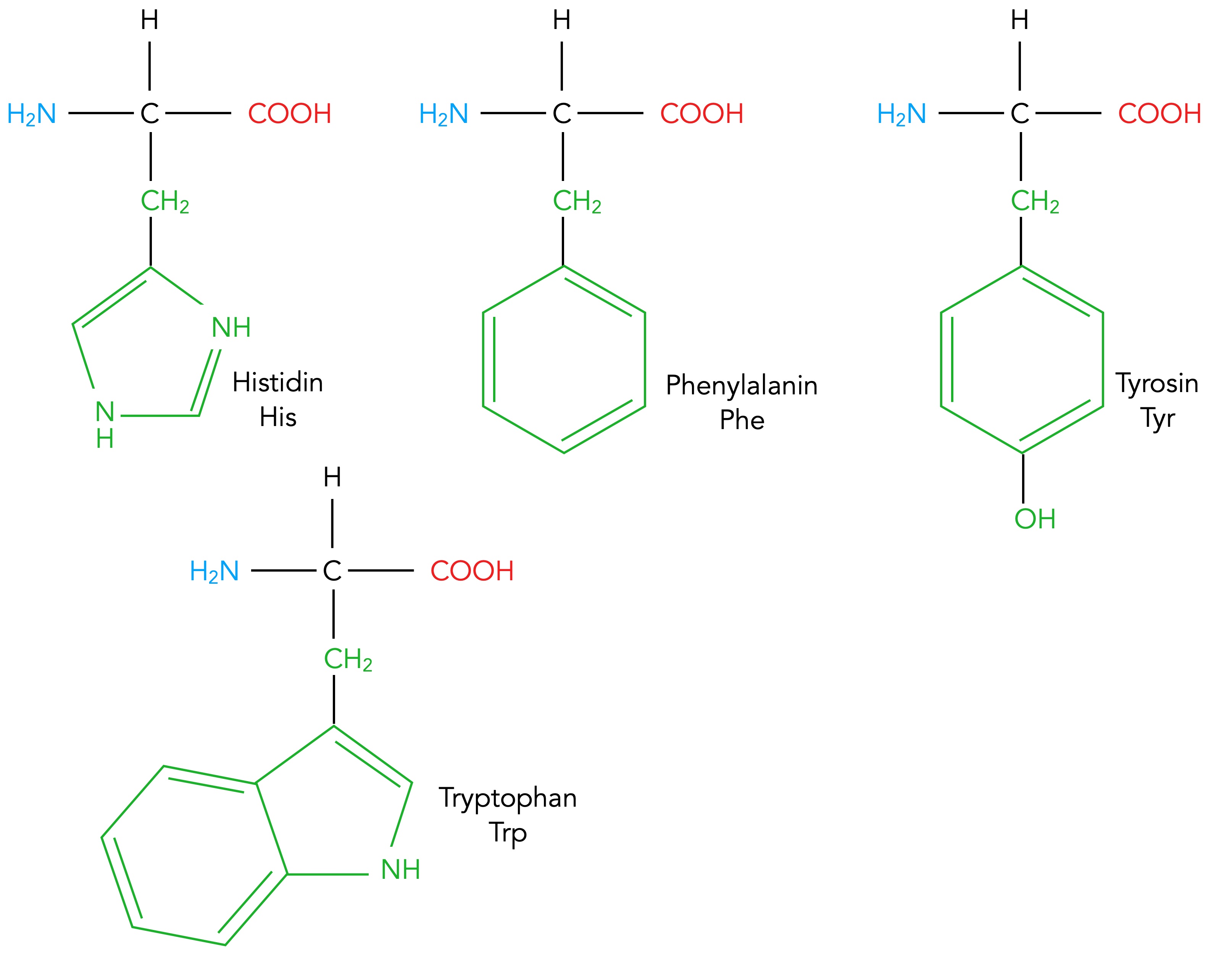
Vier Aminosäuren mit aromatischen Resten: Histidin, Phenylalanin, Tyrosin und Tryptophan
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Die vier Aminosäuren Histidin, Phenylalanin, Tryptophan und Tyrosin enthalten aromatische Reste. Das heißt jetzt nicht, dass sie besonders gut riechen, sondern die Reste enthalten ein Ringmolekül, das den Kriterien des aromatischen Zustandes entspricht. Das Tyrosin hat noch eine OH-Gruppe am Benzolring hängen und besitzt daher einen leicht polaren Rest, wird daher von Alberts [4] bei den Aminosäuren mit einem ungeladenen polaren Rest eingeordnet.
8. Zwei ungewöhnliche Aminosäuren
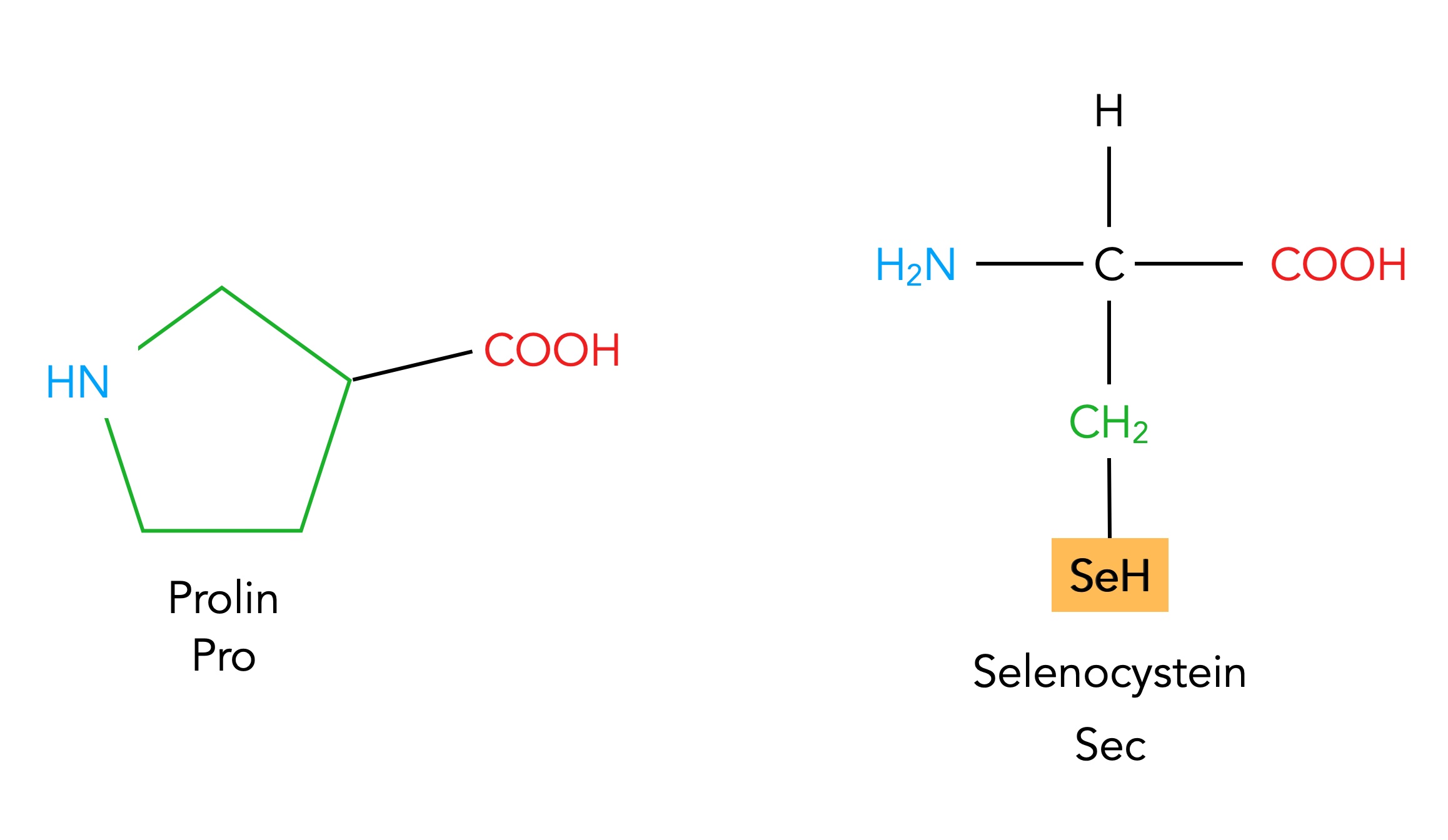
Die Aminosäuren Prolin und Selenocystein
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Die Aminosäure Prolin lässt sich nur ganz schwer einordnen. Sie hat einen Aufbau, der von dem allgemeinen Bau der Aminosäuren abweicht. Prolin besitzt nämlich keine freie Aminogruppe, sondern die Aminogruppe ist in einen fünfgliedrigen Ring aus vier C-Atomen und einem N-Atom integriert, an dem dann die Carboxygruppe sitzt. Nach Alberts [4] gehört Prolin zu den Aminosäuren mit einem unpolaren Rest, also zur Gruppe 1.
Selenocystein schließlich ist eine Aminosäuren, die nur ganz selten in der Natur vorkommt. Im Grunde handelt es sich um ein Cystein-Moleküls, bei dem das S-Atom durch ein Se-Atom ersetzt wurde. Oft wird Selenocystein mit zu den biogenen bzw. proteinogenen Aminosäuren dazu gezählt, deren Anzahl sich dann von 20 auf 21 erhöht.
Für Biologie-Profis
Einen genetischen Code für diese 21. Aminosäure Selenocystein gibt es eigentlich nicht. Wenn ein Lebewesen diese Aminosäure benötigt, wird dazu das Stopcodon UGA quasi umprogrammiert. Selenocystein ist quer über alle Eukaryoten- und Prokaryotenstämme verbreitet. Man kennt inzwischen mehr als 30 eukaryotische und mehr als 15 prokaryotische Proteine, in denen die Aminosäure Selenocystein vorkommt [6].
Die 20 biogenen Aminosäuren
Hier ein Überblick der 20 Aminosäuren, die in Lebewesen eine Rolle spielen:
Auf diesem Bild sind die 20 Aminosäuren farbig nach der Einteilung von Römpp, Alberts etc. unterlegt:
- Gelb = ungeladene unpolare Aminosäuren
- Grün = ungeladene polare Aminosäuren
- Rot = negativ geladene saure Aminosäuren
- Blau = positiv geladene basische Aminosäuren (Histidin hellblau, da kaum basisch)
Die negativen bzw. positiven Ladungen der Gruppen 3 und 4 wurden hier nicht mit eingezeichnet, aber man kann sich ja leicht denken, dass die COOH-Gruppen ein Proton abgeben und die NH2-Gruppen eines aufnehmen können.
Die Markierung (E) ist ein Hinweis für die Leute aus dem Fach Ernährungslehre. Das (E) steht für essentiell. Diese Aminosäuren müssen mit der Nahrung aufgenommen werden, weil sie der menschliche Stoffwechsel nicht selbst aus anderen Aminosäuren, Zuckern oder sonstigen Verbindungen herstellen kann.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992, Artikel "Aminosäuren".
- Spektrum Lexikon der Biologie, Artikel "Aminosäuren" 1999
- Wikipedia, Artikel zu den einzelnen Aminosäuren
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Wikipedia, Artikel "Selenocystein".
Seitenanfang -
Weiter mit Eigenschaften der Aminosäuren...