Das beta-Faltblatt
Schon in den 30er Jahren des 20. Jahrhunderts stellte William Astbury (1889-1961) bei seinen Röntgenstruktur-Untersuchungen an kristallisierten Proteinen fest, dass viele Proteine regelmäßige Bereiche enthalten. Der Begriff der Wasserstoffbrücken-Bindung war zu der Zeit schon bekannt, und Astbury nahm an, dass solche H-Brücken an der Bildung dieser regelmäßigen Bereiche beteiligt sind. 1951 entwickelten Linus Pauling, Robert B. Corey und Herman Branson das Modell der alpha-Helix. Kurze Zeit später entdeckten Pauling und Corey eine weitere regelmäßige Sekundärstruktur in Proteinen und bezeichneten diese als beta-Faltblatt-Struktur.
Während die Aminosäure-Kette in der α-Helix spiralförmig gewunden ist, liegt sie in der β-Faltblatt-Struktur ausgestreckt vor, also als lange lineare Kette, die auch als β-Kette oder β-Strang bezeichnet wird:

Ein Hexapeptid als β-Kette
Autor: Ulrich Helmich, Lizenz: Public domain
Oben sehen Sie ein Molekül-Modell einer solchen β-Kette. Die Seitenketten werden durch grüne Kugel repräsentiert. Achten Sie darauf, dass sich die Seitenketten der Aminosäuren in trans-Position zueinander befinden.
Die violetten Bindungen sind eigentlich 1,5-fach Bindungen, sowohl das C-Atom wie auch das N-Atom der Peptidbindung ist sp2-hybridisiert, die Bindungselektronen sind innerhalb des violett gekennzeichneten Bereich delokalisiert, die Bindungswinkel innerhalb der Peptidbindung sind starr und betragen 120º. Daher liegen die vier Atome der Peptidbindung in einer Ebene.
Die langen β-Ketten können auf vielfältige Weise angeordnet sein. Ein β-Faltblatt entsteht, wenn mindestens zwei β-Ketten durch H-Brücken miteinander verbunden werden. In einem solchen β-Faltblatt können die β-Ketten entweder parallel oder antiparallel verlaufen.
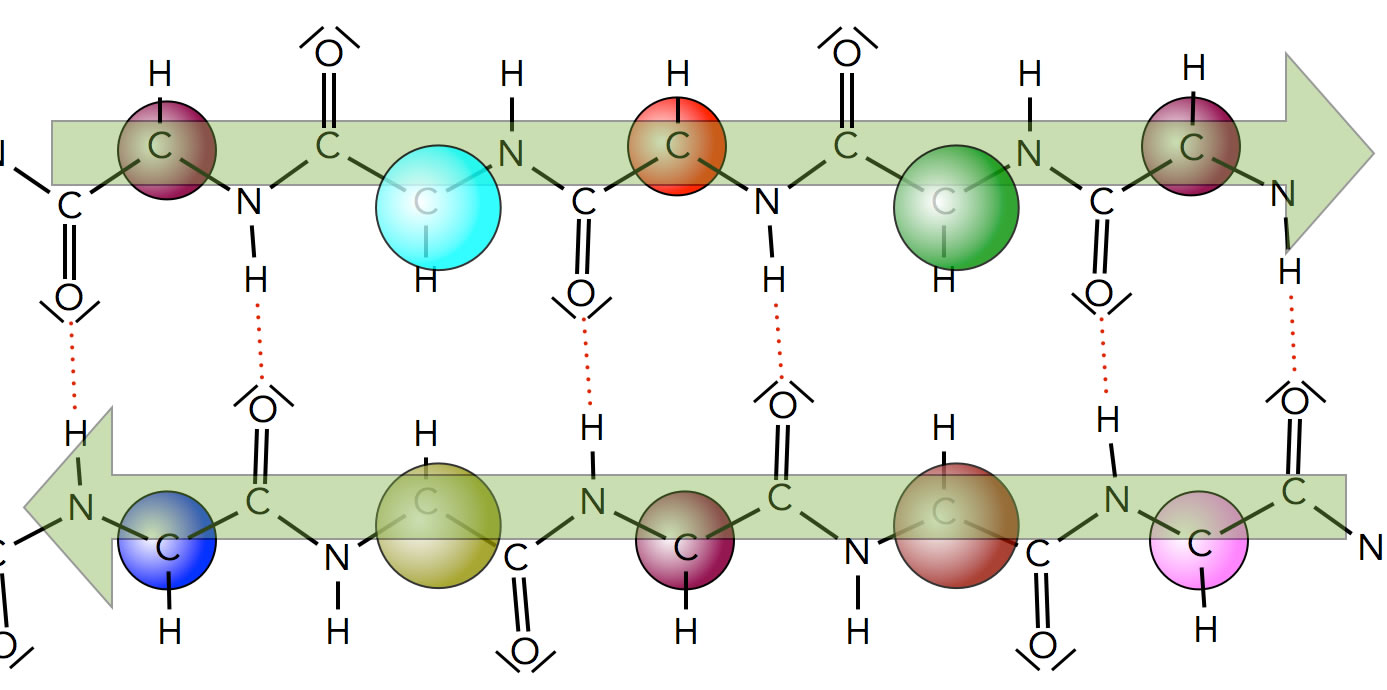
Ein antiparalleles β-Faltblatt
Autor: Ulrich Helmich, Lizenz: Public domain
Bei dem antiparallelen β-Faltblatt sind zwei Peptidketten in entgegengesetzt verlaufender Richtung angeordnet. In einem parallelen Faltblatt verlaufen beide Ketten dagegen in der gleichen Richtung.
Strukturell unterscheiden sich die beiden Anordnungen etwas. Das parallele Faltblatt ist etwas kürzer als das antiparallele, und die H-Brücken in dem antiparallelen Faltblatt sind wesentlich geordneter als die im parallelen Faltblatt [1].
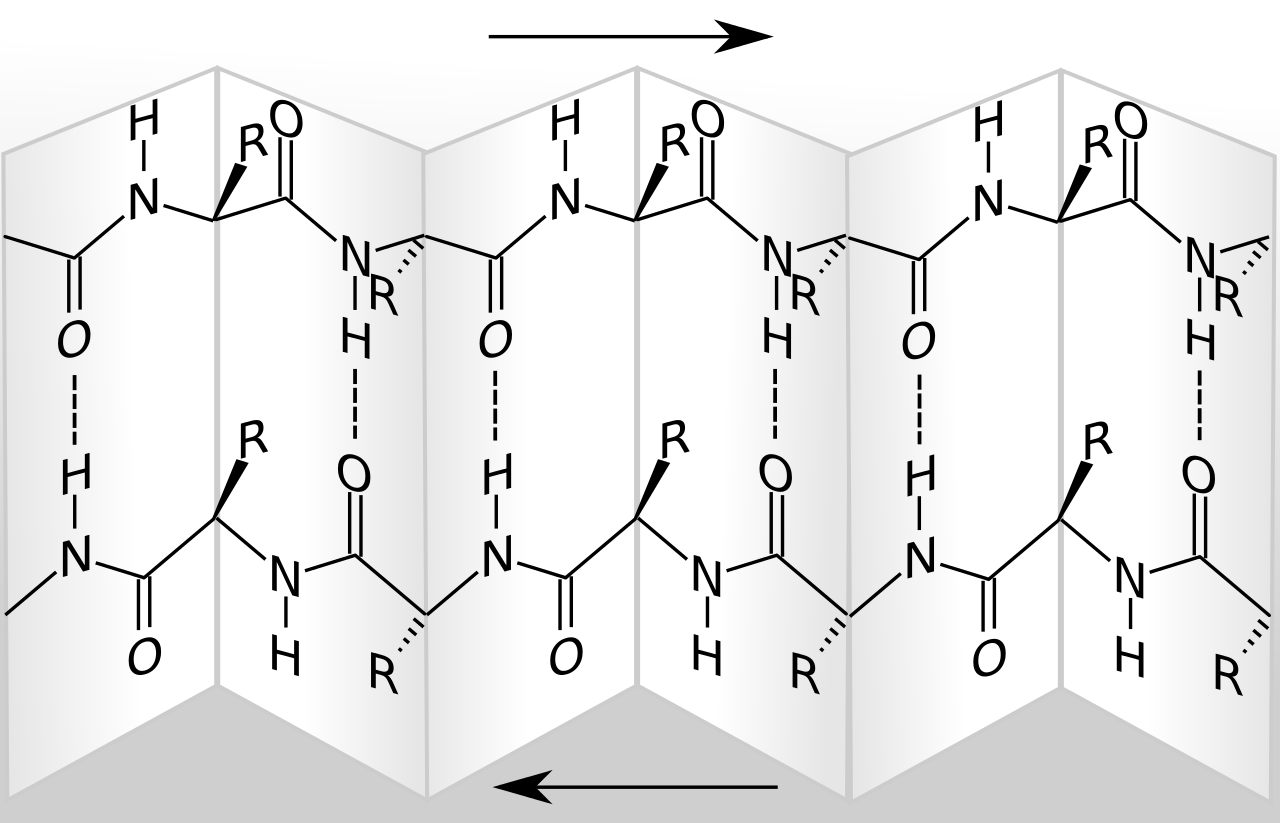
Darstellung eines antiparallelen β-Faltblattes
Roland.chem, CC0, via Wikimedia Commons
Dieses Bild aus der Wikipedia verdeutlicht, warum man diese Sekundärstruktur als "Faltblatt" bezeichnet. Die Darstellung soll an ein gefaltetes Blatt Papier erinnern.
Meistens sind mehr als zwei β-Ketten zu einer Faltblattstruktur verbunden.
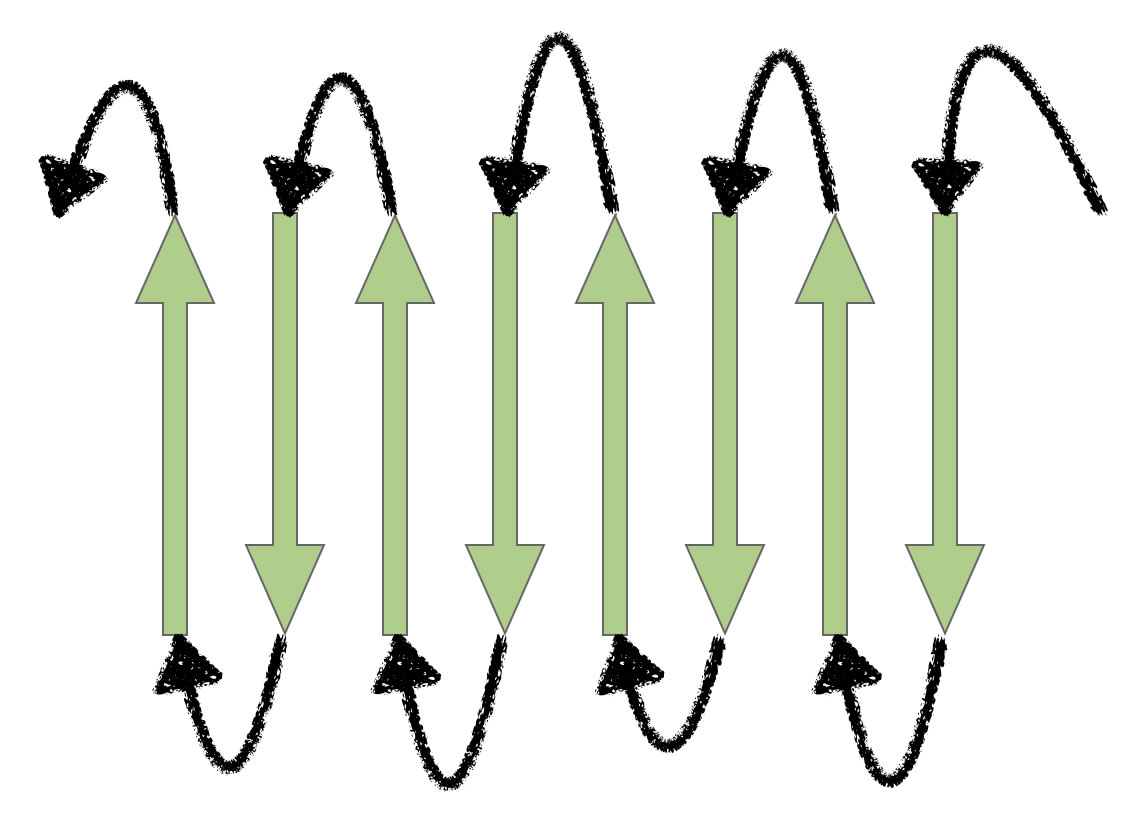
Ein häufiges β-Faltblatt-Motiv in Proteinen
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sieht man ein Motiv, das in vielen Proteinen vorkommt, vor allem in Transmembranproteinen, die also die gesamte Zellmembran durchziehen. In der Abbildung sind die acht β-Stränge antiparallel und flächig angeordnet, also in einer Ebene. Stellen Sie sich nun vor, diese Ebene würde aufgerollt zu einer Röhre. Das käme einem wirklichen Protein schon viel näher als die einfache Zeichnung in der Abbildung oben.
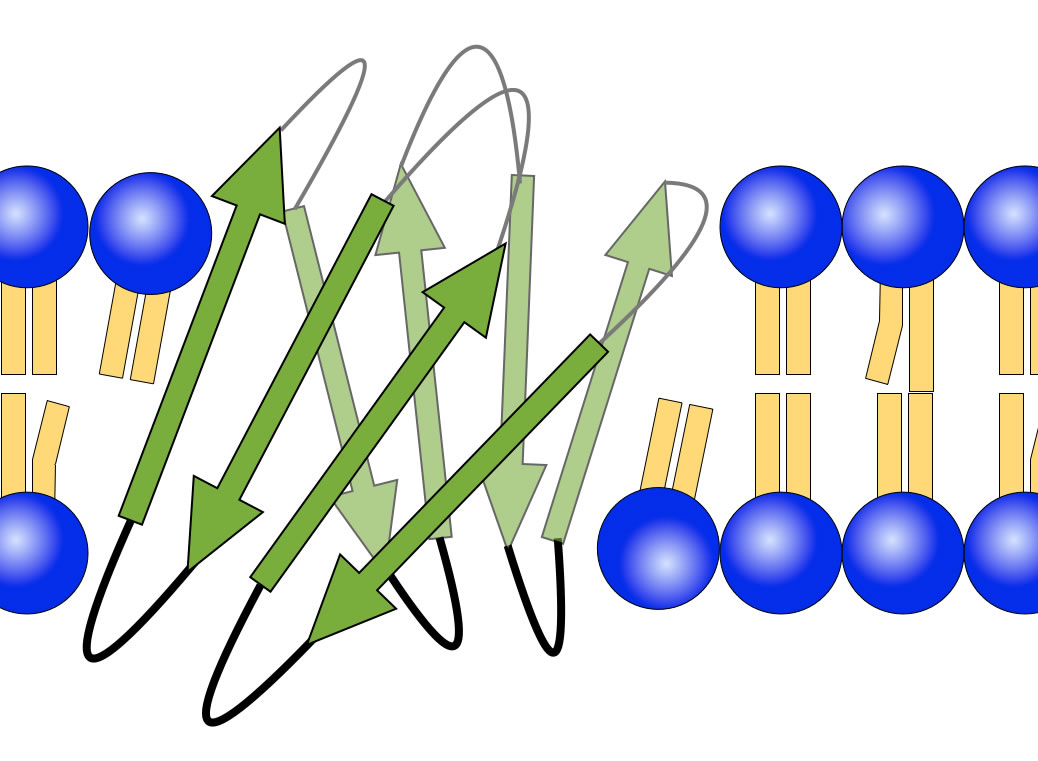
So könnten mehrere β-Faltblätter ein Transmembranprotein in der Membran verankern
Autor: Ulrich Helmich, Lizenz: Public domain
Die obige Zeichnung ist vielleicht etwas "frei erfunden", aber so ähnlich könnte ein Motiv aus mehreren Faltblättern ein Transmembranprotein in der Membran verankern.
Es gibt aber auch viele Faltblatt-Strukturen in Proteinen, die aus mehreren beta-Strängen bestehen, die teils parallel, teils antiparallel angeordnet sind (also reichlich ungeordnet).
Die einzelnen beta-Stränge eines beta-Faltblattes können in der Primärstruktur des Proteins nahe beieinander liegen (A), sie können aber auch weit entfernt sein (B). Es ist sogar möglich, dass beta-Stränge eines Faltblattes in verschiedenen Untereinheiten einer Quartärstruktur lokalisiert sind (C), wie auf der folgenden Zeichnung stark schematisch dargestellt:
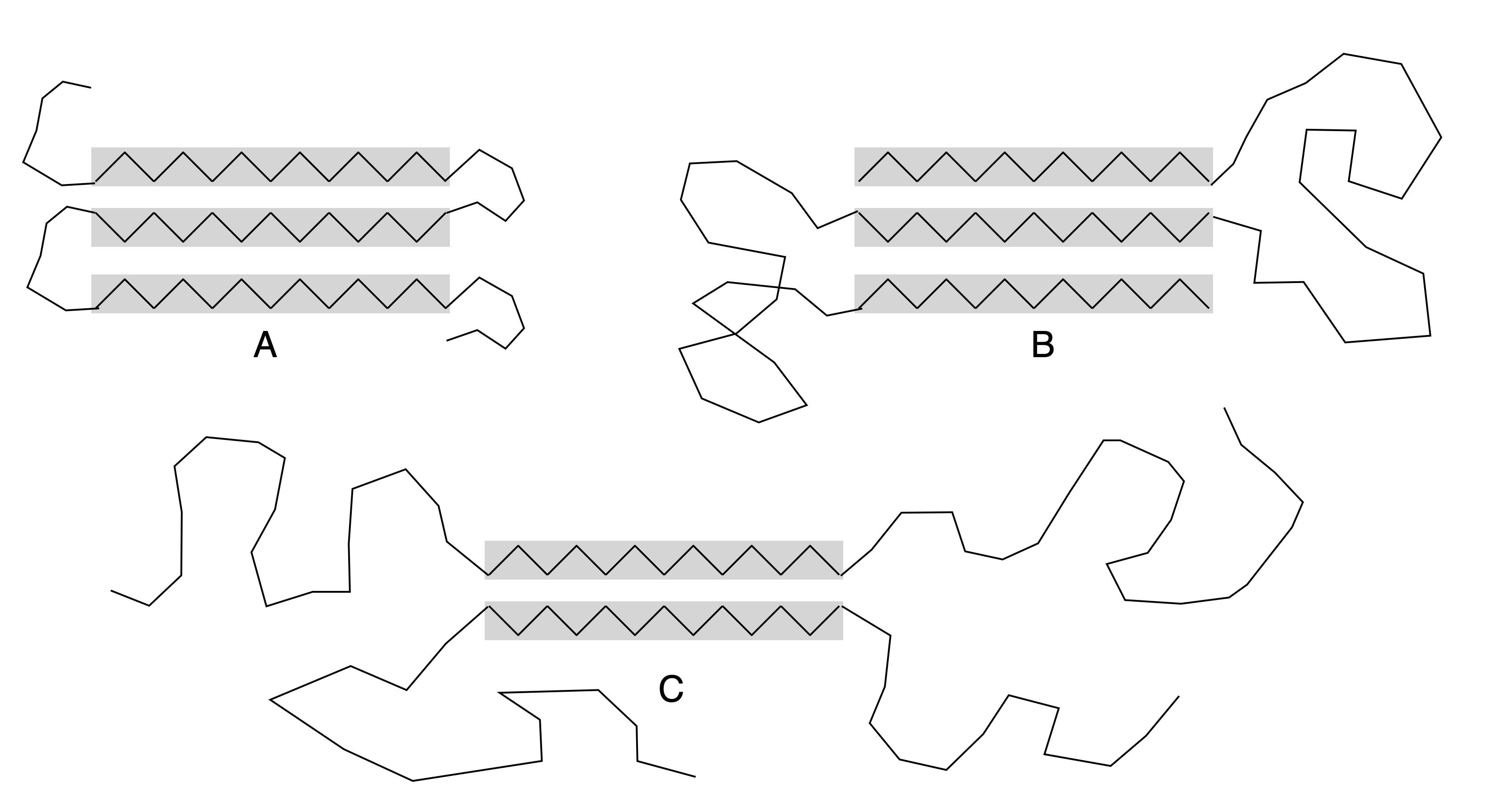
Verschiedene beta-Faltblätter
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Die alpha-Helix ist die andere wichtige Sekundärstruktur, die man in Peptiden oder Proteinen findet.
beta-Schleifen
In der letzten Abbildung sieht man mehrere β-Ketten, die durch schleifenartig angeordnete Aminosäuresequenzen miteinander verbunden sind. Wenn zwei β-Ketten direkt aufeinander folgen, wie das beispielsweise im Faltblatt (A) zu sehen ist, findet man an diesen Verbindungsstellen sogenannte β-Schleifen. In den meisten Proteinen kommen nur zwei bestimmte Typen dieser β-Schleifen vor, die sinnigerweise als Typ I und Typ II bezeichnet werden.
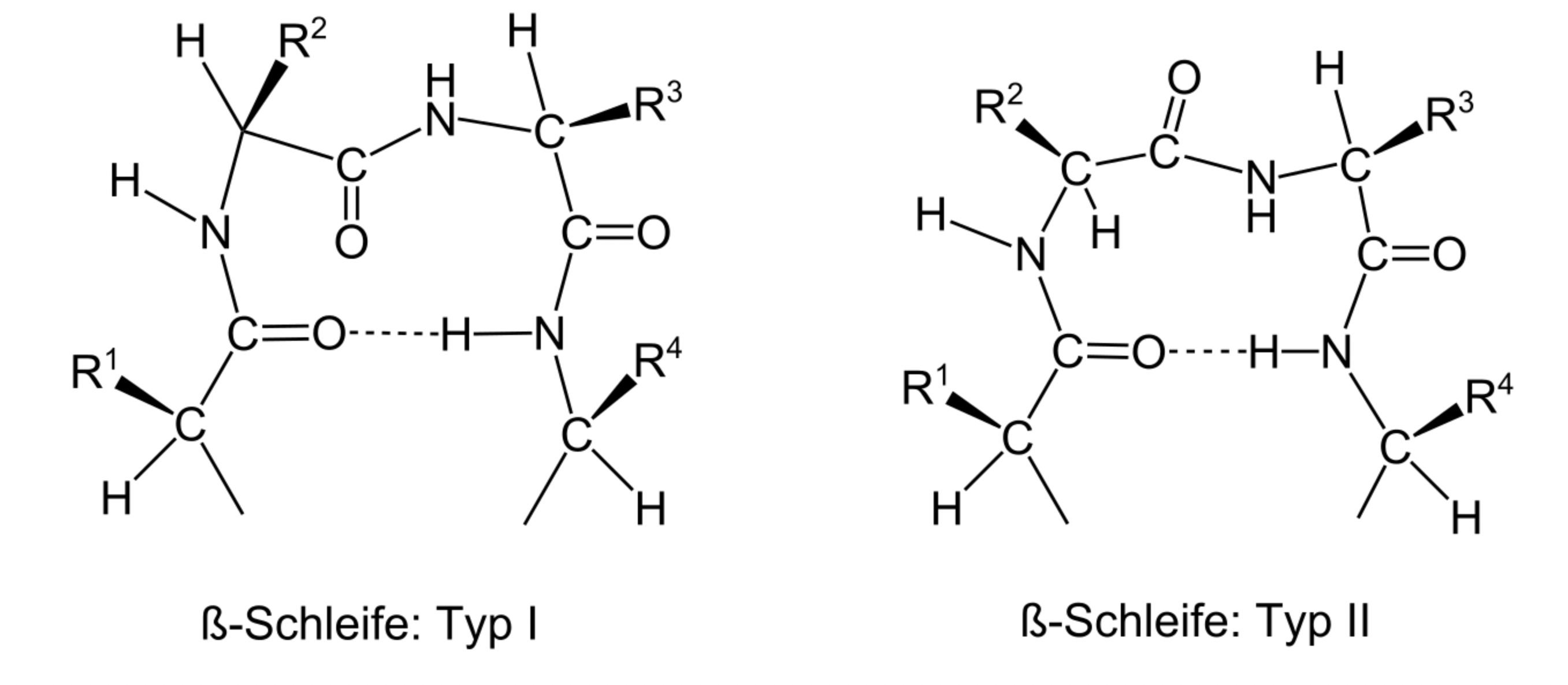
β-Schleifen
Muskid, Public domain, via Wikimedia Commons
Eine β-Schleife besteht aus vier Aminosäuren. Während bei einer α-Helix die Aminosäure 1 mit der Aminosäure 5 über eine H-Brücke verbunden ist, sind in einer β-Schleife Aminosäure 1 und 4 miteinander verbunden, ebenfalls über eine H-Brücke. Die beiden anderen Aminosäuren der β-Schleife bilden keine H-Brücken aus - auch ein Unterschied zur alαpha-Helix. Die β-Schleifen sind also keine "kleinen α-Helices", wie man vielleicht meinen könnte.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Wikipedia, Artikel "β-Faltblatt"
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Wikipedia, Artikel "β-Schleife"