Der Glucose-Na+-Symporter SGLT1 (sodium dependent glucose transporter) ist ein aus 14 α-Helices bestehendes integrales Membranprotein, das in der dem Darmlumen zugewandten Membran der Epithelzellen des Dünndarms sitzt. Die fünf letzten Helices (also vom COOH-Ende aus gesehen) sind für den Glucose-Transport zuständig, die ersten neun Helices (vom NH2-Ende aus gesehen) sorgen für den Na+-Transport [2].
Verändert man das Transporterprotein genetisch so, dass nur noch die letzten fünf Helices exprimiert werden, erhält man einen funktionierenden passiven Glucose-Transporter [2].
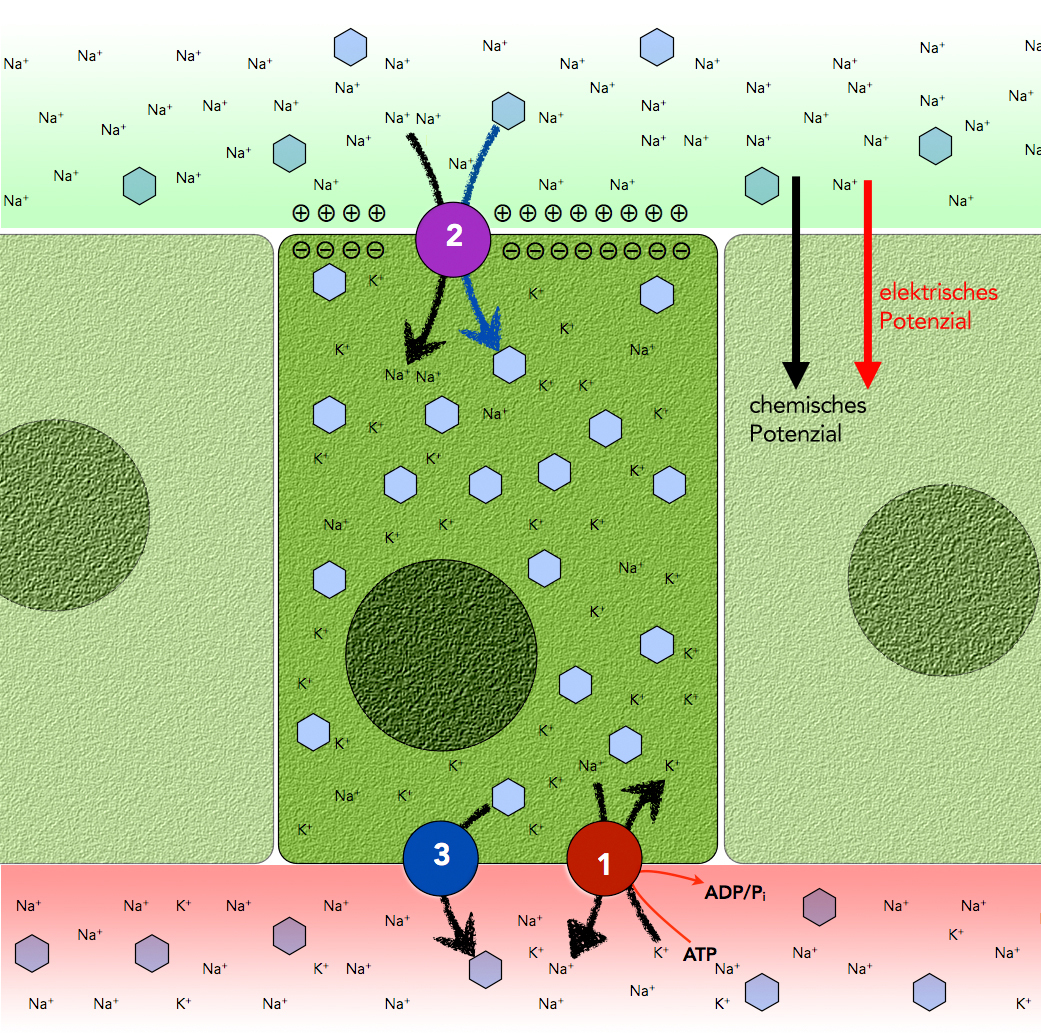
Glucose-Transport im DÜnndarm
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Der Transport der Glucose (und Galactose!) vom Dünndarm in die Epithelzellen muss aktiv erfolgen, da in den Epithelzellen bereits eine hohe Glucose-Konzentration herrscht.
- Eine ATP-getriebene Natrium-Kalium-Pumpe betreibt einen Antiport: Kalium-Ionen werden gegen das K+-Gefälle in die Epithelzelle hinein transportiert, Natruim-Ionen werden im Gegenzug gegen das Na+-Gefälle aus der Zelle heraus transportiert, so dass dort stets eine sehr geringe Na+-Konzentration herrscht.
- Aus dem Darmlumen diffundieren Na+-Ionen in die Epithelzelle hinein, angetrieben von dem chemischen Potenzial (Na+-Konzentrationsgefälle) und dem elektrischen Potenzial (Membraninnenseite negativ geladen). Diese passive Transport ist gekoppelt mit einem Glucose-Bergauftransport. In der Epithelzelle herrscht eine hohe Glucose-Konzentration, im Darmlumen eine niedrigere. Auch der fast genau so aussehende Zucker Galactose kann auf diese Weise in die Epithelzellen transportiert werden.
- Der Transport der Glucose aus der Epithelzelle in die extrazelluläre Flüssigkeit oder ins Blut geschieht nun rein passiv, in Richtung des Konzentrationsgradienten. Es handelt sich um einen klassischen Uniport.
Letztendlich ist also auch der aktive Transport der Glucose-Moleküle in die Epithelzellen hinein ein ATP-getriebener Transport, aber kein direkter, sondern ein indirekter bzw. sekundärer aktiver Transport über den Umweg des Na+-getriebenen Symporters.
Eine etwas genauere Darstellung der Arbeitsweise dieses Symporters findet sich in dem Buch von Lodish [2] und Alberts [3]. Hier eine selbst erstellte Graphik in Anlehnung an diese Abbildungen:
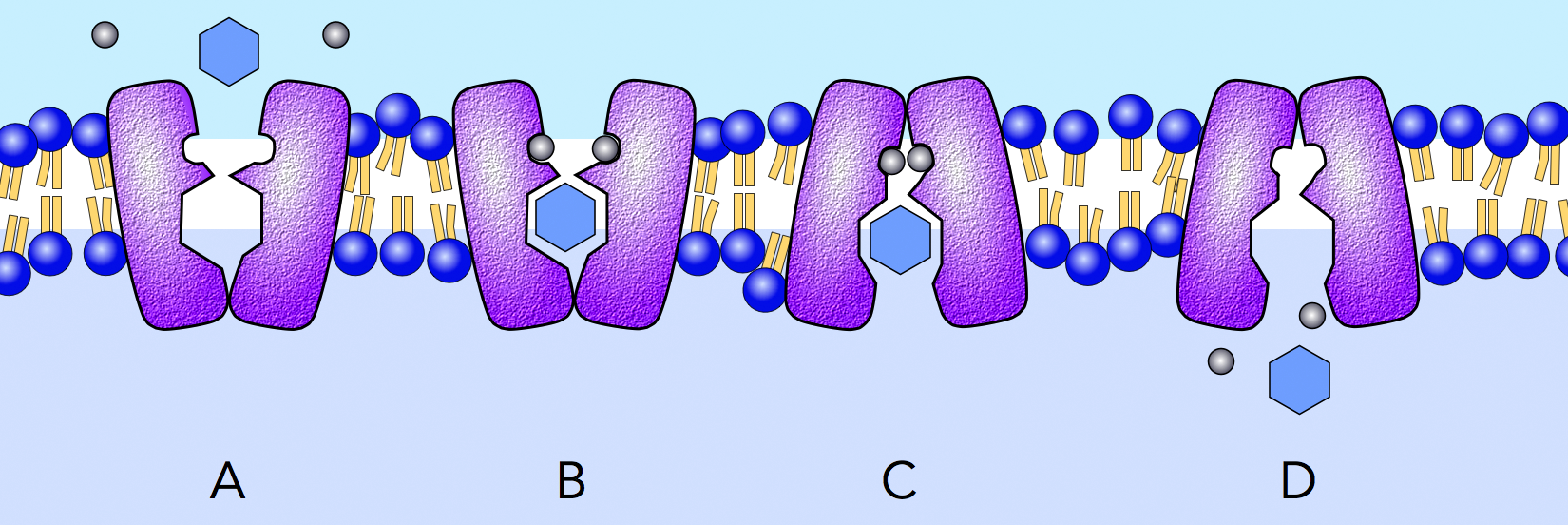
Arbeitsweise des Glucose-Natrium-Symporters
Autor: Ulrich Helmich 2021, in Anlehnung an [2] und [3], Lizenz: Public domain
Der Symporter arbeitet wie viele Carrier nach einem Klapptür-Mechanismus:
- Der Transporter ist nicht besetzt und zum Darmlumen hin geöffnet.
- Zwei Na+-Ionen und ein Glucose-Molekül binden an entsprechende Stellen des Transporters. Na+-Ionen können nicht binden, wenn Glucose im Medium fehlt, und Glucose kann nicht binden, wenn Na+-Ionen im Medium fehlen. Da die Na+-Konzentration im Darmlumen sehr hoch ist (bedingt durch die salzhaltige Nahrung), binden zunächst die Na+-Ionen und "warten" dann auf ein Glucose-Molekül [3].
- Der Transporter klappt um, ist jetzt zum Zellinnern hin geöffnet, die drei Solute (2 Na+, 1 Glucose) sind noch gebunden.
- Die drei Solute lösen sich und diffundieren ins Zellinnere. Dabei lösen sich die Na+-Ionen sehr schnell, wegen der niedrigen Na+-Konzentration in der Epithelzelle. Die Glucose löst sich langsamer, da die Glucose-Konzentration in der Zelle schon recht hoch ist. Erst wenn sich alle drei Solute gelöst haben, kehrt der Transporter in den Zustand A zurück [3].
Dieses YouTube-Video beschreibt die hier dargestellten Transportvorgänge sehr schön und eignet sich auch gut als Klausurvorbereitung.
Energetische Aspekte
Der durch die Natrium-Kalium-Pumpe erzeugte Na+-Gradient in den Epithelzellen ist so groß, dass er ca. -13 kJ/mol Energie speichert. Da je zwei Na+-Ionen transportiert werden, ist ΔG für den passiven Transport von 2 mol Na+ ca. -26 mol/kJ. Diese gespeicherte Energie reicht locker aus, um durch aktiven Transport einen Glucosegradienten zu erzeugen, bei die Glucose-Innenkonzentration ca. 30.000 mal höher ist als die Glucose-Konzentration im Darmlumen. Würde der Symporter nur ein Natrium-Ion pro Glucose-Molekül transportieren, könnte nur eine 170fache Glucose-Konzentration aufgebaut werden [2].
Regulation der Glucose-Aufnahme
Die Glucose-Natrium-Transporter des menschlichen Dünndarms sind Ansatzpunkte für Diabetes-Medikamente. Kann man die Glucose-Aufnahme nach einer Kohlenhydrat reichen Mahlzeit hemmen, so wird verhindert, dass der Blutzuckerspiegel allzu stark ansteigt. Auf einer Seite, in der solche Medikamente vorgestellt werden [4], findet sich ein schönes Schema, das erklärt, wie in den Epithelzellen die Aufnahme der Glucose reguliert wird. Dazu betrachten wir einmal die folgende Skizze:
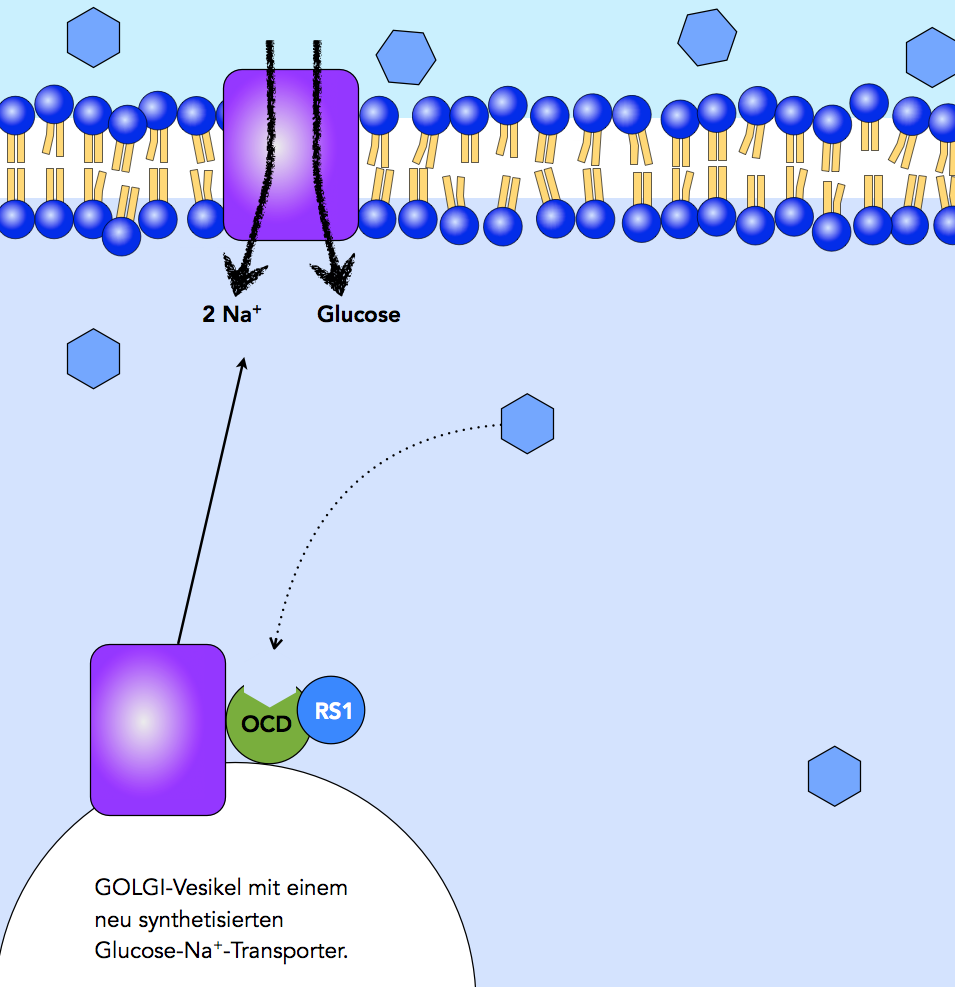
Glucose-Aufnahme bei geringer Glucose-Konzentration im Darmlumen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Zwischen den Mahlzeiten ist die Glucose-Konzentratio im Darmlumen recht niedrig, entsprechend wenig Glucose wird von den Epithelzellen aufgenommen, so dass auch die intrazelluläre Glucose-Konzentration recht gering ist.
Die Glucose-Natrium-Transporter SGLT1 sind Proteine, die - wie die meisten anderen Proteine auch - von Ribosomen des rauen endoplasmatischen Reticulums hergestellt werden. Über ER-Vesikel gelangen sie dann in die Zisternen des Golgi-Apparates, in denen sie chemische modifiziert werden können. Der Golgi-Apparat schnürt dann Golgi-Vesikel ab, mit denen dann die Proteine zur Zellmembran transportiert werden.
In dem Bild ist unten links ein Golgi-Vesikel zu sehen, in dessen Membran ein SGLT1-Protein eingebaut ist. Die Membran des Golgi-Vesikels ist hier stark vereinfacht durch einen dünnen Strich dargestellt; sonst wäre die Zeichnung zu groß geworden. Das SGLT1-Protein ist mit einem Aktivatorprotein namens OCD verbunden, das seinerseits mit einem RS1-Inhibitorprotein verknüpft ist. Das Aktivatorprotein OCD hat eine Bindungsstelle für Glucose.
Damit SGLT1 zur Zellmembran gelangt, muss sich das Golgi-Vesikel vom Golgi-Apparat lösen und mit Hilfe von Transportproteinen zur Zellmembran verschafft werden. Dort verschmilzt das Golgi-Vesikel mit der Membran, so dass SGLT1 in die Zellmembran eingebaut wird.
Solange das allosterische Zentrum von OCD nicht mit Glucose besetzt ist, bleibt OCD mit RS1 verbunden, so dass der Inhibitor RS1 die Abschnürung der Vesikel verhindern oder zumindest verlangsamen kann.
Was passiert nun, wenn wir ein Brötchen mit zuckerreicher Marmelade gegessen haben? Dazu schauen wir uns das nächste Bild an.
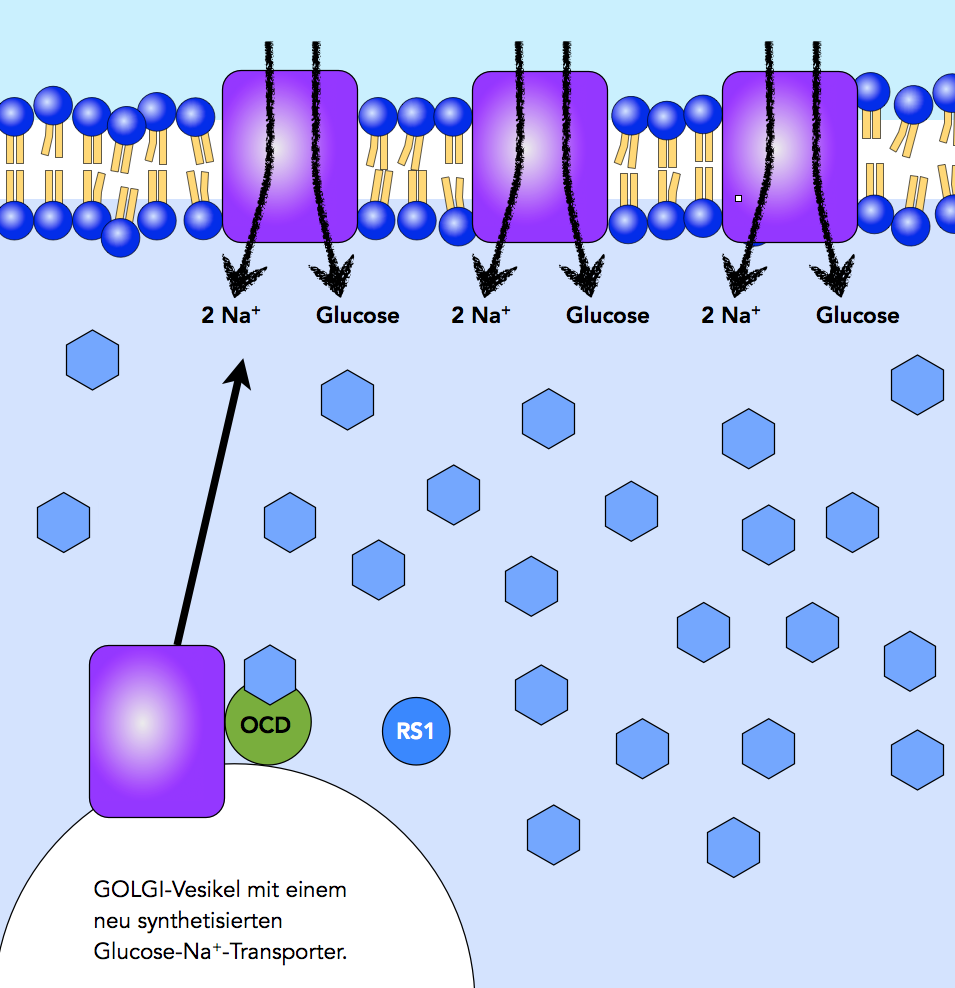
Glucose-Aufnahme bei hoher Glucose-Konzentration im Darmlumen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Im Darmlumen herrscht nach der Mahlzeit eine hohe Glucose-Konzentration, entsprechend viel Glucose wird auch in die Epithelzelle transportiert, so dass auch hier die Glucose-Konzentration steigt. Die Wahrscheinlichkeit, dass das allosterische Zentrum von OCD besetzt wird, nimmt daher zu. Sobald sich ein Glucose-Molekül in dieses allosterische Zentrum setzt, löst sich die hemmende RS1-Einheit von dem aktivierenden OCD. Das OCD kann jetzt die Ablösung der Golgi-Vesikel fördern und begünstigt somit den Einbau der SGLT1-Proteine in die Zellmembran.
Bei hoher Glucose-Konzentration werden also vermehrt GOLGI-Vesikel mit SGLT1 zur Zellmembran transportiert, so dass sich dort die Anzahl der SGLT1-Proteine erhöht. Dies hat dann einen verstärkten Glucose-Transport in die Epithelzelle zur Folge [4, 5].
Der SGLT2-Transporter der Nieren
Neben dem Glucose-Natrium-Symporter SGLT1 gibt es noch den fast baugleichen SGLT2-Transporter, der in der Niere arbeitet. Die Aufgabe dieses Transporters ist es, eventuell im Primärharn vorhandene Glucose zurück zu gewinnen. Im Gegensatz zum SGLT1 benötigt dieser Transporter nur je ein Natrium-Ion, um Glucose aus dem Harn zurück in den Körper zu transportieren, wo sie gebraucht wird.
Auch dieser Transporter ist ins Blicklicht der Diabetes-Forschung geraten. Wenn man die Glucose-Aufnahme aus dem Harn unterbinden kann, führt dies zu einer Senkung des Blutzuckerspiegels.
Quellen:
- Wikipedia, Artikel "Sodium/glucose cotransporter 1"
- Harvey Lodish et al. Molecular Cell Biology, New York 2004
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- "The Na+-D-glucose cotransporters SGLT1 and SGLT2 are targets for the treatment of diabetes and cancer" in Pharmacology & Therapeutics Volume 170, February 2017, Pages 148-165.
- "Function and regulation of the sodium D-glucose cotransporter SGLT1" in dem Research Report 2008 der Universität Würzburg.