Als Lipid-Anker bezeichnet man bestimmte Fettsäuren (Myristinsäure- oder Palmitinsäure-Reste) oder Isopren-Oligomere (Farnesyl-, Gernaylgeranyl-Reste), die kovalent an ein Endoprotein oder an ein Transmembranprotein auf der Innenseite der Membran gebunden sind (meistens über die Seitenkette der Aminosäure Cystein) und dieses Protein in der hydrophoben Mittelschicht der Zellmembran verankern.
Myristinsäure als Lipid-Anker
Rhodopsin ist ein typisches Beispiel. Neben den sieben α-Helices hat das Rhodopsin-Molekül die Fettsäure Myristinsäure kovalent über eine Amidbindung an den N-terminalen Glycinrest des Proteins gebunden [5].
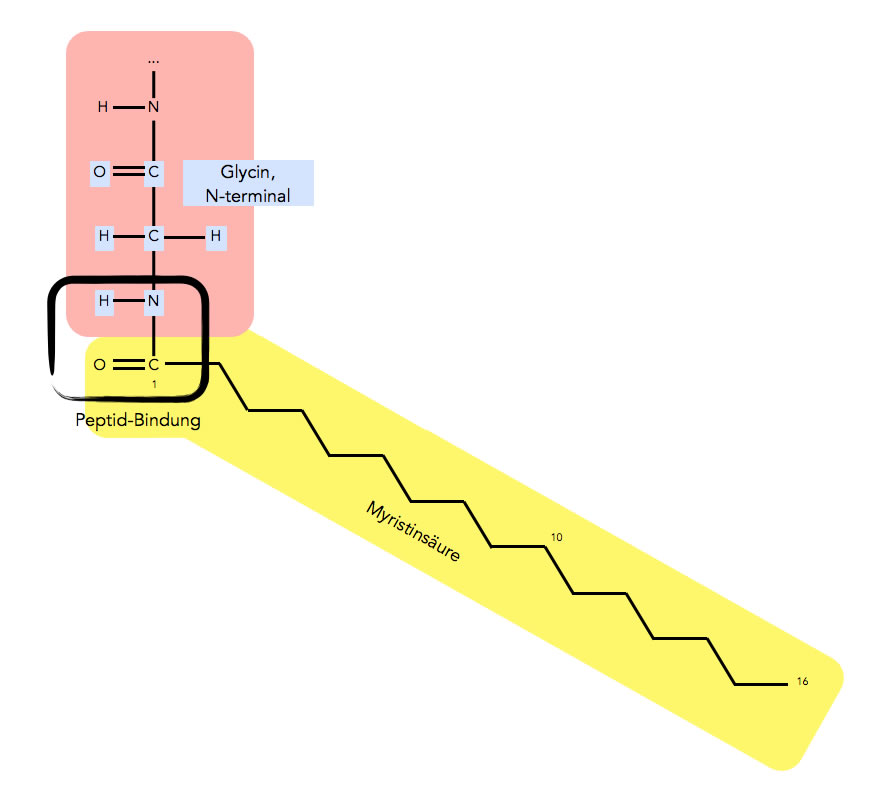
Myristinsäure als Lipidanker eines Proteins, über eine Peptid-Bindung kovalent verknüpft.
Autor: Ulrich Helmich, Lizenz: Public domain
In dem Bild sehen wir, wie ein Myristinsäure-Molekül an ein Glycin-Moleküle am N-Terminus des Proteins kovalent gebunden ist. Der Bindungstyp ist im Prinzip eine Peptidbindung, wie sie auch zwischen zwei Aminosäuren vorkommt. Nur verbindet sich hier die NH2-Gruppe des Glycins nicht mit der COOH-Gruppe einer anderen Aminosäure, sondern mit der COOH-Gruppe der Myristinsäure.
Das Besondere an dieser Bindung ist hier, dass die Fettsäure über die terminale NH2-Gruppe des Proteins gebunden wird. Normalerweise werden Lipide über Seitenketten von Aminosäuren gebunden, sie sich mitten im Protein befinden.
Palmitinsäure als Lipid-Anker
Auch Palmitinsäure ist ein häufiger Lipid-Anker. Diese Fettsäure wird über das Schwefel-Atom einer Cystein-Seitenkette gebunden (Thioester, im Gegensatz zu einem "normalen" Ester, bei dem die Fettsäure über ein Sauerstoff-Atom gebunden wird):
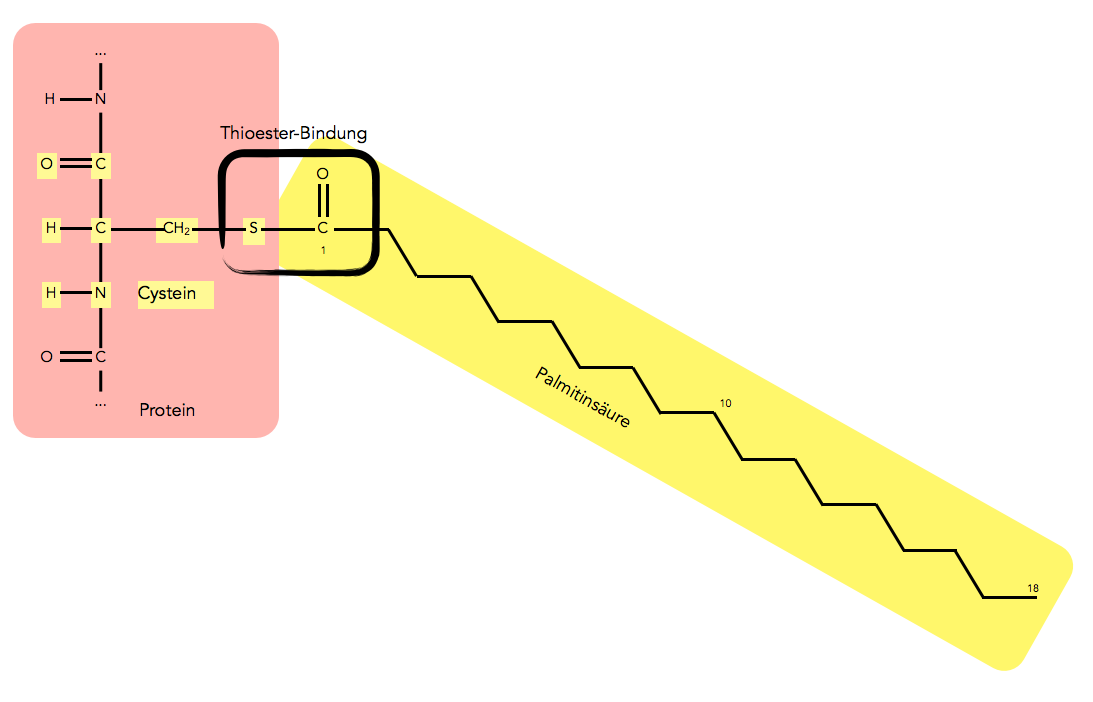
Palmitinsäure als Lipidanker eines Proteins, über eine Thioester-Bindung kovalent verknüpft.
Autor: Ulrich Helmich, Lizenz: Public domain
kurze Terpene als Lipid-Anker
Schließlich gibt es noch Lipid-Anker, die aus Farnesyl- oder Geranylgeranylresten bestehen. Diese hydrophoben Einheiten werden nicht über eine Thio-Ester-Bindung an eine Cystein-Seitenkette gebunden, sondern über eine Thio-Ether-Bindung:
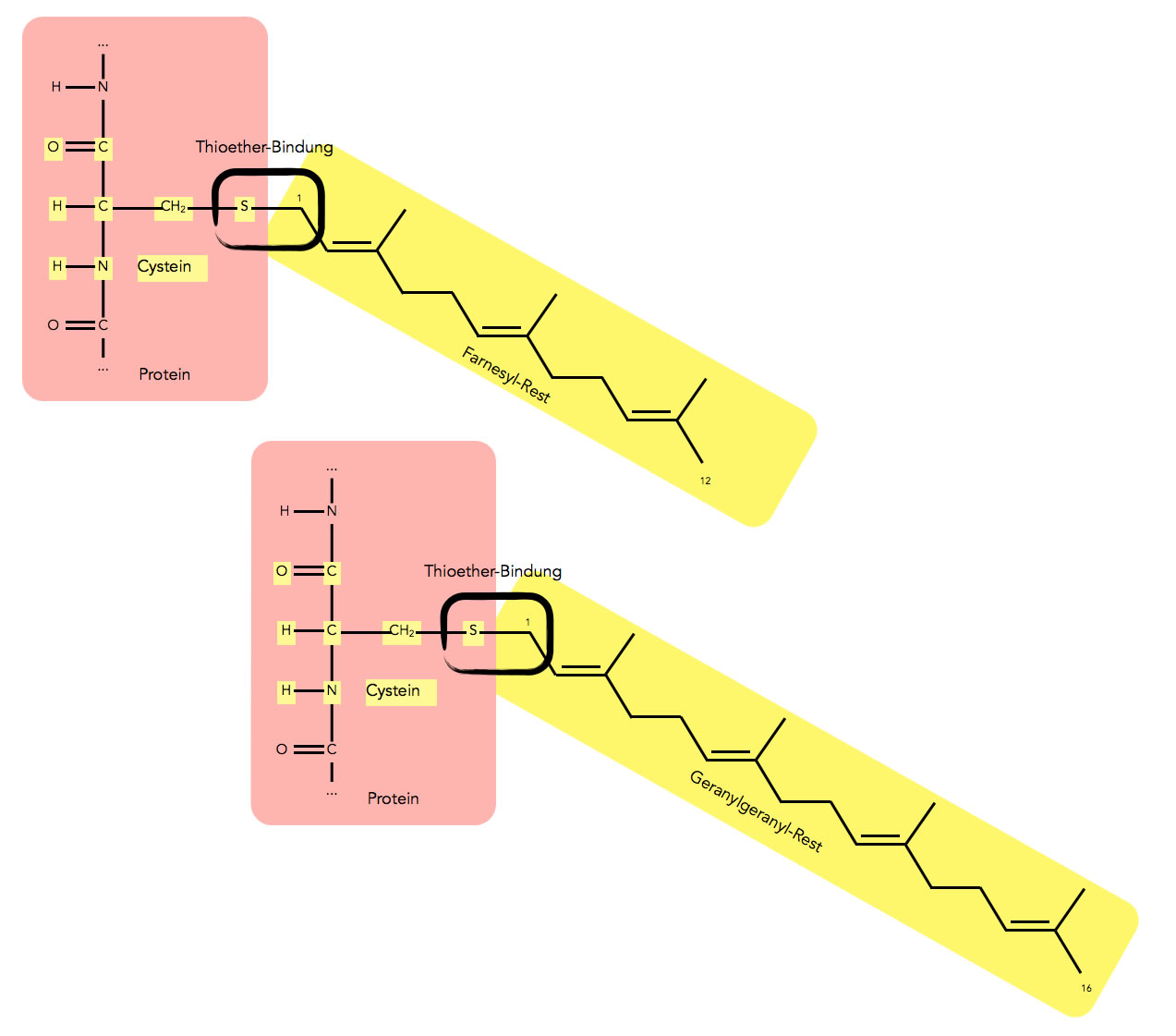
Farnesyl- und Geranylgeranyl-Reste als Lipid-Anker für Proteine
Autor: Ulrich Helmich, Lizenz: Public domain
Eine Ether-Bindung ist wesentlich stabiler als eine Ester-Bindung, daher ist es sehr schwer für das Protein, den Terpen-Rest wieder abzuspalten. Solche Proteine sind mehr oder weniger dauerhaft auf der cytoplasmatischen Seite der Membran verankert.
Glycosyl-Phosphatidyl-Inositol-verankerte Proteine
Die bisher besprochenen lipid-verankerten Proteine befanden sich alle auf der cytoplasmatischen Seite der Membran. Es gibt aber auch zahlreiche Proteine, die sich auf der extrazellulären Außenseite der Membran befinden. Viele dieser Proteine sind auf komplexe Weise über Zucker-Einheiten und Fettsäuren in der Membran verankert.
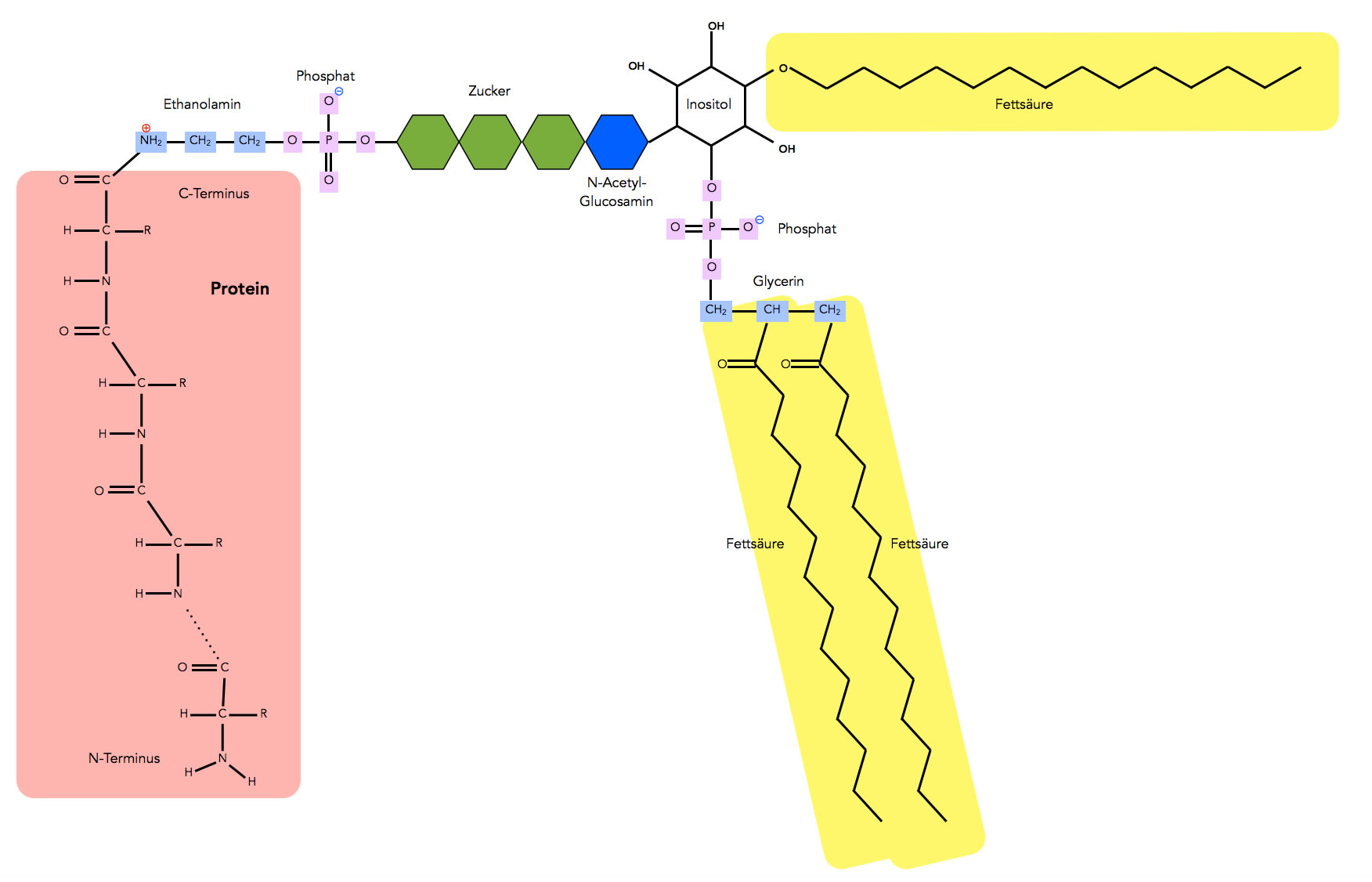
Ein Glycosyl-Phosphatidyl-Inositol-verankertes Protein
Autor: Ulrich Helmich, nach einer Zeichnung von Nadia Skauli in dem Wikipedia-Artikel "GPI-Anker",
Lizenz: Public domain
Der GPI-Anker besteht aus einem Ethanolamin, das über die NH2-Gruppe mit der endständigen COOH-Gruppe des Protein-C-Terminus verbunden ist. Das Ethanolamin ist dann mit Phosphorsäure verestert. Eine andere OH-Gruppe der Phosphorsäure ist dann mit drei Mannose-Einheiten verbunden. Die dritte Mannose-Einheit ist wiederum mit nicht acetyliertem N-Acetyl-Glucosamin verknüpft, einem stickstoffhaltigen Derivat der Glucose. Diese Einheit ist dann mit Inositol-Phosphat verbunden. Die Phosphat-Gruppe ist wieder mit einem Glycerin-Molekül verestert, das dann zwei Fettsäuren besitzt.
Periphere und integrale Proteine
Die Existenz eines Lipid-Ankers allein sagt noch nichts darüber aus, ob das so verankerte Protein ein peripheres oder ein integrales Membranprotein ist. Lipid-Anker kommen in beiden Klassen vor. Entscheidend für die Einordnung als "peripheres" oder "integrales" Protein ist die Frage, wie fest das Protein mit dem Lipid-Anker an bzw. in die Membran eingebunden ist. Lässt sich das Protein durch "milde" Maßnahmen wie pH-Änderung oder Änderungen der Salzkonzentration aus der Membran lösen, gehört es zu den lipid-verankerten peripheren Proteinen. Sind dagegen drastischere Maßnahmen notwendig wie zum Beispiel der Einsatz von Detergenzien, so handelt es sich um ein lipid-verankertes integrales Membranprotein.
Quellen:
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- engl. Wikipedia, Artikel "sodium channel".
- Wikipedia, Artikel "Porine".
- Flexikon.doccheck.com, Artikel "Lipidanker".
- Luckey, Membrane Structural Biology, 2. Auflage, Cambridge University Press 2014.