Das erweiterte Atommodell
J. Plücker entdeckte 1858 die sogenannte Kathodenstrahlung (Betastrahlung), eine Strahlung, die von bestimmten Gasentladungs- oder Kathodenröhren ausgeht, wenn man sie erhitzt. Joseph John Thomson entdeckte 1897, dass diese Kathodenstrahlung aus kleinsten negativ geladenen Teilchen besteht; Teilchen, die noch viel kleiner sind als Atome. Thomson nannte diese winzigen negativen Teilchen Elektronen, nach dem griechischen Wort für Bernstein.
Die Tatsache, dass Metallatome Elektronen freisetzen können, wenn sie erhitzt werden, veranlasste Thomson, das Atommodell von Dalton im Jahre 1904 zu erweitern.
Nach dem Atommodell von Thomson besteht ein Atom aus einer positiven Masse, in die eine gewisse Anzahl negativer Elektronen eingebettet ist.
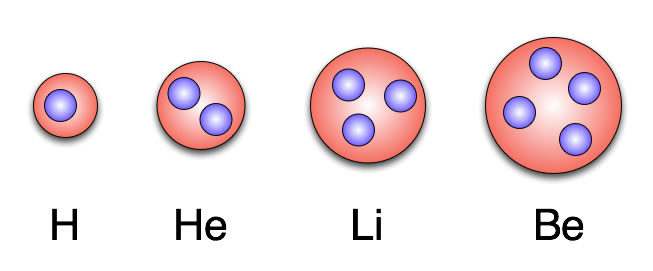
Die ersten vier Elemente nach dem Rosinenkuchenmodell
Hier sind die ersten vier Elemente nach dem Thomson-Modell dargestellt. Das Wasserstoff-Atom (H) enthält ein Elektron, das Helium-Atom (He) zwei, das Lithium-Atom (Li) drei und das Beryllium-Atom (Be) vier Elektronen. Die elektrische Ladung der positiven Masse ist genau so groß wie die Anzahl der Elektronen, so dass sich positive und negative Ladungen ausgleichen. Nach außen hin erscheint ein Atom also elektrisch neutral.
Vergleicht man die positive Masse mit einen "Kuchenteig" und die Elektronen mit den "Rosinen", die in diesem Teig verteilt sind, kann man auch verstehen, warum dieses Atommodell als Rosinenkuchenmodell bekannt wurde. Im englischen Original wird es übrigens als Plum pudding model bezeichnet.

Kein Rosinenkuchen, sondern ein Christstollen
Dieses schöne Bild (Pixabay.com, User congerdesign) zeigt zwar keinen Rosinenkuchen, sondern einen Christstollen, gibt aber ungefähr eine Vorstellung davon, was sich Thomson unter dem "Rosinenkuchenmodell" vorstellte.
Ionen
Die Elektrolyse von Salzen wie Zinkbromid zeigt uns, dass es neben den "normalen" neutralen Atomen auch elektrisch positiv und negativ geladene Atome geben muss. Solche geladenen Atome werden als Ionen bezeichnet. DALTON konnte die Existenz von Ionen nicht mit seinem Atommodell erklären, denn nach seinem Atommodell bestehen Atome ja aus kleinen massiven unteilbaren Kugeln. Damit ein elektrisch positives Ion entstehen kann, muss aus dem Atom aber ein negatives Stück entfernt werden. Umgekehrt muss zur Bildung eines negativen Ions dem Atom ein negatives Teilchen hinzugefügt werden. Beides ist mit der Unteilbarkeit der Atome unvereinbar.
Thomson konnte dagegen die Existenz von Ionen sehr einfach erklären. Ein positives Ion hat ein, zwei oder drei Elektron weniger, als das entsprechende Atom, ein negatives Ion hat ein, zwei oder drei Elektron mehr als das entsprechende Atom.
Kupfer- und Zink-Atome geben gern zwei Elektronen ab, aus Kupfer-Atomen werden dann beispielsweise zweifach positiv geladene Kupfer-Ionen, und aus Zink-Atomen werden zweifach positiv geladene Zink-Ionen.
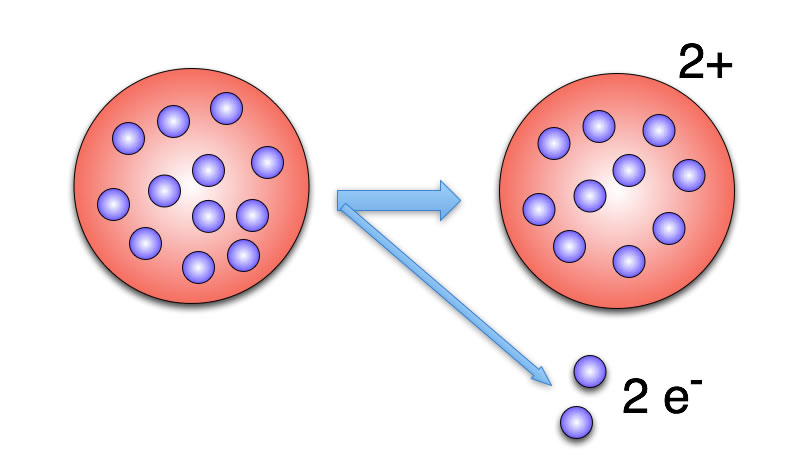
Bildung eines zweifach positiven Ions
In diesem Bild sehen wir, wie sich Thomson die Bildung eines zweifach positiv geladenen Ions aus einem Kupfer- oder Zink-Atom vorstellt.
Chlor- oder Brom-Atome nehmen dagegen gern ein Elektron auf. Aus Brom-Atomen werden dann einfach negativ geladende Bromid-Ionen, aus Chlor-Atomen entstehen einfach negativ geladene Chlorid-Ionen. Sauerstoff-Atome nehmen sogar zwei Elektronen auf, aus Sauerstoff-Atomen werden dann zweifach negativ geladene Oxid-Ionen. Stickstoff-Atome sind sogar in der Lage, drei Elektronen aufzunehmen, so dass dreifach negativ geladene Nitrid-Ionen entstehen.
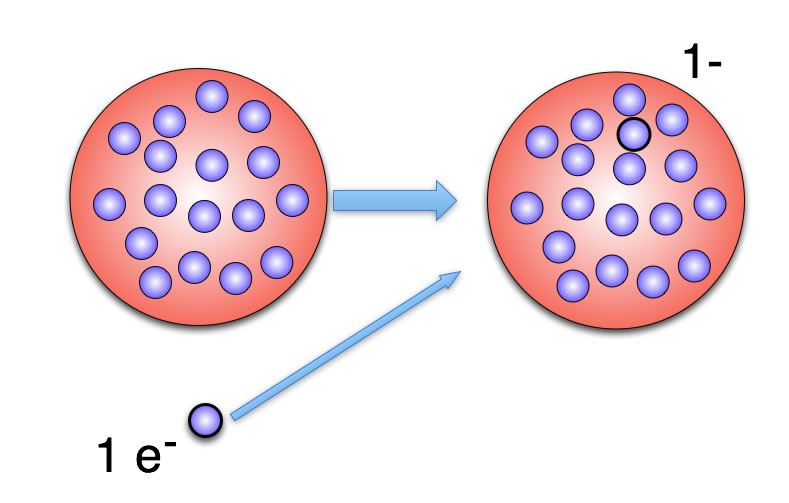
Bildung eines negativen Ions
Hier sehen wir, wie sich nach Thomson ein einfach negativ geladenes Bromid-Ion aus einem Brom-Atom bilden kann. Die Zahl der Elektronen ist aus Übersichtsgründen allerdings etwas verringert worden; Brom hat in Wirklichkeit 35 Elektronen, das Bromid-Ion 36 Elektronen.
Warum Sauerstoff-Atome zwei Elektronen aufnehmen und Stickstoff-Atome drei, konnte THOMSON allerdings noch nicht erklären, so ausgefeilt war sein Atommodell auch wieder nicht.
Elektrolyse mit dem Rosinenkuchenmodell erklärt
In einer Zinkbromid-Lösung befinden sich nicht Zink-Atome und Brom-Atome, sondern zweifach positiv geladene Zink-Ionen sowie einfach negativ geladene Bromid-Ionen.
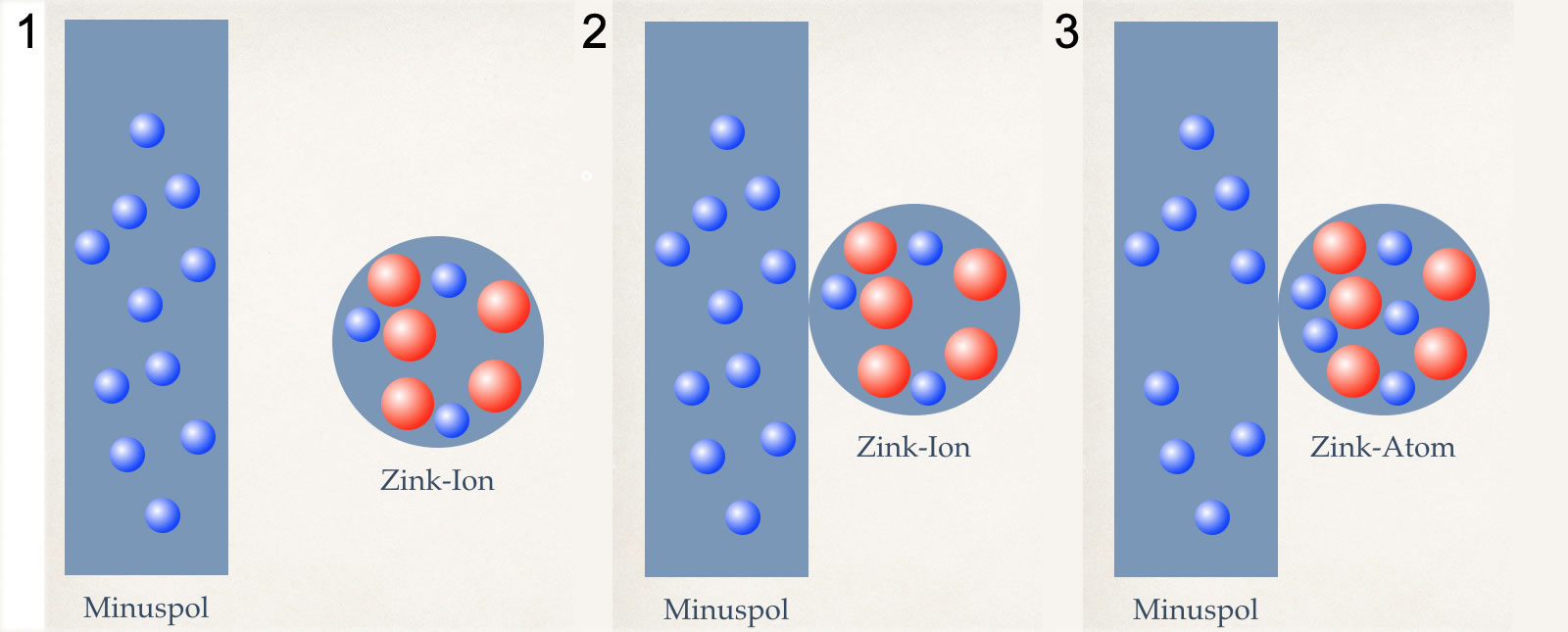
Die Vorgänge am Minuspol in drei Schritten erklärt
Bild 1:
Ein Zink-Ion ist ein Zink-Atom, dem zwei Elektronen fehlen. Daher ist es zweifach positiv geladen. Zink-Ionen lösen sich gut in Wasser und sind farblos1).
Bild 2:
Das Zink-Ion wird von dem Minuspol elektrisch angezogen. Im Minuspol herrscht ein Überschuss an Elektronen.
Bild 3:
Das Zink-Ion hat die fehlenden zwei Elektronen aus dem Minuspol aufgenommen. Dadurch ist aus dem Zink-Ion ein "normales" Zink-Atom geworden. Der Minuspol hat jetzt zwei Elektronen weniger.
Zink-Atome lösen sich nicht im Wasser, sondern bilden eine feste Masse, im Idealfall einen Zinkbaum.
Die farblosen1) Bromid-Ionen werden vom Pluspol angezogen. Dort herrscht ein Elektronenmangel. Dies führt dazu, dass die Bromid-Ionen ihr überschüssiges Elektron an den Pluspol abgeben. Aus den negativen Bromid-Ionen werden elektrisch neutrale und braun gefärbte1) Brom-Atome. Je zwei dieser Brom-Atome vereinigen sich dann zu einem Brom-Molekül Br2.
Weitere Informationen zum Rosinenkuchenmodell gibt es auf der Seite für die Stufe EF.
Anmerkung
1) Atome und Ionen haben grundsätzlich keine Farbe, dafür sind sie zu klein. Sieht man aber viele Trillionen Atome oder Ionen gleichzeitig, so kann man manchmal durchaus eine Farbe wie rotbraun erkennen. Diese Farbe entsteht durch das Zusammenspiel dieser vielen Trillionen Atome oder Ionen und dem Licht, das darauf fällt. Aber das einzelne Atom oder Ion hat keine Farbe.
Seitenanfang -
Einleitung - Rosinenkuchenmodell -
Kern-Hülle-Modell -
Schalenmodell -
Periodensystem