Das Beispiel HCl/H2O
Die Dissoziation von HCl
Betrachten wir die Dissoziation von Chlorwasserstoff einmal etwas genauer:
$1. \ \ HCl \rightleftharpoons H^{+} + Cl^{-}$
Die Dissoziation (Spaltung) von Chlorwasserstoff in einer wässrigen Lösung kann in beide Richtungen verlaufen. HCl-Moleküle können als Säuren ihr H-Atom als Proton abspalten, und zurück bleibt das Chlorid-Ion als Säurerest. Umgekehrt kann das Chlorid-Ion sich wieder mit einem Proton zu einem HCl-Molekül vereinigen.
Welche neue Erkenntnis kann man aus diesem Reaktionsbeispiel ziehen?
Eine Säure, die ein Proton abgegeben hat, wird zu einer Base!
Eine Base, die ein Proton aufgenommen hat, wird zu einer Säure.
Die Base B-, die durch die Protonenabgabe aus einer Säure HB entsteht, wird auch als korrespondierende Base der Säure HB bezeichnet.
Umgekehrt ist die Säure HB die korrespondierende Säure der Base B-.
Bei dem Beispiel HCl ist HCl die korrespondierende Säure der Base Cl-, und Cl- ist die korrespondierende Base der Säure HCl.
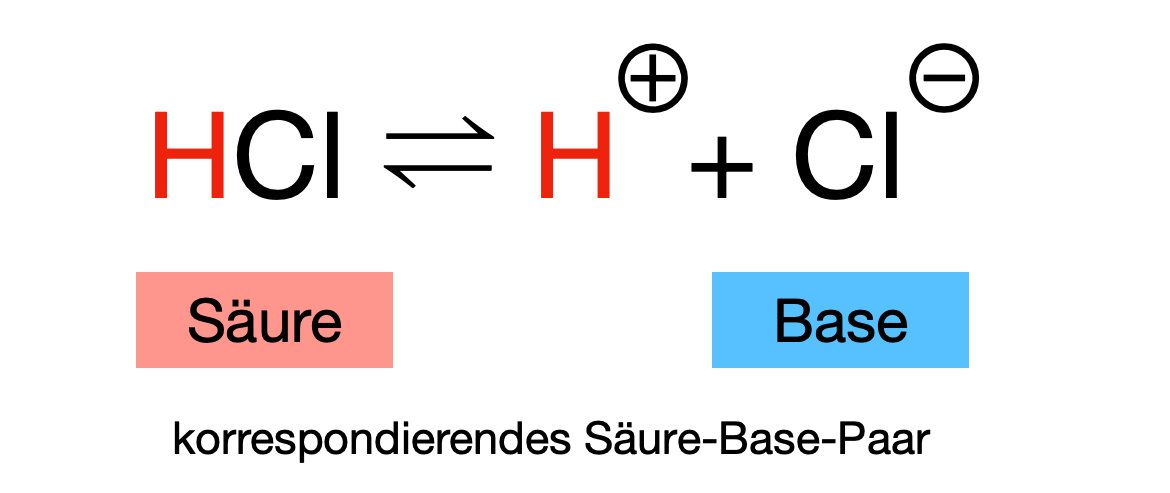
Das Säure-Base-Paar HCl/Cl-
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Eine Säure wird zusammen mit ihrer korrespondierenden Base als korrespondierendes Säure-Base-Paar bezeichnet. Das Musterbeispiel für ein korrespondierendes Säure-Base-Paar ist HCl/Cl-.
Wir wollen nun ein zweites korrespondierendes Säure-Base-Paar betrachten.
Die Bildung von H3O+
Löst man gasförmigen Chlorwasserstoff in Wasser, so bildet sich Salzsäure, eine saure Lösung. Die Dissoziation des HCl-Moleküls ist der erste Schritt bei diesem Vorgang. Der zweite Schritt besteht in der Aufnahme der Protonen durch Wasser-Moleküle:
$2. \ \ H_2O + H^{+} \rightleftharpoons + H_3O^{+}$
Erkennst du hier das korrespondierende Säure-Base-Paar? Ja genau, hier ist H3O+/H2O das korrespondierende Säure-Base-Paar.
Warum schreibt man nicht H2O/H3O+ für dieses Säure-Base-Paar? Ganz einfach: Die Säure wird immer zuerst genannt, dann die Base. Und die Säure ist hier H3O+.
Das Beispiel NH3/H2O
Diese neue Sache mit den korrespondierenden Säure-Base-Paaren müssen wir unbedingt an einem zweiten Beispiel vertiefen. Betrachten wir dazu die Reaktion von Ammoniak mit Wasser:
$1. \ \ H_2O \rightleftharpoons OH^{-} + H^{+}$
$2. \ \ NH_3 + H^{+} \rightleftharpoons NH_4^{+}$
Aufgabe
Benenne hier die beiden korrespondierenden Säure-Base-Paare!
Die Lösung dieser Aufgabe ist recht einfach:
- Säure-Base-Paar 1: H2O / OH-
- Säure-Base-Paar 2: NH4+ / NH3
Achte darauf, dass du die Säure immer zuerst hinschreibst.
Protolysen
Als Protolyse bezeichnet man die Übertragung eines Protons von einer Säure auf eine Base. Die Übersetzung von "Protolyse" wäre also "Protonenübertragungsreaktion".
Beim Lösen von Chlorwasserstoff HCl in Wasser werden Protonen auf Wasser-Moleküle übertragen. Das kann man jetzt auch so ausdrücken:
Das korrespondierende Säure-Base-Paar HCl/Cl- gibt ein Proton an das korrespondierende Säure-Base-Paar H3O+/H2O ab.
Wenn man Ammoniak NH3 in Wasser löst, entsteht Ammoniumhydroxid-Lösung. Die Protolyse beschreiben wir jetzt so:
Das korrespondierende Säure-Base-Paar H2O / OH- gibt ein Proton an das korrespondierende Säure-Base-Paar NH4+ / NH3 ab.
Immer daran denken: Zuerst die Säure hinschreiben. Auch wenn das manchmal etwas komisch aussieht wie bei NH4+ / NH3. Hier nimmt ja die Base NH3 das Proton auf und wird zur korrespondierenden Säure NH4+. Aber die Reaktionen sind ja umkehrbare Reaktionen, das heißt, auch die Rückreaktion läuft ab, und bei dieser Rückreaktion ist NH4+ die Säure und NH3 die korrespondierende Base.
Betrachtet man solche Protolysen, dann fällt ein ganz wichtiger Zusammenhang auf:
Wichtige Erkenntnis
Eine Säure kann ihr Proton nur abgeben, wenn eine Base vorhanden ist, die das Proton aufnimmt.
Eine Base kann nur ein Proton aufnehmen, wenn eine Säure vorhanden ist, die das Proton abgibt.
Ein korrespondierendes Säure-Base-Paar kann also nie allein auftreten, es ist stets ein zweites Paar notwendig. Das eine Paar kann ein Proton an das andere Paar abgeben und umgekehrt.
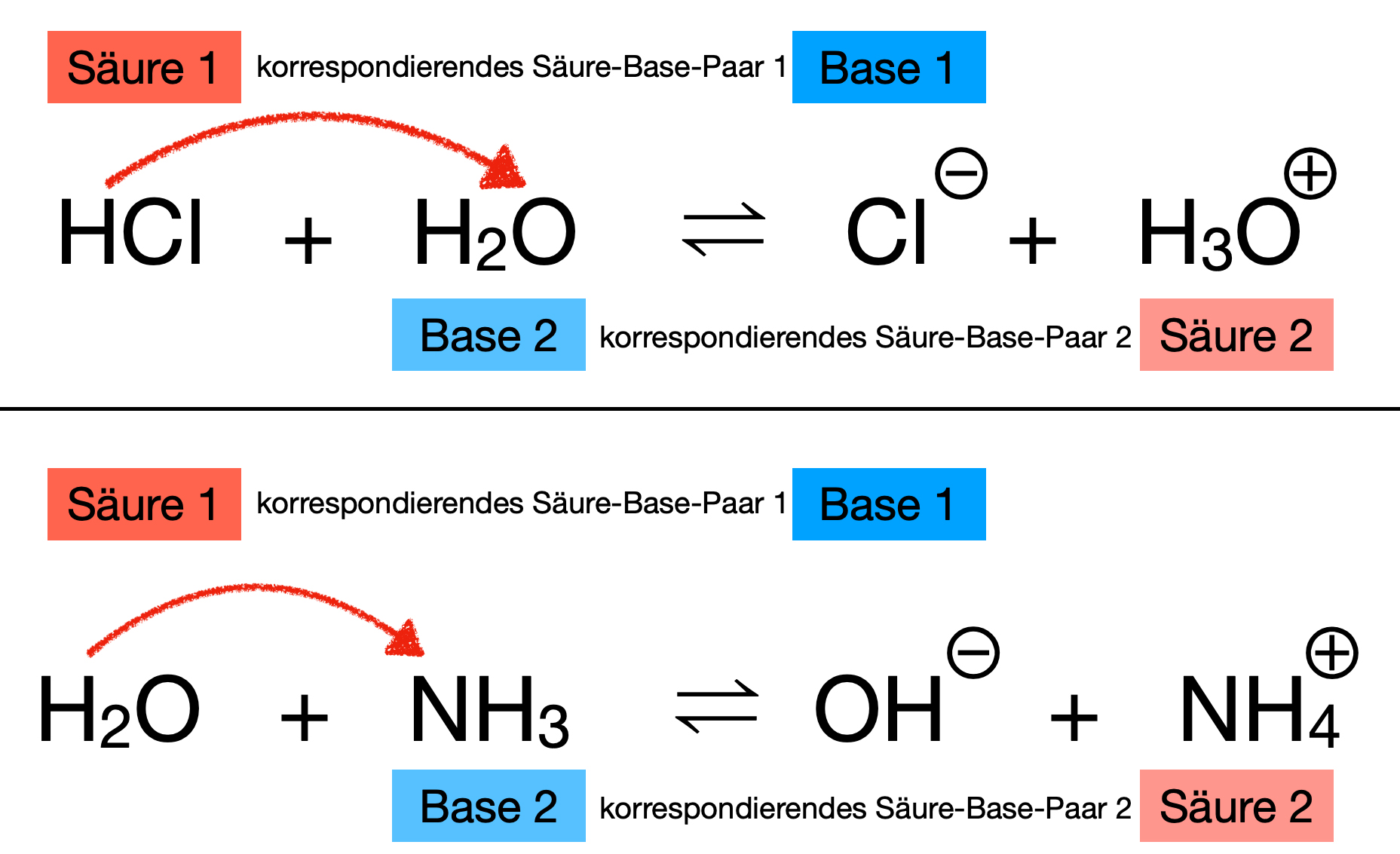
Zwei Protolysen mit je zwei korrespondierenden Säure-Base-Paaren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir noch einmal die besprochenen Protolysen.
Oben: Das korrespondierende Säure-Base-Paar HCl/Cl- (Säure/Base 1) gibt ein Proton an H3O+/H2O ab (Säure/Base 2)
Unten: Das korrespondierende Säure-Base-Paar H2O/OH- (Säure/Base 1) gibt ein Proton an NH4+/NH3 ab (Säure/Base 2).