Aufbau:
Ein Becherglas wird auf die Platte eines Magnetrührers gestellt, darüber wird mit Hilfe eines Stativs eine Bürette eingespannt.
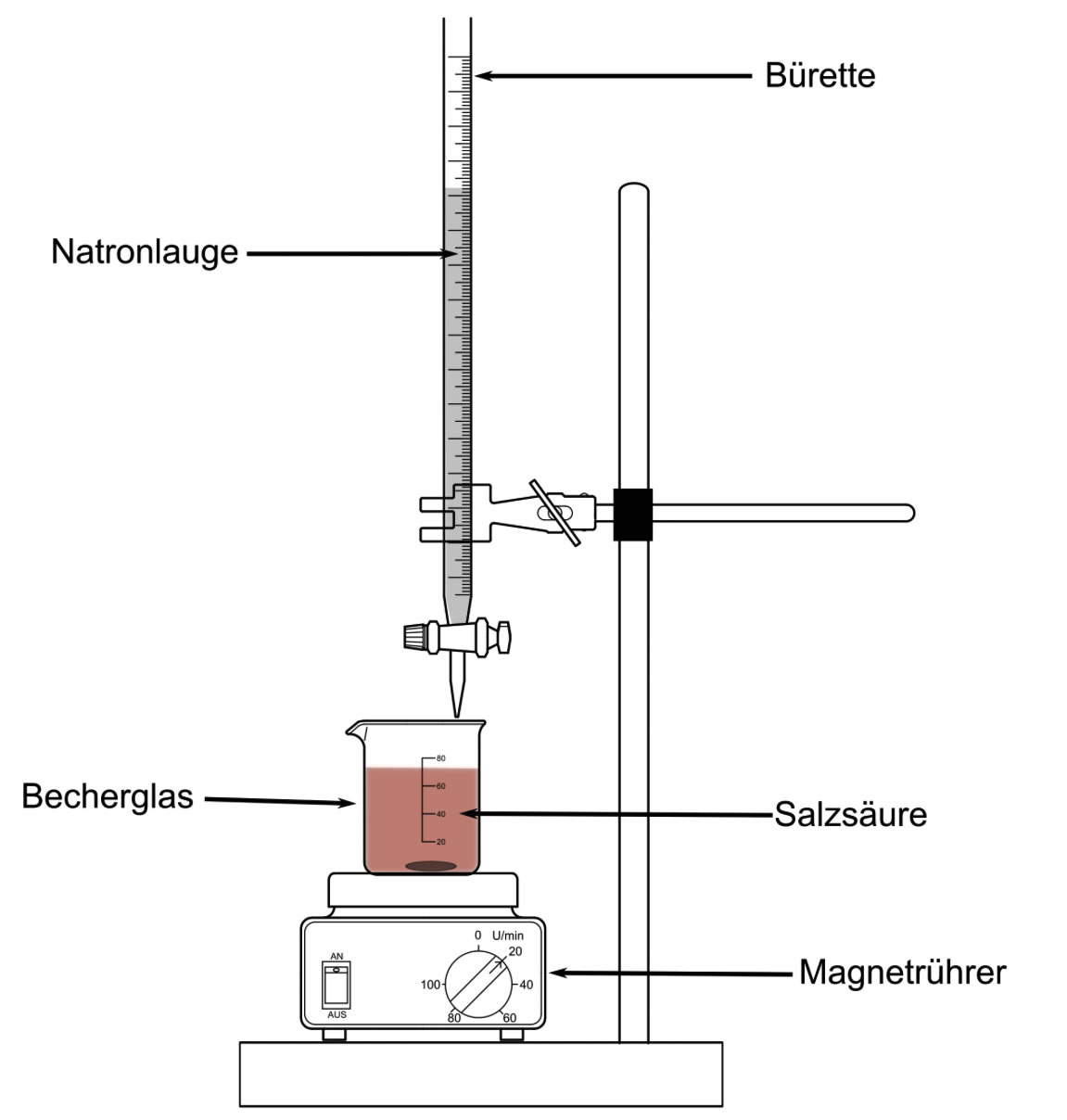
Eine typische Titrationsapparatur
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Durchführung:
Man gibt ein exakt abgemessenes Volumen der Säure, der Konzentration man bestimmen will, in das Becherglas, zum Beispiel 50 ml. Dann füllt man das Becherglas mit dest. Wasser auf ein größeres Volumen auf, beispielsweise 200 ml.
Zwischenfrage:
Warum ist es egal, ob man den Inhalt des Becherglases auf 150, 174 oder 200 ml auffüllt?
Antwort:
Weil bei der Titration nur die Stoffmenge der vorgelegten Säure n(Säure) bestimmt wird, und die ändert sich nicht durch die Zugabe von Wasser, egal ob man 100 ml, 124 ml oder 150 ml zugibt.
Anschließend gibt man ein paar Tropfen Universalindikator in das Becherglas mit der verdünnten sauren Lösung.
Alternativ kann man natürlich ein pH-Messgerät benutzen, dann hat man hinterher aber nicht das schöne Erlebnis mit dem Farbumschlag. Man kann auch beide Verfahren gleichzeitig einsetzen: Indikator und pH-Messgerät, dann hat man beides, die Freude am Farbwechsel und die Exaktheit der Messung.
Die Bürette füllt man dann mit der Natronlauge.
Dazu stellt man die Bürette am besten auf den Fußboden, stellt einen Trichter in die obere Öffnung der Bürette und schüttet die Natronlauge vorsichtig in den Trichter.
Viele Leute meinen, sie müssten die Bürette exakt bis zum oberen Strich der Skala füllen. Das kann man machen, muss es aber nicht. In diesem Fall muss man sich aber genau notieren, wie hoch der Füllstand der Bürette ist, bevor man auch nur einen Tropfen aus der Bürette herauslässt.
Nun stellt man den Magnetrührer an und lässt die Natronlauge aus der Bürette in die verdünnte Säure tropfen. Sobald sich die ersten blauen Schlieren in der sauren Lösung zeigen, dreht man den Hahn der Bürette zu und wartet kurz ab. Manchmal schlägt die Farbe des Indikators schon jetzt nach Grün um, und dann ist die Titration abgeschlossen. Manchmal schlägt die Farbe auch schon nach Blau um, dann hat man den sogenannten Äquivalenzpunkt schon überschritten, die saure Lösung ist also nicht nur schon neutralisiert, sondern es befindet sich zu viel Lauge in der Lösung.
Wenn der Indikator aber noch nicht grün ist, sollte man den Hahn der Bürette vorsichtig wieder öffnen und die Lauge dann ganz langsam, Tropfen für Tropfen, herauskommen lassen. Wenn die Lösung gelbgrün ist, sollte man noch langsamer verfahren, bis die Lösung schließlich richtig grün gefärbt ist oder das pH-Messgerät einen Wert zwischen 6,8 und 7,2 anzeigt, im Idealfall 7,0.
Jetzt ist die Titration beendet, das Becherglas wird von dem Magnetrührer genommen und der Inhalt kann bedenkenlos entsorgt werden, er ist ja jetzt neutral.
Das in der Bürette verbliebene NaOH-Volumen wird nun möglichst genau abgelesen und notiert, und dann wird die Bürette vorsichtig ausgespannt, die restliche Natronlauge kann in die Vorratsflasche zurückgegeben werden.