Wir untersuchen fünf Flüssigkeiten
Fünf farblose Flüssigkeiten in fünf Erlenmeyerkolben
Autor: Ulrich Helmich 2010, Lizenz: Public domain
Durchführung:
In fünf Erlenmeyerkolben A bis E befinden sich folgende Flüssigkeiten:
- A) Wasser
- B) verd. Salzsäure (10%)
- C) verd. Essigsäure (10%)
- D) verd. Salpetersäure (20%)
- E) stark verd. Salpetersäure (5%).
In meinem Unterricht stelle ich meinen Schüler(innen) dann immer die folgende Aufgabe:
Aufgabe:
Findet heraus, welche Flüssigkeit sich in welchem Gefäß befindet!
Die Schüler(innen) wissen natürlich nicht, in welchem Erlenmeyerkolben sich welche Flüssigkeit befindet. Außerdem haben Sie noch nie oder nur sehr wenig mit Säuren gearbeitet, daher sind noch ein paar Zusatzinformationen hilfreich.
Hilfsmittel:
Als Hilfsmittel stehen zur Verfügung:
- Universalindikator
- Magnesiumband
- Silbernitratlösung
Zusatzinformationen:
- "Starke Säuren färben Universalindikator rot, schwächere Säuren bzw. stark verdünnte Säuren färben den Indikator orange oder gelb, neutrale Lösungen grün und Laugen blau".
- "Unedle Metalle reagieren mit Säuren unter Bildung von Metallsalzen und Wasserstoff. Je stärker konzentriert die Säure ist, desto heftiger die Reaktion"
- "Silbernitrat reagiert mit Chlorid-Ionen zu einem weißen Niederschlag von Silberchlorid".
Wie könnte man nun mit den zur Verfügung stehenden Hilfsmitteln, den Zusatzinformationen sowie dem gesunden Menschenverstand herausfinden, in welchem Gefäß sich welche Säure befindet?
Beispiel für einen Lösungweg:
Hier ein möglicher Weg, um diese Aufgabe zu lösen.
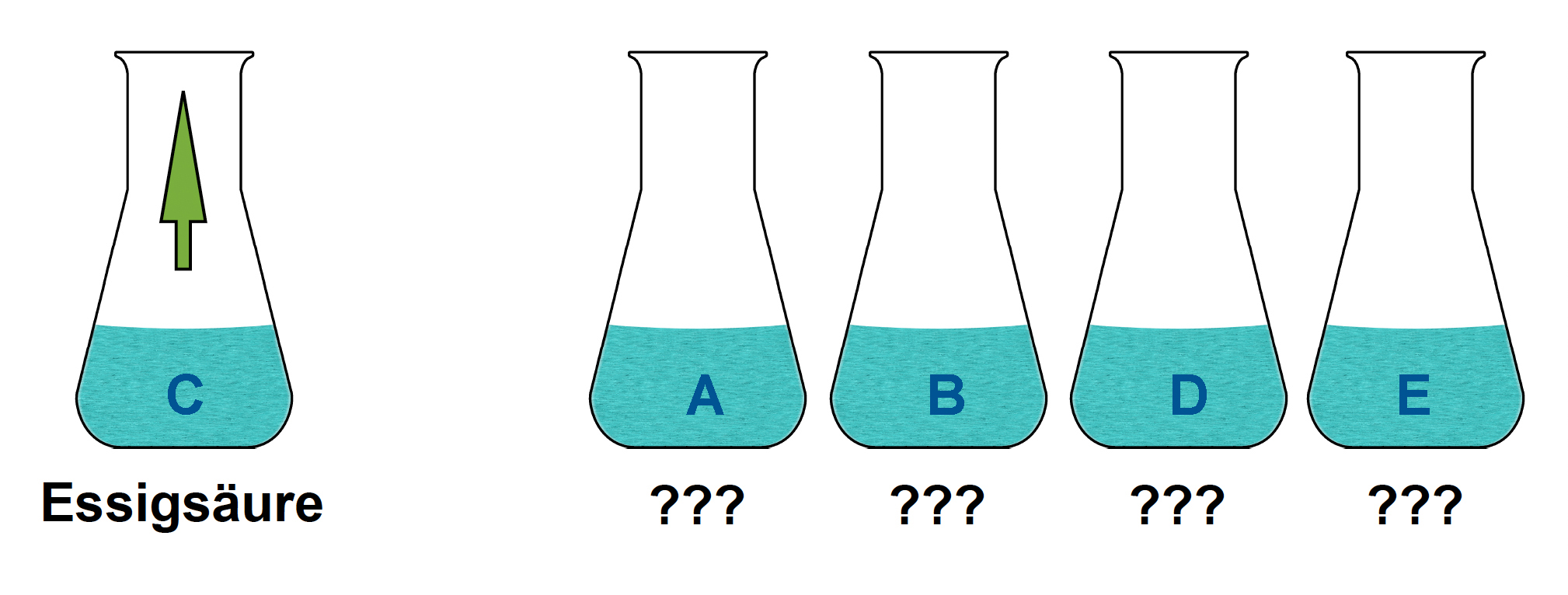
Schritt 1:
Schritt 1
Autor: Ulrich Helmich 2010, Lizenz: Public domain
Vorsichtige Geruchsprobe von jeder Flüssigkeit. Der Stoff in Kolben C riecht sehr stark nach Essig, damit steht schon einmal fest, dass sich im Kolben C die verdünnte Essigsäure befindet.
Hinweis: Man sollte wissen, wie man eine solche Geruchsprobe durchführt, ohne sich selbst zu gefährden. Nicht mit der Nase am Kolben riechen, sondern den Duft mit der Hand vorsichtig zur Nase wedeln.
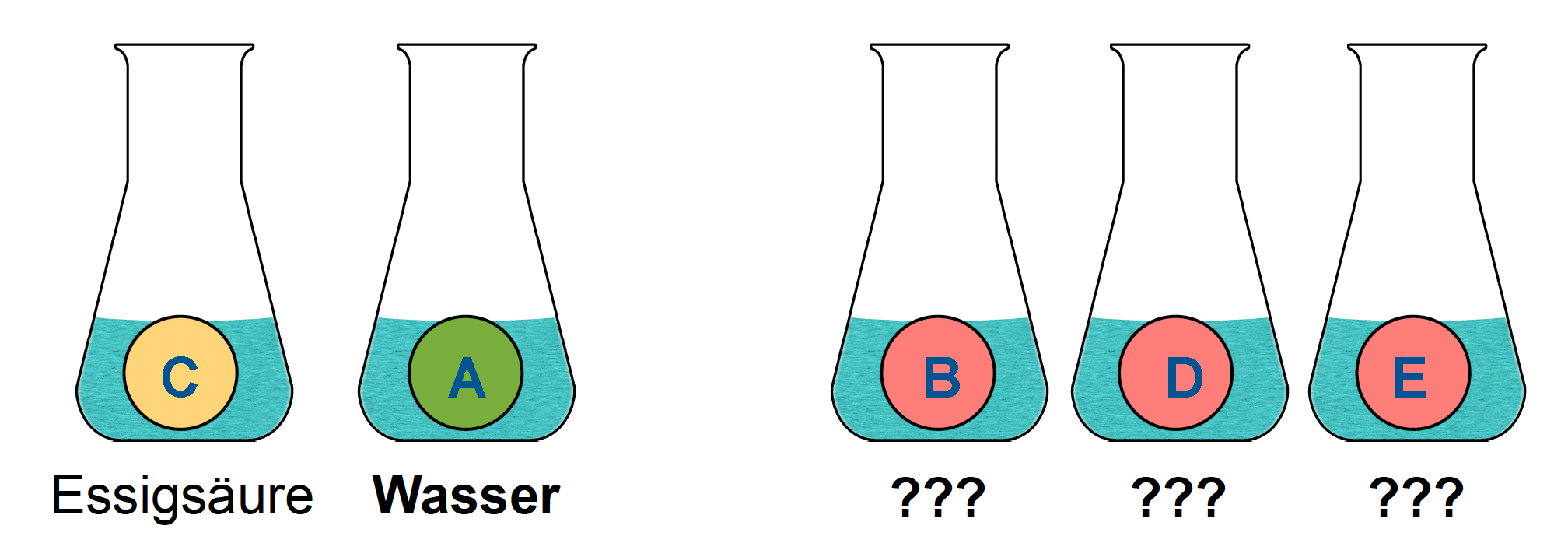
Schritt 2:
Schritt 2
Autor: Ulrich Helmich 2010, Lizenz: Public domain
Etwas Universalindikator in die Kolben geben. Bei A) wird die Lösung grün, bei B) rot, bei C) gelb-organge, bei D) und E) wieder rot. Damit steht fest, dass sich in Kolben A Wasser befindet.
Hinweis: Universalindikator hat in Leitungswasser eine grüne Farbe. Ist die Lösung schwach sauer, schlägt die Farbe in den gelben bis orangefarbenen Bereich um, bei stark sauren Lösungen nimmer der Indikator sogar eine rote bis leicht violette Färbung an. Laugen färben den Indikator dagegen grünlich-blau (schwache Laugen) bis intensiv blau (starke Laugen).
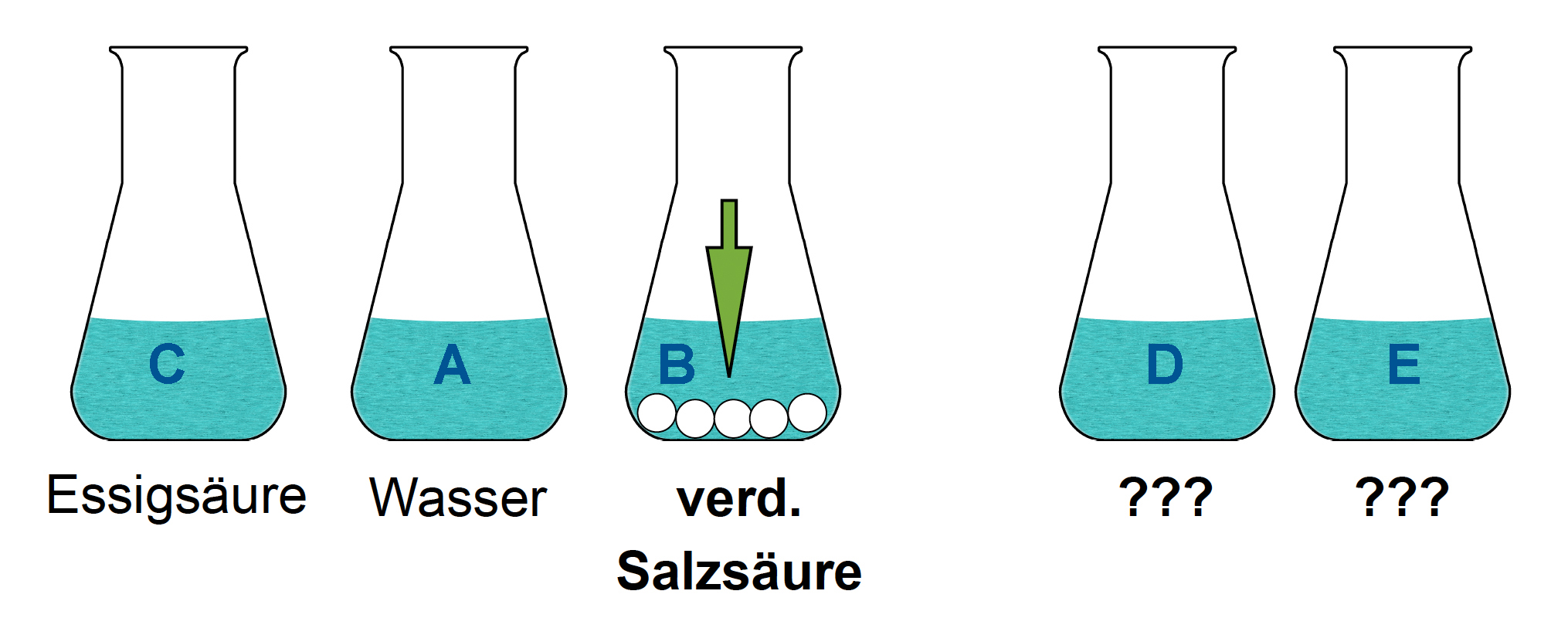
Schritt 3:
Schritt 3
Autor: Ulrich Helmich 2010, Lizenz: Public domain
In die drei verbliebenen Kolben werden nun ein paar Tropfen Silbernitrat-Lösung gegeben. Nur in einem Kolben entsteht ein dicker weißer Niederschlag. Da nur Salzsäure als Chlorwasserstoff-Lösung Chlorid-Ionen enthält, wird dieser Kolben wohl die Salzsäure enthalten.
Hinweis für Chemie-Profis: Es findet folgende chemische Reaktion statt:
$HCl + AgNO_{3} \to AgCl\downarrow + HNO_{3}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Aus Salzsäure HCl und Silbernitratlösung AgNO3 bilden sich schwerlösliches Silberchlorid AgCl und Salpetersäure HNO3.
Schritt 4:
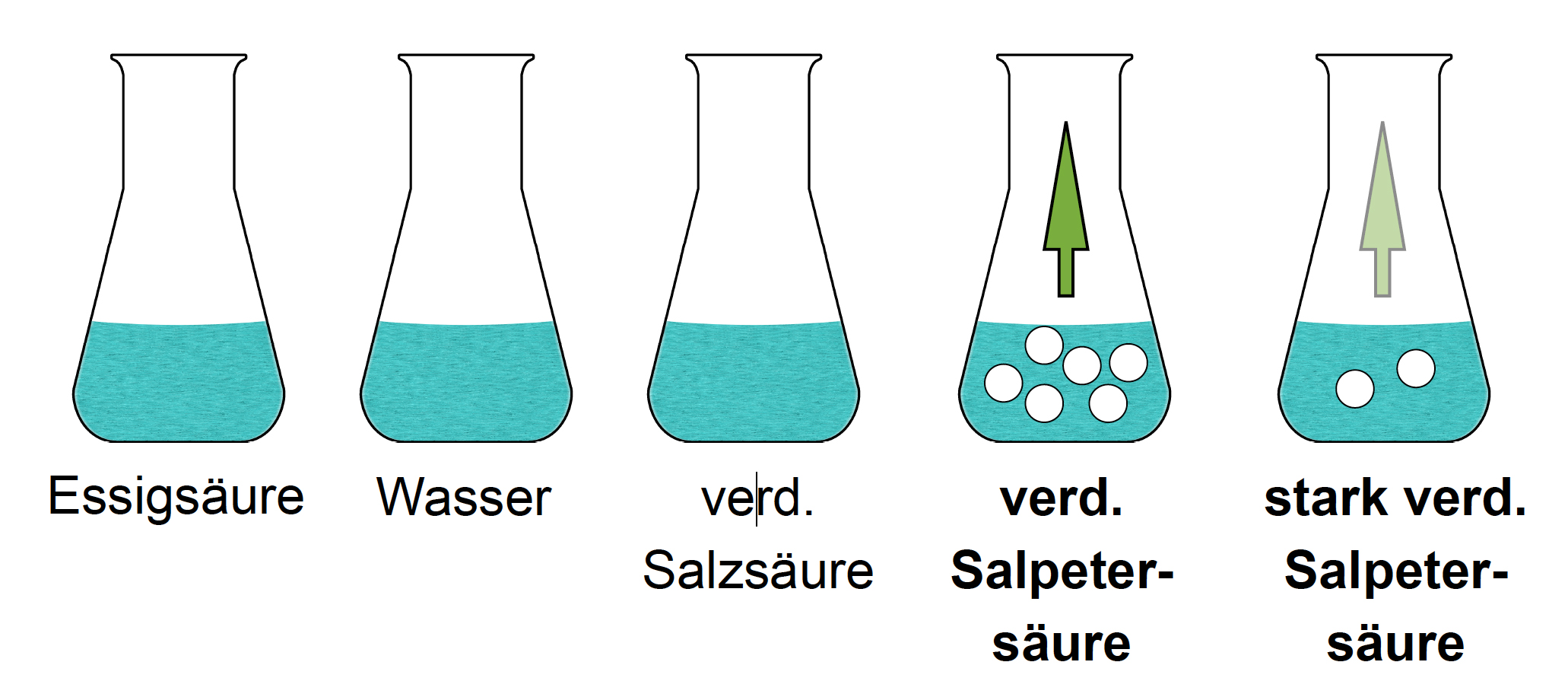
Schritt 4
Autor: Ulrich Helmich 2010, Lizenz: Public domain
Ein kleines Stück Magnesiumband in die zwei verbliebenen Kolben geben. Bei beiden Flüssigkeiten setzt eine Reaktion ein, es bilden sich farblose Blasen, die nach oben aufsteigen, und das Metall fängt an, sich aufzulösen. Allerdings ist die Reaktion bei D) heftiger als bei E), daher wird der Kolben D die verdünnte Salpetersäure enthalten, der Kolben E) die stark verdünnte Salpetersäure.
Hinweis für Chemie-Profis: Unedle Metalle reagieren mit Säuren zu Wasserstoff und Metallsalzen. Mit der Salpetersäure reagiert Magnesium wie folgt:
$Mg + 2 \ HNO_{3} \to Mg(NO_{3})_{2} + H_{2} \uparrow$