Transaminierung, Übersicht
Die Transaminierung ist eine wichtige Reaktion der Aminosäuren im Stoffwechsel. Sie dient zur Synthese von Aminosäuren, von denen der Körper zu wenig hat, aus Aminosäuren, die sich im Überschuss befinden.
Bei der Transaminierung wird die Aminogruppe von einer Quell-Aminosäure (Aminosäure im Überschuss) auf eine Ketosäure übertragen - meistens α-Ketoglutarat. Dabei entsteht dann die benötigte neue Aminosäure, und die Quell-Aminosäure wird zu einer Ketosäure.
Fallbeispiel: Synthese von Alanin aus Glutaminsäure
Die Aminosäure Alanin kann aus der Aminosäure Glutaminsäure gebildet werden. Dazu wird die Aminogruppe der Glutaminsäure (bzw. des Anions Glutamat) auf Pyruvat übertragen. Pyruvat ist in den Zellen immer vorhanden, denn es ist das Endprodukt der Glycolyse.
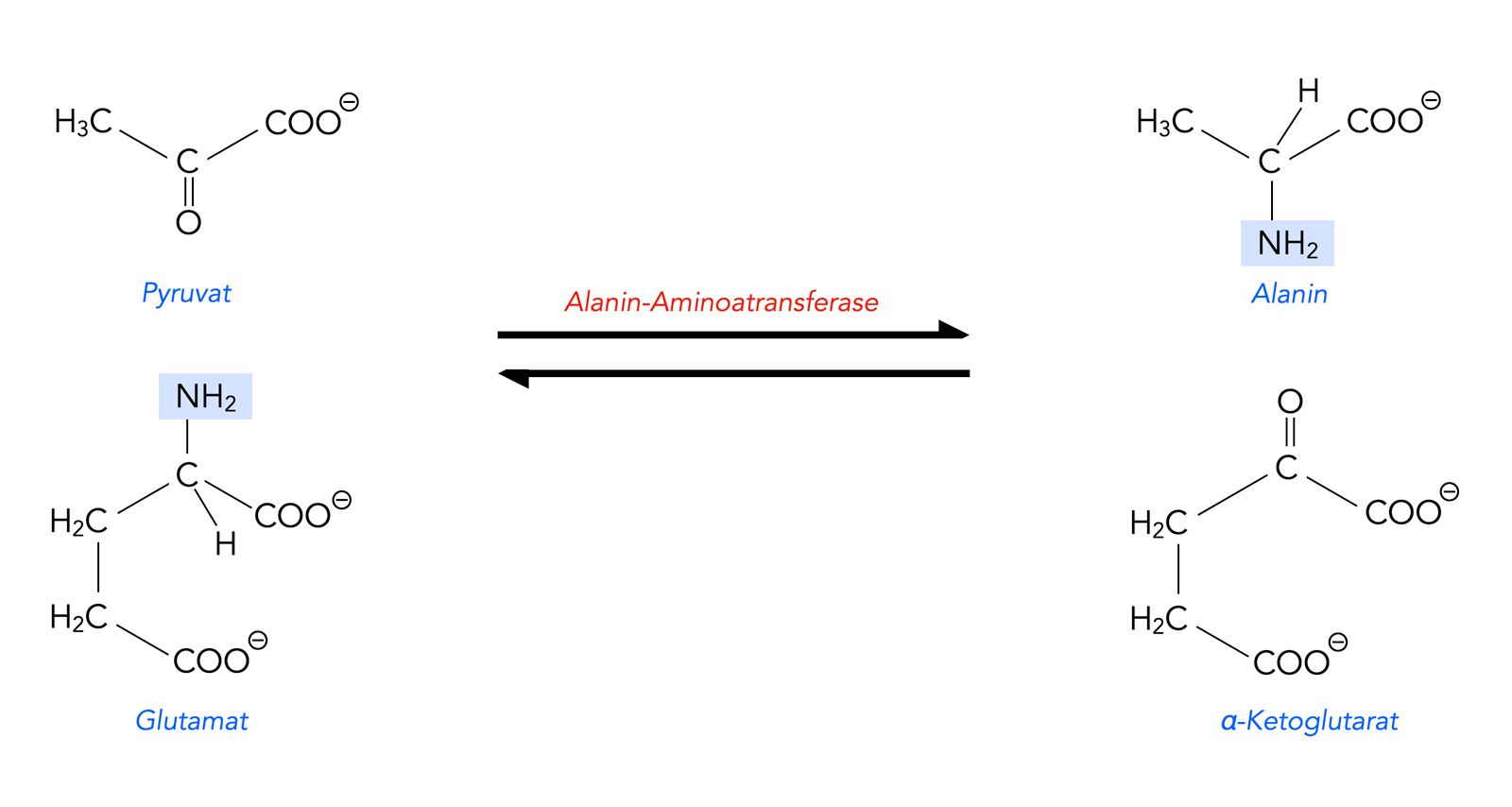
Alanin entsteht aus Pyruvat und Glutamat
Autor: Ulrich Helmich 04/2023, Lizenz: siehe Seitenende
Aus dem Glutamat entsteht dann α-Ketoglutarat.
Das α-Ketoglutarat gehört zu den 2-Oxosäuren. Das sind Carbonsäuren, deren α-C-Atom eine Carbonylgruppe bildet, also eine Keto-Funktion hat. Die allgemeine Struktur der 2-Oxosäuren ist R-CO-COOH.
Katalysiert wird diese voll reversible Reaktion durch das Enzym Alanin-Aminotransferase. Diese Reaktion wird übrigens im Körper auch genutzt, um Pyruvat und Glutamat aus Alanin und α-Ketoglutarat herzustellen, wenn entsprechender Bedarf besteht.
Eine solche Transaminierung spielt auch bei der energetischen Verwertung von Aminosäuren eine Rolle, die mit der Nahrung aufgenommen wurden. Die aufgenommenen Aminosäuren werden desaminiert (NH2-Gruppe wird entfernt), und das übrig gebliebene Kohlenstoff-Gerüst wird in den Citratzyklus eingespeist, wo es dann zur Energiegewinnung dient. Die abgespaltene Aminogruppe wird dann auf andere chemische Verbindungen übertragen, also handelt es sich insgesamt ebenfalls um eine Transaminierung.
Einen genaueren Überblick finden Sie in diesem Wikipedia-Artikel
Desaminierung
Bei der Transaminierung wird, wie wir eben gesehen haben, eine Aminogruppe von einer Aminosäure auf eine Ketosäure übertragen, so dass eine neue Aminosäure entsteht.
Bei der Desaminierung dagegen gibt eine Aminosäure ihre Aminogruppe ab, ohne dass eine neue Aminosäure gebildet wird. Aus der abgegebenen Aminogruppe wird dann Ammoniak NH3, das aber sehr giftig ist und daher schnell weiterverarbeitet werden muss. Diese Reaktion findet in der Leber statt, dabei wird aus NH3 und CO2 Harnstoff H2N-CO-NH2 hergestellt (Harnstoffzyklus).
Die Desaminierung ist der erste Schritt beim Abbau von Aminosäuren im Stoffwechsel. Es gibt mehrere Formen der Desaminierung, nämlich die oxidative, die nichtoxidative, die hydrolytische und die eliminierende Desaminierung.
Oxidative Desaminierung
Bei dieser Reaktion wird aus einer Aminosäure eine alpha-Ketosäure gebildet, außerdem wird Ammoniak NH3 und Wasserstoff freigesetzt. Das Ammoniak wird im Harnstoffzyklus "entsorgt", der Wasserstoff wird an ein Coenzym gebunden. In den Mitochondrien wird diese Desaminierung durch Glutamat-Dehydrogenase katalysiert, in den Peroxisomen durch Aminosäure-Oxidasen. Die Desaminierung in den Mitochondrien ist für den Stoffwechsel wesentlich wichtiger als der Vorgang in den Peroxisomen.
Nichtoxidative Desaminierung
Diese Art des Desaminierung wird durch Dehydrasen katalysiert, auch hier entstehen alpha-Ketosäuren und Ammoniak aus den Aminosäuren.
Hydrolytische Desaminierung
In der Leber und in der Niere katalysiert die Glutaminase die hydrolytische Desaminierung von Glutamin.
Glutamin gehört zu den Amiden, genauer gesagt, zu den Carbonsäureamiden. Unter einem Carbonsäureamid versteht man eine Carbonsäure, bei deren COOH-Gruppe die OH-Gruppe durch eine Amingruppe ausgetauscht wurde: R-CO-NH2, R-CO-NHR', R-CO-NR'R" oder R-CO-N+R'R"R'".
Auch ein Dipeptid ist strenggenommen ein Amid, denn es entspricht der allgemeinen Struktur R-CO-NH-R'. Die Peptidbindung wird daher auch als Amidbindung bezeichnet.
Bei der Desaminierung wird die Amidgruppe -CO-NH2 in der Seitenkette von Glutamin durch eine OH-Gruppe ersetzt, so dass wieder eine COOH-Gruppe entsteht. Dies ist quasi die Rückreaktion der Amid-Bildung. Bei dieser Hydrolyse entstehen Glutaminsäure und Ammoniak.
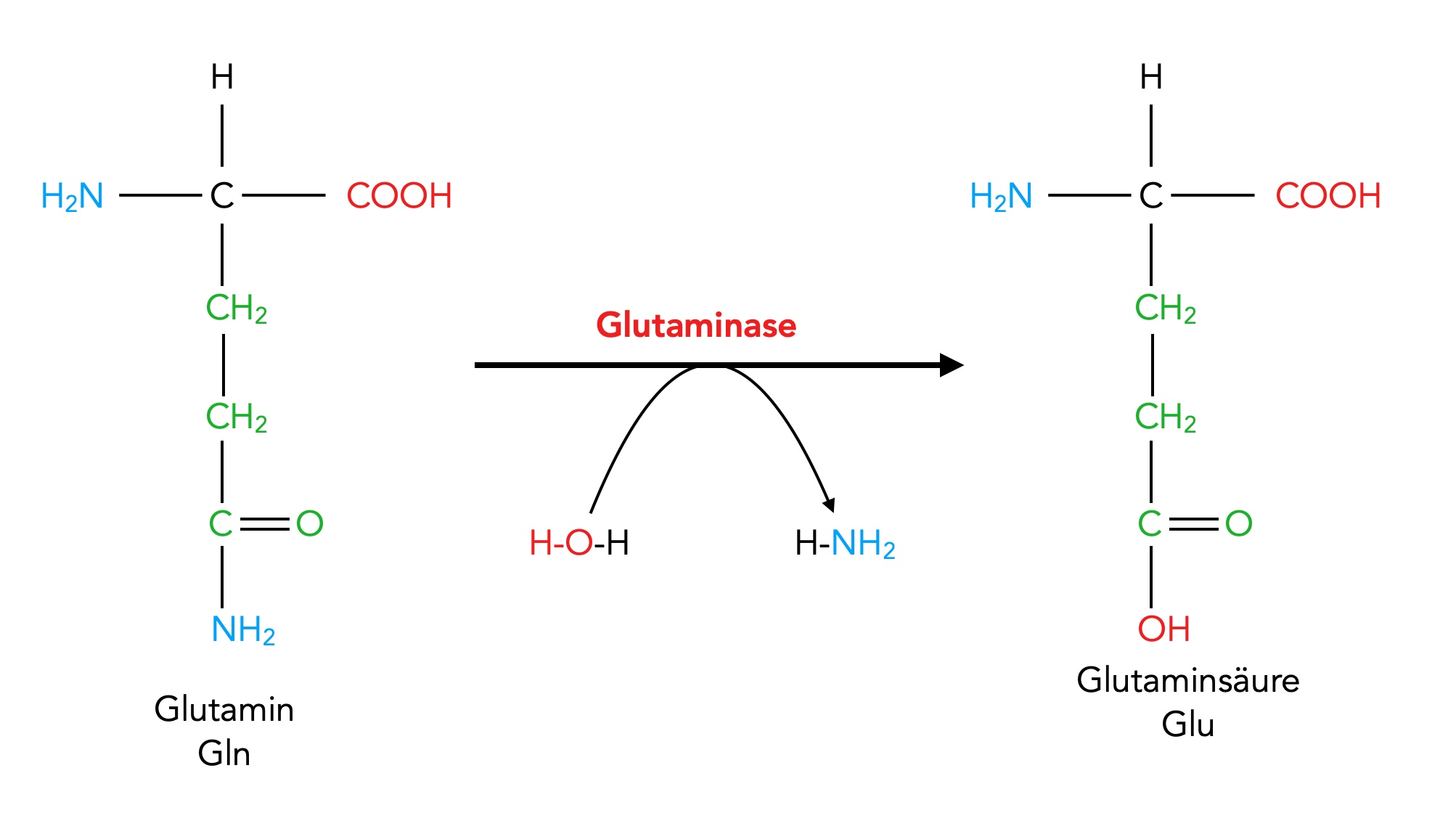
Hydrolytische Desaminierung von Glutamin zu Glutaminsäure
Autor: Ulrich Helmich 03/2024, Lizenz: siehe Seitenende
Die Aspariginase führt eine analoge Reaktion mit Asparagin durch, wobei dann Asparaginsäure und Ammoniak entstehen.
Eliminierende Desaminierung
Diese Art der Desaminierung ist etwas komplexer als die drei anderen Arten. Zunächst wird nämlich eine andere funktionelle Gruppe in der Seitenkette der Aminosäure entfernt, beim Cystein beispielsweise die SH-Gruppe am β-C-Atom. Es bildet sich dann eine Doppelbindung zwischen dem α- und dem β-C-Atom, und erst im nächsten Schritt wird über ein Imino-Zwischenprodukt die NH2-Gruppe abgespalten [3].

Desaminierung von Cystein, Serin und Threonin
Autor: Ulrich Helmich 03/2024, Lizenz: siehe Seitenende
Diese Art der Desaminierung tritt vor allem bei den Aminosäuren Serin, Cystein und Threonin auf. Die ganze Reaktion ist PALP-abhängig, das heißt, Vitamin B6 tritt hier als Cofaktor auf. Serin und Cystein werden auf diese Weise zu Pyruvat umgesetzt, Threonin zu alpha-Ketobutyrat [4].
Medizinische Bedeutung
Eine Desaminierung, die jetzt nichts mit dem Thema "Aminosäuren" zu tun hat, die aber biologisch-medizinisch genau so wichtig ist, ist die Bildung der RNA-Base Uracil aus der DNA-Base Cytosin als Folge einer DNA-Mutation.
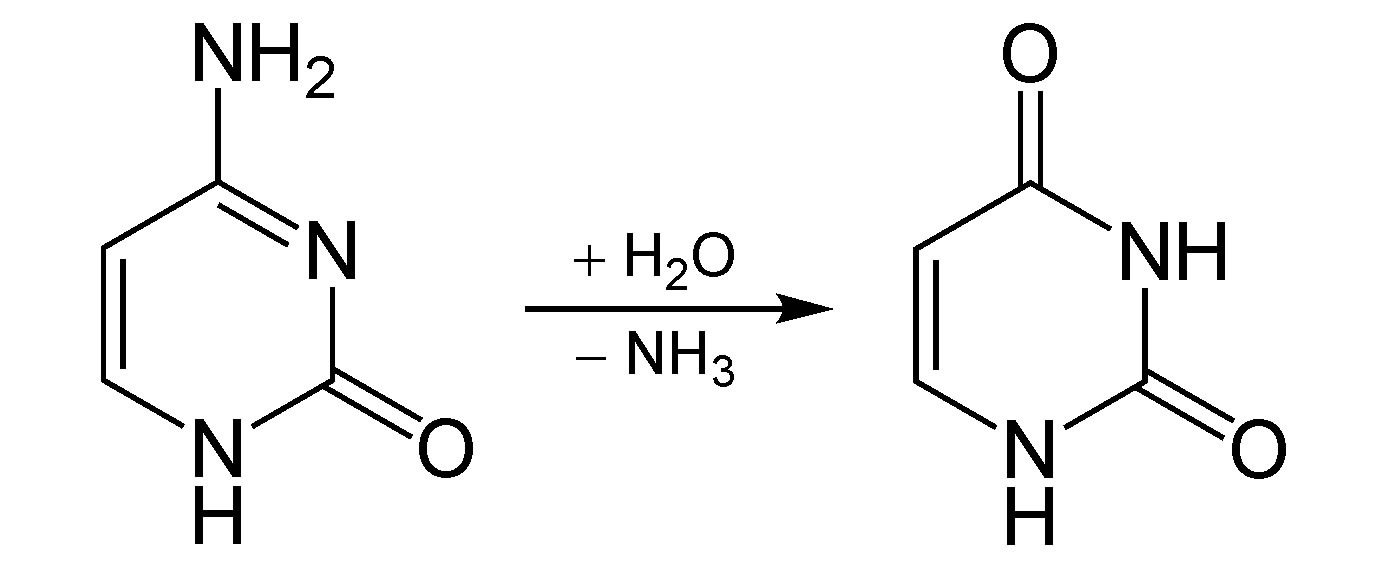
Bildung von Uracil aus Cytosin
Quelle: Wikipedia, Artikel "Uracil", Autor: Yikrazuul, Lizenz: public domain
Bei der Replikation der DNA führt diese Punkt-Mutation dann zu Fehlern. Cytosin paart sich nämlich stets mit Guanin. Durch die Mutation entstandenes Uracil paart sich aber nicht mit Guanin, sondern mit Adenin.
In den DNA-Tochterstrang, der dann synthetisiert wird, wird also Adenin statt Guanin eingebaut. Diese Art der Mutation kommt laut Wikipedia in einer Säugetierzelle ca. 192 mal pro Tag vor.
Transaminierung im Detail
Der erste Schritt bei der Transaminierung ist die Bildung einer Schiff-Base. Wir wollen zunächst diesen ersten Schritt betrachten.
Eine Schiff-Base entsteht, wenn die Aminogruppe eines primären Amins mit der Carbonylgruppe eines Aldehyds oder Ketons reagiert. Chemisch gesehen handelt es sich um eine nucleophile Addition:

Bildung einer Schiff-Base aus einem Aldehyd und einem primären Amin
Autor: Ulrich Helmich 03/2023, Lizenz: siehe Seitenende
Betrachten wir nun die Transaminierung im Detail. Die folgende Abbildung orientiert sich an der Abbildung 14/1 aus dem Zeeck, 9. Auflage [5]:

Transaminierung
Autor: Ulrich Helmich 03/2024, Lizenz: siehe Seitenende
Im ersten Schritt reagiert die Aminosäure mit Pyridoxal-Phosphat, einer aktiven Form des Vitamin B6. Es bildet sich eine Schiff-Base, die sich aber über eine Tautomerie umlagern kann. Durch Hydrolyse trennen sich dann die beiden Komponenten wieder, es entsteht eine alpha-Ketocarbonsäure und das Pyridoxamin-Phosphat, also quasi das Pyridoxal-Phosphat, das die Aminogruppe von der Aminosäure übernommen hat.
Isopeptidbindungen
In dem Gegenstandskatalog wird das Stichwort "Isopeptidbindungen" im Zusammenhang mit Transaminierungen, Desaminierungen, Schiff-Basen, Amiden und 2-Oxosäuren aufgeführt, was reichlich willkürlich erscheint, da dieses Thema nichts mit den anderen Themen zu tun hat. Viel besser hätte dieses Thema zum Punkt 9.1.3.3 - Seitenketten - gepasst.
Die Peptidbindung sollte Ihnen bereits aus dem Schulunterricht (Biologie, Chemie, Ernährungslehre) bekannt sein. Sie bildet sich zwischen der Carboxygruppe einer Aminosäure A und der Aminogruppe der Aminosäure B.
Nun haben aber auch basische Aminosäuren (Arginin, Lysin) eine Aminogruppe in der Seitenkette, während saure Aminosäuren (Glutaminsäure, Asparaginsäure) eine COOH-Gruppe in der Seitenkette haben.
Auch hier kann eine Peptidbindung entstehen. Die Aminogruppe in der Seitenkette von Lysin kann beispielsweise eine kovalente Peptidbindung mit der Carboxygruppe in der Seitenkette von Glutaminsäure bilden.

Peptidbindung, Isopeptidbindung und Ionenbindung im Vergleich
Autor: Ulrich Helmich 03/2024, Lizenz: siehe Seitenende
Diese kovalente Isopeptidbindung unterscheidet sich von der Ionenbindung, die entsteht, wenn sich die positiv geladene NH3+-Gruppe von Lysin mit der negativ geladenen COO--Gruppe von Glutaminsäure verbindet.
Isopeptidbindungen führen ähnlich wie Disulfidbrücken zu einer kovalenten Quervernetzung von Proteinketten. Transglutaminasen katalysieren diese Reaktion [6].
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Spektrum Kompaktlexikon der Biologie, Artikel "Desaminierung"
- DocCheck Flexikon, Artikel "Desaminierung"
- Zeeck, Grond, Zeeck: Chemie für Mediziner, 9. Auflage, München 2017.
- DocCheck Flexikon, Artikel "Isopeptidbindung"
Seitenanfang -
Weiter mit hydrophoben und hydrophilen Aminosäure-Resten...