Aufgabe 1
Stellen Sie die hier dargestellten Vorgänge der Oxidation eines Alkohols mit Hilfe von Kupfer am Beispiel des Ethanols übersichtlich und schematisch mit vollständigen Reaktionsgleichungen dar. Gehen Sie dabei besonders auf die relevanten Bindungselektronen in dem Ethanol-Molekül ein (C-H-Bindung der CH2-Gruppe und O-H-Bindung der OH-Gruppe).
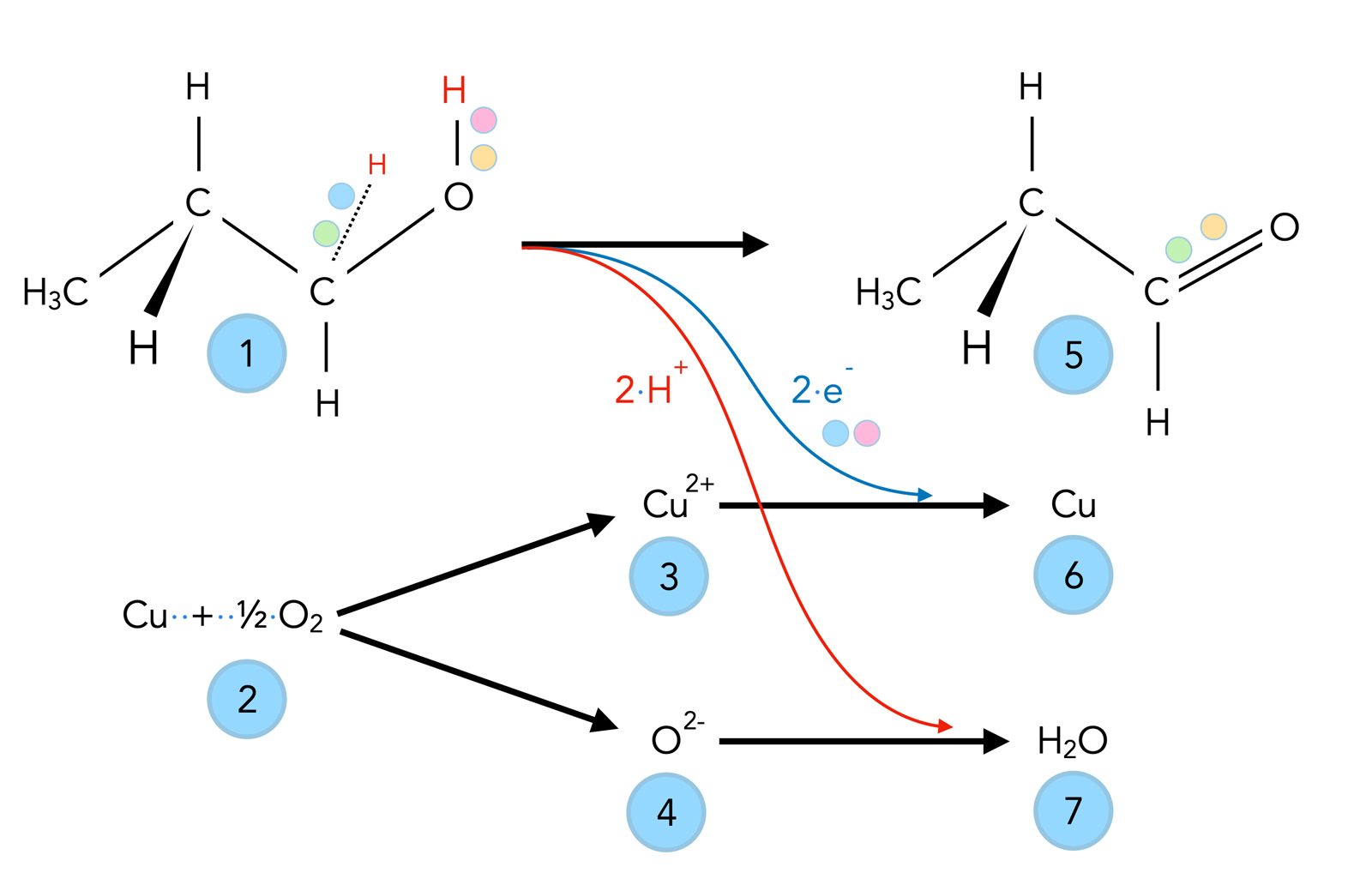
Oxidation eines primären Alkohols mit Kupferoxid CuO
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
In dieser schematischen Darstellung wurden einige relevante Elektronen der Moleküle farblich gekennzeichnet, um einen besseren Überblick zu erhalten.
Die Reaktion beginnt bei (2) mit der Oxidation von Kupfer zu Cu2+- und O2- - Ionen.
Die Kupfer-Kationen nehmen dann zwei Elektronen vom Ethanol auf (3)→(6) und werden dadurch reduziert, während der Alkohol oxidiert wird (5). Wie man an den farbig gekennzeichneten Elektronen erkennen kann, stammt das eine Elektron aus der C-H-Bindung des Ethanols, das andere aus der O-H-Bindung. Das andere Elektron der C-H-Bindung schließt sich mit dem zweiten Elektron der O-H-Bindung mit der bereits bestehenden C-O-Einfachbindung zu einer C=O-Doppelbindung zusammen. Es entsteht Acetaldehyd bzw. Ethanal.
Durch das Auflösen der C-H- und der O-H-Bindung und das gleichzeitige Abgeben von zwei Elektronen bilden sich zwei Protonen. Diese reagieren dann mit den Sauerstoff-Anionen zu Wasser (4) → (7).