Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
- Estersynthese
- funktionelle Gruppen verschiedener Stoffklassen und ihre Nachweise:
Hydroxy-Gruppe, Carbonyl-Gruppe, Carboxy-Gruppe und Ester-Gruppe - Eigenschaften ausgewählter Stoffklassen:
Löslichkeit, Schmelztemperatur, Siedetemperatur - intermolekulare Wechselwirkungen
*nach dem Kernlehrplan des Landes NRW 2022
Schauen wir uns ein typisches Carbonsäureester-Molekül einmal näher an:
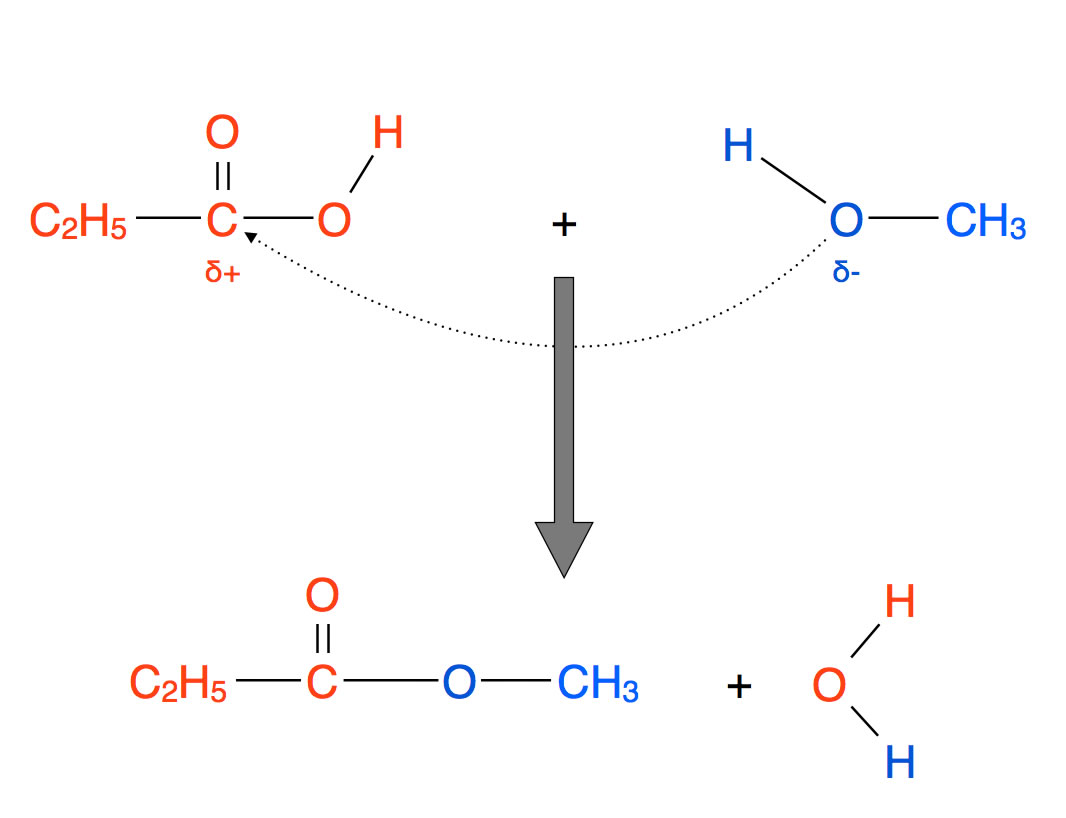
Bildung eines Esters
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Dann überlegen wir einmal, wie die Siedetemperatur und die Wasserlöslichkeit eines solchen Carbonsäure-Esters aussehen könnten - bevor wir einfach in der Wikipedia recherchieren. Aber wir wollen ja schließlich unser chemisches Verständnis (Struktur-Eigenschafts-Konzept) schulen.
Siedetemperaturen
Wenn man herausfinden möchte, ob eine Verbindung oder eine ganze Stoffklasse niedrige, mittelhohe oder sehr hohe Siedetemperaturen hat, dann muss man sich selbst zwei Fragen stellen und diese beantworten.
Die erste Frage, die man sich stellen muss, ist die:
1. Können Ester-Moleküle untereinander H-Brücken bilden?
Offensichtlich ist das nicht möglich. Es sind zwar zwei Sauerstoff-Atome im Ester vorhanden, die als H-Brücken-Akzeptoren wirken könnten, aber kein H-Atom, das ein H-Brücken-Donator ist. Alle H-Atome des Esters sitzen an C-Atomen, die C-H-Bindung ist sehr unpolar, und das ist keine gute Voraussetzung für einen H-Brücken-Donator.
Daraus folgt nun, dass die Siedetemperaturen der Ester deutlich niedriger sind als die der entsprechenden Alkohole und Carbonsäuren. Denn die Moleküle beider Stoffgruppen können untereinander H-Brücken bilden.
Die zweite Frage, die sich ebenfalls auf die Siedetemperatur bezieht, ist diese:
2. Sind Ester-Moleküle gute permanente Dipole?
Das ist in der Tat der Fall. Die beiden O-Atome haben eine hohe Elektronegativität und ziehen daher Bindungselektronen an. Das C-Atom der Carbonyl-Gruppe sollte positiv polarisiert sein, die O-Atome negativ. Ester sind also mehr oder weniger gute permanente Dipole, so dass zwischen den Molekülen relativ starke intermolekulare Anziehungskräfte herrschen. Genauer gesagt, die Keesom-Wechselwirkungen. Die Keesom-Kräfte gehören übrigens zu den van-der-Waals-Wechselwirkungen (neben den London- und Debye-Kräften).
Aus dieser Erkenntnis folgt jetzt, dass die Siedetemperaturen der Ester deutlich höher sein sollten als die entsprechender Alkane.
Nun sind wir so weit, dass wir die Siedetemperaturen einiger Ester in der Wikipedia recherchieren und mit den Siedetemperaturen der Ausgangsstoffe sowie mit den Siedetemperaturen ungefähr gleich großer Alkohole* und Carbonsäuren* vergleichen. Beginnen wir mit dem einfachsten Carbonsäure-Ester überhaupt, dem Ameisensäuremethylester bzw. dem Methylmethanoat:
Der Siedepunkt dieser Verbindung liegt bei 32 ºC. Die Ausgangsstoffe Methanol und Methansäure haben Siedetemperaturen von 65 ºC bzw. 101 ºC - obwohl beide eine geringere Molmasse besitzen als der Ester. Säuren und Alkohole mit der gleichen Molmasse haben dann noch höhere Siedetemperaturen - da müssen wir erst gar nicht recherchieren.
Ameisensäuremethylester hat eine molare Masse von ca. 60 g/mol. Der Siedepunkt von Butan (58,12 g/mol) liegt bei -0,5 ºC, ist also tatsächlich deutlich niedriger als der von Ameisensäuremethylester.
Aufgabe 1
Überprüfen Sie nach dem gleichen Muster die Siedetemperatur von Essigsäureethylester bzw. Ethylethanoat.
Die Lösung dieser Aufgabe müssen Sie jetzt ausnahmsweise einmal selbst herausfinden.
Wasserlöslichkeit
Auch hier wollen wir wieder zunächst überlegen, bevor wir in Büchern oder in der Wikipedia nachschlagen. Um die Wasserlöslichkeit einer organischen Verbindung zu beurteilen, muss man sich ebenfalls zwei Fragen stellen.
1. Können die Moleküle der Verbindung H-Brücken mit H2O-Molekülen bilden?
Das ist bei Carbonsäure-Estern tatsächlich der Fall. Die beiden O-Atome können als H-Brücken-Akzeptoren auftreten. Im Prinzip sollten Carbonsäure-Ester also wasserlöslich sein.
Die zweite Frage lautet:
2. Besitzt das Molekül große Alkyl-Gruppen (oder andere hydrophobe Gruppierungen) ?
Bei "kleinen" Estern ist das nicht der Fall. Carbonsäure-Ester mit Methyl- oder Ethyl-Gruppen sollten gut wasserlöslich sein. Je länger die beiden Alkyl-Gruppen sind, desto geringer wird die Wasserlöslichkeit sein. Ein Ester aus Hexansäure und Hexanol wird mit Sicherheit nicht mehr wasserlöslich sein.
Nachdem wir das Grundsätzliche geklärt haben, schauen wir uns die Wasserlöslichkeit einiger Ester mal näher an.
Ameisensäureethylester (2 C-Atome) ist gut in Wasser löslich, bei 20 ºC lösen sich bis zu 300 g Ester in einem Liter Wasser.
Essigsäureethylester (4 C-Atome) ist auch noch wasserlöslich. Die Wasserlöslichkeit beträgt aber nur noch 85 g/l, ist also schon deutlich niedriger als die des einfachsten Esters.
Essigsäurebutylester (6 C-Atome) ist kaum noch wasserlöslich: 4,3 g/l.
Buttersäurebutylester (8 C-Atome) schließlich ist so gut wie gar nicht mehr löslich in Wasser 0,50 g/l.
Nachtrag zu den Fragen zur Wasserlöslichkeit
Bei organischen Ionen muss man sich eine dritte Frage stellen, wenn man die Wasserlöslichkeit beurteilen will:
3. Ist das Atom mit der positiven oder negativen Ladung relativ frei zugänglich für Wasser-Moleküle?
Wenn das der Fall ist, dann kann sich um dieses Ion eine Hydrathülle bilden, ähnlich wie bei anorganischen Ionen im Wasser. Und wenn sich eine Hydrathülle bilden kann, heißt das in der Regel auch, dass die Verbindung gut wasserlöslich ist - auch wenn die Ionen keine H-Brücken mit H2O-Molekülen bilden können.
Oft ist das geladene C-, N- oder O-Atom aber von Alkyl-Gruppen oder anderen Atomgruppen umgeben, so dass die Wasser-Moleküle nur schlechten Zutritt haben. Es bildet sich dann keine Hydrathülle um das Molekül.